Etude De La Croissance De La Levure Et
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

130512213.23.Pdf
ABS.1.7S.37? i » THE VINTNER, AND SPIRIT DEALER’S CONTAINING A GREAT VARIETY OF THE MOST APPROVED RECIPES, FOR THE MAKING, MIXING, MANAGING, FLAVOURING, COLOURING, AND BOTTLING, FOREIGN AND BRITISH SPIRITS, PORTER, AND ALES. ADAPTED TO EVERY BRANCH OF THE WINE, PORTER, ALE, AND SPIRIT TRADE. BY ALEXANDER PEDDIE, Author of the Cottonand Linen Weaver’s Assistant, Practical Measurer,’ ©la^gnln, PUBLISHED BY KHULL, BLACKIE, & CO. AND ARCHIBALD FULLARTON & CO. EDINBURGH. 1835. ENTERED IN STATIONERS HALL. O' B THE FOLLOWING RECIPES, NOTES, AND INSTRUCTIONS, Upon the MAKING, MIXING, AND PROPER MANAGEMENT OF WINES, PORTER, ALES, AND SPIRITS, ARE RESPECTFULLY DEDICATED, TO THE WINE MERCHANTS, SPIRIT DEALERS, AND BREWERS OF ^cotlantr, (ffiiiglanlf, anU Srclanir, BY ALEX. PEDDIE. ■ > PREFACE. T o say much upon the usefulness and importance of a work of this kind, would be superfluous, vain and idle; the worth of it will be fully appreciated by those for whom it is particularly intended. All that seems necessary is, to give a short outline of the plan of the work, and point out where a little deviation (from the nature of the substances em- ployed), at particular times may be absolutely ne- cessary. It is now a number of years since I formed a de- sign of compiling a work of this kind, for the use of those engaged in the wine and spirit trade; and I would not at this time, in all likelihood, have brought it into the notice of the public, had it not been for the repeated solicitations of many respecta- ble wine merchants and spirit dealers in Edinburgh, Glasgow, Greenock, and other places, to whom I shewed the manuscript copy, that I might receive their opinion upon its merits. -

The Wines of the Bible
The Wines of the Bible THE WINES OF THE BIBLE AN EXAMINATION AND REFUTATION OF THE UNFERMENTED WINE THEORY BY THE REV. A.M. WILSON LONDON: HAMILTON, ADAMS & CO. EDINBURGH: ANDREW ELLIOT. GLASGOW: THOMAS D. MORISON MANCHESTER: JOHN BOYD 1877 2 The Wines of the Bible Preface The question as to the nature of Ancient Wines in general, and of the Wines of the Bible in particular, has been forced into special prominence by recent discussions of the Wine of the Communion. Whether the writer of the following pages has been successful in exhibiting the true nature of these Wines, or has failed in the effort, he has at least, the satisfaction of knowing that he has done what he could. Having been a teetotaler for more than thirty years, his personal habits, associations, and sympathies have all been in favor of the unfermented theory; but the facts encountered in the present investigation, have constrained him, reluctantly, to conclude that, so far as the Wines of the Ancients are concerned, Unfermented Wine is a myth. E. U. Manse, Bathgate, April, 1877 3 The Wines of the Bible Publishers Introduction It is with extreme pleasure to reproduce A.M. Wilson’s epic book, “The Wines of the Bible.” It has been out of print for years and almost impossible to obtain a copy. This present reproduction was taken from photo copies obtained over 30 years ago from a borrowed library loan copy. The following pages were hand typed over many hours and so all spelling errors are due to the present publisher rather than the original copy used. -

Politecnico Di Torino
POLITECNICO DI TORINO Collegio di Ingegneria Gestionale Master of Science Degree in Engineering and Management Master of Science Thesis Analysis of the craft beer movement in Italy Supervisor Candidate Prof. Luigi Benfratello Tommaso Magrì Academic Year 2018/2019 2 Summary The purpose of this thesis is to describe the current state of the beer market in Italy with a qualitative and quantitative focus on craft breweries. Since it has been influencing the demand and setting new minimum quality levels, the Italian craft beer movement has become more important in recent years. The first chapter analyses the concept of beer: its origin and how it has evolved over the centuries, the raw materials of which it is composed and its production process. Furthermore, this chapter provides a brief description of the differences in the production process between industrial and craft beer. The second chapter begins with a general overview of the global beer market: some parameters (like market size, growth rates and trends) are provided. Furthermore, an in-depth analysis of three continents (and respective countries), where the largest amount of beer is produced, is carried out: Asia (China), America (USA) and Europe (United Kingdom), with an overview of their craft beer movements. The third chapter focuses on the Italian beer market. It begins with an analysis of the Italian legislation and continues with a snapshot view of the sector. The displayed data and numbers help the reader to understand the market situation: production and consumption, imports and exports, main competitors, distribution channels and suppliers are taken into consideration. The fourth chapter deals with an empirical analysis of a sample of brewing firms. -

Spokane's Ale Trail
Produced with support from Spokane County TPA funds. TPA County Spokane from support with Produced steamplantbrewingco.com inlandnwaletrail.com laughingdogbrewing.com SelkirkAbbey.com 12stringbrewingco.com that celebrate the best our region has to offer. to has region our best the celebrate that working with local farmers and ranchers to create dishes dishes create to ranchers and farmers local with working every palate that is sure to please. to sure is that palate every It’s not for the masses, it’s for you. for it’s masses, the for not It’s Friday nights. nights. Friday Ale). We pair these with a menu made from scratch, scratch, from made menu a with these pair We Ale). Stout and delicate Pilsner, we offer something for for something offer we Pilsner, delicate and Stout medal winning hand crafted ales. crafted hand winning medal variety of tasty snacks and have live music many many music live have and snacks tasty of variety popular (Double Stack Stout) to the most unique (Jalapeño (Jalapeño unique most the to Stout) Stack (Double popular way. From our Fresh Hop Ale and IPA to our Imperial Imperial our to IPA and Ale Hop Fresh our From way. Belgium and Northern France. Come try one of our gold our of one try Come France. Northern and Belgium of specialty barrel aged beers. We also serve a a serve also We beers. aged barrel specialty of ranging from our lightest (Blonde) to the darkest and most most and darkest the to (Blonde) lightest our from ranging from coast to coast, and winning awards along the the along awards winning and coast, to coast from Farmhouse style ales that originated centuries ago in in ago centuries originated that ales style Farmhouse experimental beer and an ever increasing selection selection increasing ever an and beer experimental Register. -

Pro Fin Rap.Pdf
AVERTISSEMENT PREALABLE Le présent document a été réalisé par des étudiants du Master Pro Qualimapa (USTL-Lille) dans le cadre de leur scolarité. Il n’a pas un caractère de publication scientifique au sens strict. En effet, il n’a pas été soumis à un comité de lecture avant publication. Ce travail a été noté, ainsi que la soutenance orale et l’éventuelle production multimédia auxquelles il a donné lieu. Ces évaluations participent à l’évaluation globale des étudiants en vue de l’obtention du diplôme de Master ; elles ont un caractère privé et ne sont pas communiquées ici. Le contenu de ce document est donc proposé sous la seule responsabilité de leurs auteurs et doit être utilisé avec les précautions d'usage. C’est pourquoi le lecteur est invité à exercer son esprit critique. Sa reproduction, totale ou partielle, est autorisée à condition que son origine et ses auteurs soient explicitement cités. La liste des autres projets étudiants disponibles en ligne est disponible sur le site Internet du Master Qualimapa : http://qualimapa.univ-lille1.fr/rapp1.htm L’équipe enseignante BIGOINSophie SALOME David BR UGNONI Laure SELLIER Sébastien GAYE Anne-Sophie SERRAND Anne- Claire HOCHARTStéphane VANCE ULEN Patricia LE VILAIN Patricia VIALARONPascal La Filière Bière I.A.A. L. I.A.E. Ali terme de ce travail nous tenons à remercier tout particulièrement : - Madame Bertout pour son soutien et sa disponibilité, - Les professeurs tuteurs de ce projet : Mademoiselle Van Hecke et Messieurs Bounie et Lenglet, - Tous les professionnels qui nous ont accordé un peu de leur temps lors d'entretiens et de visites, ainsi que de précieuses informations. -

Beer, Barbarism, and the Church from Late Antiquity to the Early Middle Ages
University of Tennessee, Knoxville TRACE: Tennessee Research and Creative Exchange Masters Theses Graduate School 5-2007 Beer, Barbarism, and the Church from Late Antiquity to the Early Middle Ages Joseph Wayne Strickland University of Tennessee - Knoxville Follow this and additional works at: https://trace.tennessee.edu/utk_gradthes Part of the History of Religion Commons Recommended Citation Strickland, Joseph Wayne, "Beer, Barbarism, and the Church from Late Antiquity to the Early Middle Ages. " Master's Thesis, University of Tennessee, 2007. https://trace.tennessee.edu/utk_gradthes/325 This Thesis is brought to you for free and open access by the Graduate School at TRACE: Tennessee Research and Creative Exchange. It has been accepted for inclusion in Masters Theses by an authorized administrator of TRACE: Tennessee Research and Creative Exchange. For more information, please contact [email protected]. To the Graduate Council: I am submitting herewith a thesis written by Joseph Wayne Strickland entitled "Beer, Barbarism, and the Church from Late Antiquity to the Early Middle Ages." I have examined the final electronic copy of this thesis for form and content and recommend that it be accepted in partial fulfillment of the equirr ements for the degree of Master of Arts, with a major in History. Michael Kulikowski, Major Professor We have read this thesis and recommend its acceptance: Christine Shepardson, Robert Bast Accepted for the Council: Carolyn R. Hodges Vice Provost and Dean of the Graduate School (Original signatures are on file with official studentecor r ds.) To the Graduate Council: I am submitting herewith a thesis written by Joseph Wayne Strickland entitled “Beer, Barbarism, and the Church from Late Antiquity to the Early Middle Ages.” I have examined the final electronic copy of this thesis for form and content and recommend that it be accepted in partial fulfillment of the requirements for the degree of Master of Arts, with a major in History. -

A History of Beer in Ancient Europe
University of Windsor Scholarship at UWindsor Languages, Literatures and Cultures Department of Languages, Literatures and Publications Cultures 2005 The Barbarian's Beverage: A History of Beer in Ancient Europe Max Nelson University of Windsor Follow this and additional works at: https://scholar.uwindsor.ca/llcpub Part of the Modern Languages Commons, and the Modern Literature Commons Recommended Citation Nelson, Max. (2005). The Barbarian's Beverage: A History of Beer in Ancient Europe. https://scholar.uwindsor.ca/llcpub/26 This Book is brought to you for free and open access by the Department of Languages, Literatures and Cultures at Scholarship at UWindsor. It has been accepted for inclusion in Languages, Literatures and Cultures Publications by an authorized administrator of Scholarship at UWindsor. For more information, please contact [email protected]. THE BARBARIAN’S BEVERAGE THE BARBARIAN’S BEVERAGE A History of Beer in Ancient Europe Max Nelson First published 2005 by Routledge 2 Park Square, Milton Park, Abingdon, Oxon OX14 4RN Simultaneously published in the USA and Canada by Routledge 270 Madison Avenue, New York, NY 10016 Routledge is an imprint of the Taylor & Francis Group This edition published in the Taylor & Francis e-Library, 2004. “To purchase your own copy of this or any of Taylor & Francis or Routledge’s collection of thousands of eBooks please go to www.eBookstore.tandf.co.uk.” © 2005 Max Nelson All rights reserved. No part of this book may be reprinted or reproduced or utilised in any form or by any electronic, mechanical, or other means, now known or hereafter invented, including photocopying and recording, or in any information storage or retrieval system, without permission in writing from the publishers. -
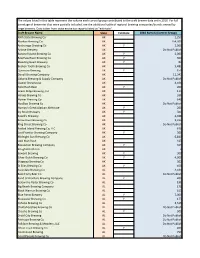
H.710: National Barrelage Data
The values listed in this table represent the volume each control group contributed to the craft brewer data set in 2016. For full barrelage of breweries that were partially included, see the additional table of regional brewing companies/brands owned by large brewers. Data taken from state excise tax reports listed as "estimate". Craft Brewer Name State Estimate 2016 Barrels (Control Group) 49th State Brewing Co AK 1,250 Alaskan Brewing Co AK 154,300 Anchorage Brewing Co AK Y 2,000 Arkose Brewery AK Do Not Publish Baranof Island Brewing Co AK Y 2,000 BearPaw River Brewing Co AK Y 300 Bleeding Heart Brewery AK Y 80 Broken Tooth Brewing Co AK 5,481 Cynosure Brewing AK Y 150 Denali Brewing Company AK 11,341 Gakona Brewing & Supply Company AK Do Not Publish Glacier Brewhouse AK 4,101 Gold Rush Beer AK Y 200 Grace Ridge Brewing, Inc AK 110 Haines Brewing Co AK 336 Homer Brewing Co AK 648 HooDoo Brewing Co AK Do Not Publish Humpy's Great Alaskan Alehouse AK Y 200 Icy Strait Brewery AK Y 500 Kassik's Brewery AK 2,048 Kenai River Brewing Co AK 2,236 King Street Brewing Co AK Do Not Publish Kodiak Island Brewing Co, LLC AK 678 Last Frontier Brewing Company AK Y 300 Midnight Sun Brewing Co AK 6,840 Odd Man Rush AK 425 Resolution Brewing Company AK Y 315 RoughWoods Inn AK 2 Seward Brewing AK Y 300 Silver Gulch Brewing Co AK Y 4,000 Skagway Brewing Co AK 302 St Elias Brewing Co AK Y 450 Avondale Brewing Co AL 4,630 Back Forty Beer Co AL Do Not Publish Band of Brothers Brewing Company AL Y 400 Below the Radar Brewing Co AL 196 Big Beach Brewing Company -

Repositorio Digital
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUÍMICA DE ALIMENTOS TÍTULO DEL PROYECTO DE INVESTIGACIÓN: “Desarrollo de un estilo de cerveza artesanal Weissbier “ideal”, mediante caracterización sensorial por método cata y pruebas fisicoquímicas y microbiológicas en tres formulaciones” Trabajo de titulación presentado como requisito previo a la obtención del título de: Químico de Alimentos Autor: Chávez Jácome Jaime Raúl Tutora: MSc. Milene Fernanda Díaz Basantes Quito, Marzo del 2019 ii iii iv Lugar donde se realizó la Investigación La elaboración de la cerveza artesanal de estilo Weissbier se lo realizó en las instalaciones de la empresa de cerveza artesanal ÄquatorBraü, ubicada en la Calle A, Lote 10 y Pablo Herrera, Caspigasi. Mientras que los análisis fisicoquímicos, microbiológicos, se los realizó en la Facultad de Ciencias Químicas de la Universidad Central del Ecuador, en los Laboratorios de Química de Alimentos y Ambiental (OSP) y Laboratorio de Microbiología de Alimentos y las pruebas sensoriales se las realizó en el establecimiento Boho Park, ubicado en las calles Iñaquito y Juan José de Villalengua. v Dedicatoria El presente trabajo de investigación está dedicado a mi padre, que a pesar del poco tiempo que lo tuve conmigo, desde el cielo guio mis pasos y me dio la fortaleza y las ganas de seguir superándome cuando más lo necesitaba. A mi madre, ya que gracias a ella logre convertirme en el profesional que soy ahora, por el ser el pilar fundamental en mi educación, por sacarme a mí y a mis hermanos adelante, por su apoyo incondicional en mis estudios y simplemente por ser la mejor mamá del mundo. -

The Beginnings of Beer in the Ancient World: Greece
The Beginnings of Beer in the Ancient World: Greece Travis Rupp & [email protected] [email protected] Barley for Beer • One of the first alcoholic drinks in the Neolithic Period (c. 6000 BC). • Barley as currency • Staple cereal of ancient Egypt • Residue tests indicate barley beer in Sumeria by 5000 BC • Sumerian Tablet depicting process c. 4000 BC • Listed in Egyptian grave goods c. 2650- 2575 (Tomb of Hekherebau) • Oldest recipe, Sumerian poem honoring Ninkasi (1900 BC) Funerary stele from el-Amarna (c. 1350 BC) • Epic of Gilgamesh (18th century) Tell el-Farkha: (3600-2600 BC) Rise of the Brewing Industry: Egypt 3D Reconstruction of Tell el-Farcha Brewery (c. 3500 BC) 12 x 13 feet ROMAN BREWING? Pliny the Elder (AD 23-79) “A particular intoxication…” (Nat. Hist. 14.29.149) Roman benefits of beer? …lactis potus ossa alit, frugum nervos, aqua carnes (23.22.37). …quorum omnium spuma cutem feminarum in facie nutrit (22.82.164). Floor Malting Born in Europe – AD 179 Above: Reconstruction of the furnace for the kilning floor at Regensburg Left: reconstruction of a medieval chimney, much like the one that Roman Ruin in Regensburg, Germany: The would have covered oldest known Malt House in the world the furnace pit at (constructed AD 179) Regensburg Beer Rations for Soldiers Letter c. AD 100 Decurion Masculus to prefect Flavius Cerialis: Cervesam commilitones non habunt quam rogo iubeas mitti. Atrectus the cervesar[ius[? Birth of beer styles and the cost of a pint… Diocletian’s Tax Reforms and the Cost of Production (AD 284-305) Different terms for different beers? • Cervesia = Celtic wheat beer • Camum = Celtic barley beer • Zythum = Egyptian beer • Sabaia = Beer of Illyricum An Italian Sextarius (Pint) • Celtic beers = 4 denarii • Zythum = 2 denarii • Cheapest wine = 8 denarii Bust of Diocletian r. -

Beer for Men and Gods Brewing in Egypt Under the Ptolemies and the Principate (323 BC – 284 AD)
Beer for Men and Gods Brewing in Egypt under the Ptolemies and the Principate (323 BC – 284 AD) Daan Smets Presented in fulfilment of the requirements for the degree of Master of Arts in Master in de geschiedenis van de Oudheid Promotor: prof. dr. Katelijn Vandorpe Academic year 2018 – 2019 224,538 characters I hereby declare that, in line with the Faculty of Arts’ code of conduct for research integrity, the work submitted here is my own original work and that any additional sources of information have been duly cited. Proem “And… and what is civilization if it isn’t people talking to each other over a goddamned beer?” Fayez said, then lolled his head back over his shoulder. “Am I right?” “Fuckin’ A,” Amos called back. – Page 9, Chapter Twenty: Elvi, Cibola Burn, book 4 of The Expanse.1 Though this observant quote originates from a rather excellent science fiction novel rather than a great work of history, it attests to the significance of beer as a crucial part of the very fabric of society. As a key catalyst in the development of fledgling sedentary settlements and burgeoning empires alike, it brings people together and acts as a key driver of effervescent social interaction, whether it is in a small human colony on a fictional extraterrestrial planet named Ilus, that wretched epicenter of inebriated congregation named Fakbar Letteren or a village perched on the reed-covered banks of the winding river called the Nile. No country’s ancient history and society is more determined by the importance of beer than Egypt (see the map, figure 1). -

Designing an Enregy Neutral Artisan Brewery
DESIGNING AN ENREGY NEUTRAL ARTISAN BREWERY. Marina Esteve Saus Bachelor’s thesis May 2013 Chemical Engineering ABSTRACT Tampereen ammattikorkeakoulu Tampere University of Applied Sciences Chemical Engineering Marina Esteve Saus DESIGNING AN ENERGY NEUTRAL ARTISIAN BREWERY Bachelor's thesis 70 pages, appendices 5 pages May 2013 Due to nowadays’ interest in producing high-quality artisan beer, the aim of this project is to set up an artisan microbrewery as a space attached to a bar or a house in order to make beer (100 l every three weeks). This project studies the raw materials and processes of making beer. It also specifies the necessary equipment to start an artisan microbrewery, capable of producing 100 l of beer every three weeks. In addition, this project estimates the space this microbrewery needs, but most importantly, it studies how the microbrewery can be energy neutral, using a water collection and treatment system, and a solar thermal photovoltaic panels system. During the project, two types of beer are produced in order to have a broader knowledge of the process and to estimate the necessary amounts of ingredients needed in an artisan microbrewery. The project was done using the BeerSmith software. This project could be implemented in any bar or home that has the required space and, as it has to be energy neutral, the microbrewery should be located in a place with a Mediterranean climate. 3 CONTENTS 1 INTRODUCTION ....................................................................................................... 6 2 HISTORY, TYPES OF BEER AND DIFFERNT BREWERIES ............................... 7 2.1 History of beer ..................................................................................................... 7 2.2 Types of beer ........................................................................................................ 9 2.3 Beer in the world ...............................................................................................