Prado Ligiapizzattodo D.Pdf
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Khalladi-Bpp Anexes-Arabic.Pdf
Khalladi Windfarm and Power Line Projects Biodiversity Protection Plan, July 2015 107 Khalladi Windfarm and Power Line Projects Biodiversity Protection Plan, July 2015 108 Khalladi Windfarm and Power Line Projects Biodiversity Protection Plan, July 2015 109 Khalladi Windfarm and Power Line Projects Biodiversity Protection Plan, July 2015 110 Khalladi Windfarm and Power Line Projects Biodiversity Protection Plan, July 2015 111 Khalladi Windfarm and Power Line Projects Biodiversity Protection Plan, July 2015 112 Khalladi Windfarm and Power Line Projects Biodiversity Protection Plan, July 2015 113 The IUCN Red List Categories and Criteria are intended to be an easily and widely understood system for classifying species at high risk of global extinction. The IUCN Red List is categorized in the following Categories: • Extinct (EX): A taxon is Extinct when there is no reasonable doubt that the last individual has died. A taxon is presumed Extinct when exhaustive surveys in known and/or expected habitat, at appropriate times (diurnal, seasonal, annual), throughout its historic range have failed to record an individual. Surveys should be over a time frame appropriate to the taxon’s life cycle and life form. Khalladi Windfarm and Power Line Projects 114 Biodiversity Protection Plan, July 2015 • Extinct in the Wild (EW): A taxon is Extinct in the Wild when it is known only to survive in cultivation, in captivity or as a naturalized population (or populations) well outside the past range. A taxon is presumed Extinct in the Wild when exhaustive surveys in known and/or expected habitat, at appropriate times (diurnal, seasonal, annual), throughout its historic range have failed to record an individual. -
B I R D W a T C H I N G •
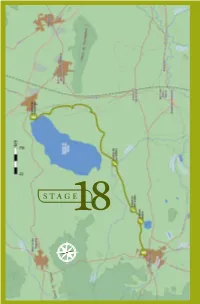
18 . F UENTE DE PIEDRA - CAMPILLOS STAGE18 E S N O 158 BIRDWATCHING • GR-249 Great Path of Malaga F UENTE DE PIEDRA - CAMPILLOS 18 . STAGE 18 Fuente de Piedra - Campillos L O C A T I O N he José Antonio Valverde Visitor´s Centre at the TReserva Natural de la Laguna de Fuente de Piedra is the starting point of Stage 18. Taking the direction south around the taken up mainly by olive trees and grain. eastern side of the salt water lagoon This type of environment will continue to you will be walking through farmland the end of this stage and it determines until the end of this stage in Campillos the species of birds which can be seen village. The 15, 7 km of Stage 18 will here. You will be crossing a stream and allow you to discover this wetland well then walking along the two lakes which known at national level in Spain, and will make your Stage 18 bird list fill cultivated farmland which creates a up with highly desirable species. The steppe-like environment. combination of wetland and steppe creates very valuable habitats with DESCRIPTION a rare composition of taxa unique at European level. ABOUT THE BIRDLIFE: Stage 18 begins at the northern tip HIGHLIGHTED SPECIES of the lagoon where you take direction Neither the length, diffi culty level or south through agricultural environment, elevation gain of this stage is particularly DID YOU KNOW? ecilio Garcia de la Leña, in Conversation 9th of “Historical Conversations of Malaga” published by Cristóbal Medina Conde (1726-1798) and entitled «About Animal Kingdom of Malaga and some Places in its Bishopric», Ccomments: «…In some lagoons, along sea shores and river banks some large and beautiful birds breed, called Flamingos and Phoenicopteros according to the ancients...», after a description of the bird´s anatomy he adds: «The Romans appreciated the bird greatly, especially its tongue which was served as an exquisite dish…». -

Tail Breakage and Predatory Pressure Upon Two Invasive Snakes (Serpentes: Colubridae) at Two Islands in the Western Mediterranean
Canadian Journal of Zoology Tail breakage and predatory pressure upon two invasive snakes (Serpentes: Colubridae) at two islands in the Western Mediterranean Journal: Canadian Journal of Zoology Manuscript ID cjz-2020-0261.R2 Manuscript Type: Article Date Submitted by the 17-Jan-2021 Author: Complete List of Authors: Febrer-Serra, Maria; University of the Balearic Islands Lassnig, Nil; University of the Balearic Islands Colomar, Victor; Consorci per a la Recuperació de la Fauna de les Illes Balears Draft Sureda Gomila, Antoni; University of the Balearic Islands; Carlos III Health Institute, CIBEROBC Pinya Fernández, Samuel; University of the Balearic Islands, Biology Is your manuscript invited for consideration in a Special Not applicable (regular submission) Issue?: Zamenis scalaris, Hemorrhois hippocrepis, invasive snakes, predatory Keyword: pressure, Balearic Islands, frequency of tail breakage © The Author(s) or their Institution(s) Page 1 of 34 Canadian Journal of Zoology 1 Tail breakage and predatory pressure upon two invasive snakes (Serpentes: 2 Colubridae) at two islands in the Western Mediterranean 3 4 M. Febrer-Serra, N. Lassnig, V. Colomar, A. Sureda, S. Pinya* 5 6 M. Febrer-Serra. Interdisciplinary Ecology Group. University of the Balearic Islands, 7 Ctra. Valldemossa km 7.5, 07122 Palma, Balearic Islands, Spain. E-mail address: 8 [email protected]. 9 N. Lassnig. Interdisciplinary Ecology Group. University of the Balearic Islands, Ctra. 10 Valldemossa km 7.5, 07122 Palma, Balearic Islands, Spain. E-mail address: 11 [email protected]. 12 V. Colomar. Consortium for the RecoveryDraft of Fauna of the Balearic Islands (COFIB). 13 Government of the Balearic Islands, Spain. -

A Diverse Snake Fauna from the Early Eocene of Vastan Lignite Mine, Gujarat, India
A diverse snake fauna from the early Eocene of Vastan Lignite Mine, Gujarat, India JEAN−CLAUDE RAGE, ANNELISE FOLIE, RAJENDRA S. RANA, HUKAM SINGH, KENNETH D. ROSE, and THIERRY SMITH Rage, J.−C., Folie, A., Rana, R.S., Singh, H., Rose, K.D., and Smith, T. 2008. A diverse snake fauna from the early Eocene of Vastan Lignite Mine, Gujarat, India. Acta Palaeontologica Polonica 53 (3): 391–403. The early Eocene (Ypresian) Cambay Formation of Vastan Lignite Mine in Gujarat, western India, has produced a di− verse assemblage of snakes including at least ten species that belong to the Madtsoiidae, Palaeophiidae (Palaeophis and Pterosphenus), Boidae, and several Caenophidia. Within the latter taxon, the Colubroidea are represented by Russel− lophis crassus sp. nov. (Russellophiidae) and by Procerophis sahnii gen. et sp. nov. Thaumastophis missiaeni gen. et sp. nov. is a caenophidian of uncertain family assignment. At least two other forms probably represent new genera and spe− cies, but they are not named; both appear to be related to the Caenophidia. The number of taxa that represent the Colubroidea or at least the Caenophidia, i.e., advanced snakes, is astonishing for the Eocene. This is consistent with the view that Asia played an important part in the early history of these taxa. The fossils come from marine and continental levels; however, no significant difference is evident between faunas from these levels. The fauna from Vastan Mine in− cludes highly aquatic, amphibious, and terrestrial snakes. All are found in the continental levels, including the aquatic palaeophiids, whereas the marine beds yielded only two taxa. -

Mesozoic Marine Reptile Palaeobiogeography in Response to Drifting Plates
ÔØ ÅÒÙ×Ö ÔØ Mesozoic marine reptile palaeobiogeography in response to drifting plates N. Bardet, J. Falconnet, V. Fischer, A. Houssaye, S. Jouve, X. Pereda Suberbiola, A. P´erez-Garc´ıa, J.-C. Rage, P. Vincent PII: S1342-937X(14)00183-X DOI: doi: 10.1016/j.gr.2014.05.005 Reference: GR 1267 To appear in: Gondwana Research Received date: 19 November 2013 Revised date: 6 May 2014 Accepted date: 14 May 2014 Please cite this article as: Bardet, N., Falconnet, J., Fischer, V., Houssaye, A., Jouve, S., Pereda Suberbiola, X., P´erez-Garc´ıa, A., Rage, J.-C., Vincent, P., Mesozoic marine reptile palaeobiogeography in response to drifting plates, Gondwana Research (2014), doi: 10.1016/j.gr.2014.05.005 This is a PDF file of an unedited manuscript that has been accepted for publication. As a service to our customers we are providing this early version of the manuscript. The manuscript will undergo copyediting, typesetting, and review of the resulting proof before it is published in its final form. Please note that during the production process errors may be discovered which could affect the content, and all legal disclaimers that apply to the journal pertain. ACCEPTED MANUSCRIPT Mesozoic marine reptile palaeobiogeography in response to drifting plates To Alfred Wegener (1880-1930) Bardet N.a*, Falconnet J. a, Fischer V.b, Houssaye A.c, Jouve S.d, Pereda Suberbiola X.e, Pérez-García A.f, Rage J.-C.a and Vincent P.a,g a Sorbonne Universités CR2P, CNRS-MNHN-UPMC, Département Histoire de la Terre, Muséum National d’Histoire Naturelle, CP 38, 57 rue Cuvier, -

Latest Early-Early Middle Eocene Deposits of Algeria
MONOGRAPH Latest Early-early Middle Eocene deposits of Algeria (Glib Zegdou, HGL50), yield the richest and most diverse fauna of amphibians and squamate reptiles from the Palaeogene of Africa JEAN-CLAUDE RAGEa †, MOHAMMED ADACIb, MUSTAPHA BENSALAHb, MAHAMMED MAHBOUBIc, LAURENT MARIVAUXd, FATEH MEBROUKc,e & RODOLPHE TABUCEd* aCR2P, Sorbonne Universités, UMR 7207, CNRS, Muséum National d’Histoire Naturelle, Université Paris 6, CP 38, 57 rue Cuvier, 75231 Paris cedex 05, France bLaboratoire de Recherche n°25, Université de Tlemcen, BP. 119, Tlemcen 13000, Algeria cLaboratoire de Paléontologie, Stratigraphie et Paléoenvironnement, Université d’Oran 2, BP. 1524, El M’naouer, Oran 31000, Algeria dInstitut des Sciences de l’Evolution de Montpellier (ISE-M), UMR 5554 CNRS/UM/ IRD/EPHE, Université de Montpellier, Place Eugène Bataillon, 34095 Montpellier cedex 5, France eDépartement des Sciences de la Terre et de l’Univers, Faculté des Sciences de la Nature et de la Vie, Université Mohamed Seddik Ben Yahia - Jijel, BP. 98 Cité Ouled Aïssa, 18000 Jijel, Algeria * Corresponding author: [email protected] Abstract: HGL50 is a latest Early-early Middle Eocene vertebrate-bearing locality located in Western Algeria. It has produced the richest and most diverse fauna of amphibians and squamate reptiles reported from the Palaeogene of Africa. Moreover, it is one of the rare faunas including amphibians and squamates known from the period of isolation of Africa. The assemblage comprises 17 to 20 taxa (one gymnophionan, one probable caudate, three to six anurans, seven ‘lizards’, and five snakes). Two new taxa were recovered: the anuran Rocekophryne ornata gen. et sp. nov. and the snake Afrotortrix draaensis gen. -

Contents Herpetological Journal
British Herpetological Society Herpetological Journal Volume 31, Number 3, 2021 Contents Full papers Killing them softly: a review on snake translocation and an Australian case study 118-131 Jari Cornelis, Tom Parkin & Philip W. Bateman Potential distribution of the endemic Short-tailed ground agama Calotes minor (Hardwicke & Gray, 132-141 1827) in drylands of the Indian sub-continent Ashish Kumar Jangid, Gandla Chethan Kumar, Chandra Prakash Singh & Monika Böhm Repeated use of high risk nesting areas in the European whip snake, Hierophis viridiflavus 142-150 Xavier Bonnet, Jean-Marie Ballouard, Gopal Billy & Roger Meek The Herpetological Journal is published quarterly by Reproductive characteristics, diet composition and fat reserves of nose-horned vipers (Vipera 151-161 the British Herpetological Society and is issued free to ammodytes) members. Articles are listed in Current Awareness in Marko Anđelković, Sonja Nikolić & Ljiljana Tomović Biological Sciences, Current Contents, Science Citation Index and Zoological Record. Applications to purchase New evidence for distinctiveness of the island-endemic Príncipe giant tree frog (Arthroleptidae: 162-169 copies and/or for details of membership should be made Leptopelis palmatus) to the Hon. Secretary, British Herpetological Society, The Kyle E. Jaynes, Edward A. Myers, Robert C. Drewes & Rayna C. Bell Zoological Society of London, Regent’s Park, London, NW1 4RY, UK. Instructions to authors are printed inside the Description of the tadpole of Cruziohyla calcarifer (Boulenger, 1902) (Amphibia, Anura, 170-176 back cover. All contributions should be addressed to the Phyllomedusidae) Scientific Editor. Andrew R. Gray, Konstantin Taupp, Loic Denès, Franziska Elsner-Gearing & David Bewick A new species of Bent-toed gecko (Squamata: Gekkonidae: Cyrtodactylus Gray, 1827) from the Garo 177-196 Hills, Meghalaya State, north-east India, and discussion of morphological variation for C. -

Checklist of Amphibians and Reptiles of Morocco: a Taxonomic Update and Standard Arabic Names
Herpetology Notes, volume 14: 1-14 (2021) (published online on 08 January 2021) Checklist of amphibians and reptiles of Morocco: A taxonomic update and standard Arabic names Abdellah Bouazza1,*, El Hassan El Mouden2, and Abdeslam Rihane3,4 Abstract. Morocco has one of the highest levels of biodiversity and endemism in the Western Palaearctic, which is mainly attributable to the country’s complex topographic and climatic patterns that favoured allopatric speciation. Taxonomic studies of Moroccan amphibians and reptiles have increased noticeably during the last few decades, including the recognition of new species and the revision of other taxa. In this study, we provide a taxonomically updated checklist and notes on nomenclatural changes based on studies published before April 2020. The updated checklist includes 130 extant species (i.e., 14 amphibians and 116 reptiles, including six sea turtles), increasing considerably the number of species compared to previous recent assessments. Arabic names of the species are also provided as a response to the demands of many Moroccan naturalists. Keywords. North Africa, Morocco, Herpetofauna, Species list, Nomenclature Introduction mya) led to a major faunal exchange (e.g., Blain et al., 2013; Mendes et al., 2017) and the climatic events that Morocco has one of the most varied herpetofauna occurred since Miocene and during Plio-Pleistocene in the Western Palearctic and the highest diversities (i.e., shift from tropical to arid environments) promoted of endemism and European relict species among allopatric speciation (e.g., Escoriza et al., 2006; Salvi North African reptiles (Bons and Geniez, 1996; et al., 2018). Pleguezuelos et al., 2010; del Mármol et al., 2019). -

Long- and Short-Term Impact of Temperature on Snake Detection in the Wild: Further Evidence from the Snake Hemorrhois Hippocrepis
Acta Herpetologica 5(2): 143-150, 2010 Long- and short-term impact of temperature on snake detection in the wild: further evidence from the snake Hemorrhois hippocrepis Francisco J. Zamora-Camacho1,*, Gregorio Moreno-Rueda2, Juan M. Pleguezuelos1 1 Departamento de Biología Animal, Facultad de Ciencias, Universidad de Granada, E-18071, Grana- da, Spain. *Corresponding author. E-mail: [email protected] 2 Estación Experimental de Zonas Áridas (CSIC), La Cañada de San Urbano, Ctra. Sacramento s/n, E-04120, Almería, Spain. Submitted on: 2010, 25th February; revised on: 2010, 15th, August; accepted on: 2010, 22th, October. Abstract. Global change is causing an average temperature increment which affects several aspects of organisms’ biology, especially in ectotherms. Nevertheless, there is still scant knowledge about how this change is affecting reptiles. This paper shows that, the higher average temperature in a year, the more individuals of the snake Hem- orrhois hippocrepis are found in the field, because temperature increases the snakes’ activity. Furthermore, the quantity of snakes found was also correlated with the tem- perature of the previous years. Our results suggest that environmental temperature increases the population size of this species, which could benefit from the tempera- ture increment caused by climatic change. However, we did not find an increase in population size with the advance of years, suggesting that other factors have negatively impacted on this species, balancing the effect of increasing temperature. Keywords. -

2021Alkinsdmscres.Pdf with Marking the Unmarkable
Bangor University MASTERS BY RESEARCH Habitat Selection of a Non-Native Snake: Implications for Future Management of Zamenis longissimus in Colwyn Bay, North Wales Alkins, Dev Award date: 2021 Awarding institution: Bangor University Link to publication General rights Copyright and moral rights for the publications made accessible in the public portal are retained by the authors and/or other copyright owners and it is a condition of accessing publications that users recognise and abide by the legal requirements associated with these rights. • Users may download and print one copy of any publication from the public portal for the purpose of private study or research. • You may not further distribute the material or use it for any profit-making activity or commercial gain • You may freely distribute the URL identifying the publication in the public portal ? Take down policy If you believe that this document breaches copyright please contact us providing details, and we will remove access to the work immediately and investigate your claim. Download date: 26. Sep. 2021 Habitat Selection of a Non-Native Snake: Implications for Future Management of Zamenis longissimus in Colwyn Bay, North Wales Devlan Alkins Supervisor: Dr Wolfgang Wüster Bangor University Keywords: Non-native, Invasive, Habitat Selection, Prey Availability, Colwyn Bay, Aesculapian, Zamenis longissimus I hereby declare that this thesis is the results of my own investigations, except where otherwise stated. All other sources are acknowledged by bibliographic references. This work has not previously been accepted in substance for any degree and is not being concurrently submitted in candidature for any degree unless, as agreed by the University, for approved dual awards. -

Middle Eocene Vertebrate Fauna from the Aridal Formation, Sabkha of Gueran, Southwestern Morocco
geodiversitas 2021 43 5 e of lif pal A eo – - e h g e r a p R e t e o d l o u g a l i s C - t – n a M e J e l m a i r o DIRECTEUR DE LA PUBLICATION / PUBLICATION DIRECTOR : Bruno David, Président du Muséum national d’Histoire naturelle RÉDACTEUR EN CHEF / EDITOR-IN-CHIEF : Didier Merle ASSISTANT DE RÉDACTION / ASSISTANT EDITOR : Emmanuel Côtez ([email protected]) MISE EN PAGE / PAGE LAYOUT : Emmanuel Côtez COMITÉ SCIENTIFIQUE / SCIENTIFIC BOARD : Christine Argot (Muséum national d’Histoire naturelle, Paris) Beatrix Azanza (Museo Nacional de Ciencias Naturales, Madrid) Raymond L. Bernor (Howard University, Washington DC) Alain Blieck (chercheur CNRS retraité, Haubourdin) Henning Blom (Uppsala University) Jean Broutin (Sorbonne Université, Paris, retraité) Gaël Clément (Muséum national d’Histoire naturelle, Paris) Ted Daeschler (Academy of Natural Sciences, Philadelphie) Bruno David (Muséum national d’Histoire naturelle, Paris) Gregory D. Edgecombe (The Natural History Museum, Londres) Ursula Göhlich (Natural History Museum Vienna) Jin Meng (American Museum of Natural History, New York) Brigitte Meyer-Berthaud (CIRAD, Montpellier) Zhu Min (Chinese Academy of Sciences, Pékin) Isabelle Rouget (Muséum national d’Histoire naturelle, Paris) Sevket Sen (Muséum national d’Histoire naturelle, Paris, retraité) Stanislav Štamberg (Museum of Eastern Bohemia, Hradec Králové) Paul Taylor (The Natural History Museum, Londres, retraité) COUVERTURE / COVER : Réalisée à partir des Figures de l’article/Made from the Figures of the article. Geodiversitas est -

Deliberate Tail Loss in Dolichophis Caspius and Natrix Tessellata (Serpentes: Colubridae) with a Brief Review of Pseudoautotomy in Contemporary Snake Families
NORTH-WESTERN JOURNAL OF ZOOLOGY 12 (2): 367-372 ©NwjZ, Oradea, Romania, 2016 Article No.: e162503 http://biozoojournals.ro/nwjz/index.html Deliberate tail loss in Dolichophis caspius and Natrix tessellata (Serpentes: Colubridae) with a brief review of pseudoautotomy in contemporary snake families Jelka CRNOBRNJA-ISAILOVIĆ1,2,*, Jelena ĆOROVIĆ2 and Balint HALPERN3 1. Faculty of Sciences and Mathematics, University of Niš, Višegradska 33, 18000 Niš, Serbia. 2. Institute for Biological Research “Siniša Stanković”, University of Belgrade, Despota Stefana 142, 11000 Belgrade, Serbia. 3. MME BirdLife Hungary, Költő u. 21, 1121 Budapest, Hungary. * Corresponding author, J. Crnobrnja-Isailović, E-mail: [email protected] Received: 22. April 2015 / Accepted: 16. July 2015 / Available online: 29. July 2015 / Printed: December 2016 Abstract. Deliberate tail loss was recorded for the first time in three large whip snakes (Dolichophis caspius) and one dice snake (Natrix tessellata). Observations were made in different years and in different locations. In all cases the tail breakage happened while snakes were being handled by researchers. Pseudoautotomy was confirmed in one large whip snake by an X-Ray photo of a broken piece of the tail, where intervertebral breakage was observed. This evidence and literature data suggest that many colubrid species share the ability for deliberate tail loss. However, without direct observation or experiment it is not possible to prove a species’ ability for pseudoautotomy, as a broken tail could also be evidence of an unsuccessful predator attack, resulting in a forcefully broken distal part of the tail. Key words: deliberate tail loss, pseudoautotomy, Colubridae, Dolichophis caspius, Natrix tessellate.