PC-000290.Pdf
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-
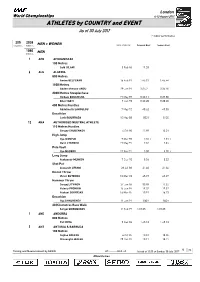
0 E Country Event
London World Championships 4-13 August 2017 ATHLETES by COUNTRY and EVENT As of 30 July 2017 i = Indoor performance 205 2038 MEN + WOMEN Countries Athletes DATE of BIRTH Personal Best Season Best 1080 MEN Athletes 1 AFG AFGHANISTAN 100 Metres Said GILANI 5 Feb 96 11.33 6 ALG ALGERIA 800 Metres Amine BELFERAR 16 Feb 91 1:45.01 1:45.44 1500 Metres Abderra mane ANOU 29 Jan 91 3:35.2 3:36.50 3000 Metres Steeplec ase Hic am BOUCHICHA 19 May 89 8:20.11 8:27.80 Bilal TABTI 7 Jun 93 8:20.20 8:20.20 400 Metres Hurdles Abdelmali) LAHOULOU 7 May 92 48.62 49.05 Decat lon Larbi BOURRADA 10 May 88 8521 8120 12 ANA AUTHORISED NEUTRAL ATHLETE 110 Metres Hurdles Sergey SHUBEN.O/ 4 Oct 90 12.98 13.01 Hig 0ump Ilya I/AN1U. 9 Mar 93 2.31i 2.31 i Danil L1SEN.O 19 May 97 2.34 2.34 2ole /ault Ilya MUDRO/ 17 Nov 91 5.80 5.70i Long 0ump Ale)sandr MEN.O/ 7 Dec 90 8.56 8.32 S ot 2ut Ale3andr LESNOI 28 Ju 88 21.40 21.36 Discus T row /ictor BUTEN.O 10 Mar 93 65.97 65.07 Hammer T row Serge5 LIT/INO/ 27 Jan 86 80.98 77.32 /aleriy 2RON.IN 15 Jun 94 79.32 79.32 Ale)sei SO.1RS.II 16 Mar 85 78.91 76.23 Decat lon Ilya SH.URENE/ 11 Jan 91 8601 8601 20 .ilometres Race 6al) Sergei SHIROBO.O/ 11 Feb 99 1:18:25 1:18:25 1 AND ANDORRA 800 Metres 2ol MO1A 9 Dec 96 1:48.13 1:48.13 5 ANT ANTIGUA 7 BARBUDA 100 Metres Ce5 ae GREENE 6 Oct 95 10.01 10.05 C a8aug n 6ALSH 29 Dec 87 10.17 10.17 1 Timing and Measurement by SEIKO AT-------.EL3..v1 Issued at 13:33 on Sunday, 30 uly 2017 78 CTTWQWOZDO b\S a London World Championships 4-13 August 2017 ATHLETES by COUNTRY and EVENT DATE of BIRTH -

Universidad Estatal De Bolívar
UNIVERSIDAD ESTATAL DE BOLÍVAR FACULTAD DE CIENCIAS ADMINISTRATIVAS GESTIÓN EMPRESARIAL E INFORMÁTICA ESCUELA DE COMUNICACIÓN SOCIAL Y DESARROLLO TURÍSTICO CARRERA DE TURISMO Y HOTELERÍA MODALIDAD DE TITULACIÓN: ESTUDIO ETNOGRÁFICO TEMA: “ESTUDIO ETNOGRÁFICO DE LOS HIELEROS DEL CHIMBORAZO, COMO ELEMENTO DINAMIZADOR PARA EL DESARROLLO TURÍSTICO DEL CAMINO ANCESTRAL DEL SARA KAPAK ÑAN, COMUNIDAD QUINDIHUA, CANTÓN GUARANDA, PROVINCIA BOLÍVAR, AÑO 2018” AUTORA: GARCÍA GARCÍA YADIRA MARICELA GUARANDA-ECUADOR AÑO 2019 UNIVERSIDAD ESTATAL DE BOLÍVAR FACULTAD DE CIENCIAS ADMINISTRATIVAS GESTIÓN EMPRESARIAL E INFORMÁTICA ESCUELA DE COMUNICACIÓN SOCIAL Y DESARROLLO TURÍSTICO CARRERA DE TURISMO Y HOTELERÍA “ESTUDIO ETNOGRÁFICO DE LOS HIELEROS DEL CHIMBORAZO, COMO ELEMENTO DINAMIZADOR PARA EL DESARROLLO TURÍSTICO DEL CAMINO ANCESTRAL DEL SARA KAPAK ÑAN, COMUNIDAD QUINDIHUA, CANTÓN GUARANDA, PROVINCIA BOLÍVAR, AÑO 2018” ESTUDIO ETNOGRÁFICO PRESENTADO COMO REQUISITO PARCIAL PARA APROBAR EL TRABAJO DE TITULACIÓN, PARA OPTAR EL TÍTULO DE: INGENIERA EN ADMINISTRACIÓN DE EMPRESAS DE TURISMO Y HOTELERÍA AUTORA: GARCÍA GARCÍA YADIRA MARICELA DIRECTORA LCDA. VERÓNICA ARCOS BÓSQUEZ MSc. PARES ACADÉMICOS ING. SILVANA DEL SALTO DÁVILA MSc. ING. GERMÁN SÁNCHEZ CHÁVEZ MSc. GUARANDA, ECUADOR AÑO - 2019 DERECHOS DE AUTOR III IV CERTIFICADO DE APROBACIÓN POR PARTE DEL DIRECTOR LCDA. VERÓNICA MARIBEL ARCOS BÓSQUEZ MSc., DOCENTE DIRECTORA DEL ESTUDIO ETNOGRÁFICO, A PETICIÓN DE PARTE INTERESADA CERTIFICA Que el Estudio Etnográfico denominado “ESTUDIO ETNOGRÁFICO DE LOS HIELEROS DEL CHIMBORAZO, COMO ELEMENTO DINAMIZADOR PARA EL DESARROLLO TURÍSTICO DEL CAMINO ANCESTRAL DEL SARA KAPAK ÑAN, COMUNIDAD QUINDIHUA, CANTÓN GUARANDA, PROVINCIA BOLÍVAR, AÑO 2018”, de autoría de YADIRA MARICELA GARCÍA GARCÍA, estudiante de la carrera de Turismo y Hotelería, ha sido concluido por parte de su autora, con la revisión del suscrito en calidad de Directora del trabajo; y al cumplir con los requisitos y lineamientos establecidos por la Facultad, faculto el trámite siguiente. -

Nota: Al Ser Una Planificación Realizada a Comienzo Del Año
Nota: Al ser una planificación realizada a comienzo del año puede existir nombres o eventos, a los que no se asistieron o se realizaron parcial o totalmente, TODOS LOS EVENTOS FUERON ENVIADOS POR LOS JEFES DE ÁREAS Y EVALUADOS POR LA PARTE TÉCNICA FEDERACIÓN ECUATORIANA DE PREPARACIÓN DE LOS DEPORTISTAS DE ALTO RENDIMIENTO 2015 ENERO Nombre del evento: 1 Lugar: ESMERALDAS Atletas: ALEJANDRO CHALA - LUIS ESCOBAR Entrenador: CELSO CORTES medico Fecha de inicio: 5 DE ENERO Fecha de terminación: 31 DE ENERO Fecha de salida: 5 DE ENERO Fecha de retorno: 01-feb OBJETIVO 2 Nombre del evento: CAMPAMENTO DE ENTRENAMIENTO RIO VERDE Lugar: ESMERALDAS Atletas: VALERIA CHILIQUINGA Y JUAN CAICEDO ELIZABETH MINA Entrenador: RAMÓN BRETO psicologo CARLOS VELE Fecha de inicio: 14-ene Fecha de terminación: 28-feb Fecha de salida: 14-ene Fecha de retorno: 28-feb OBJETIVO: FEBRERO Nombre del evento: CAMPAMENTO 3 Lugar: CARPUELA Atletas: ALEX QUIÑONEZ - SELENE CEVALLOS Entrenador: YOSVANIA MOLINA medico Fecha de inicio: 02-feb Fecha de terminación: 28-feb Fecha de salida: 02-feb Fecha de retorno: 28-feb 4 Nombre del evento: MARATHÓN Lugar: ESPAÑA SEVILLA Atletas: ROSA CHACHA, MANUEL CAÑAR Entrenador FREDDY VIVANCO Medico/fisioterapista: Fecha de inicio: FEBRERO Fecha de terminación: Fecha de salida Fecha de regreso 5 Nombre del evento: COPA PANAMERICANA CROSS COUNTRY Lugar: BARRANQUILLA Atletas: BYRON PIEDRA Entrenador RAFAEL MARTÍNEZ Medico/fisioterapista: Fecha de inicio: c Fecha de terminación: 22/02/2015 Fecha de salida 19/02/2015 Fecha de regreso 23/02/2015 -

UNIVERSIDAD DE CUENCA Facultad De Filosofía, Letras Y Ciencias De
UNIVERSIDAD DE CUENCA Facultad de Filosofía, Letras y Ciencias de la Educación Carrera de Comunicación Social La Mujer y el Deporte en la Prensa Escrita: Una mirada a tres historias desde el interior del deporte de élite en la ciudad de Cuenca en un ciclo olímpico Trabajo de titulación previo a la obtención del título de Licenciada en Ciencias de la Comunicación Social en Periodismo y Comunicación Digital AUTORA: Laura Nicole Smith Cadena CI. 1002759742 [email protected] DIRECTOR: Ricardo Teodoro Tello Carrión CI. 0102381217 Cuenca-Ecuador 08-Julio-2021 Universidad de Cuenca RESUMEN El presente documento tiene como finalidad visibilizar la realidad de la mujer deportista de élite en la prensa escrita y plasmarla mediante tres perfiles periodísticos. La mujer históricamente ha sido relegada a tareas impuestas por roles de género. A través de un recorrido por las experiencias contadas desde una perspectiva íntima de las principales actoras, se conocen los pormenores de la situación que enfrentan las mujeres deportistas de élite en el Ecuador. Se explora la historia de las mujeres en sus inicios del deporte en el mundo, su aparición en los Juegos Olímpicos de la Antigüedad y cómo ganaron terreno en su reedición de la modernidad. Cómo fue su aparición en el deporte ecuatoriano y cuencano y el paulatino avance de su participación en las disciplinas deportivas dentro de un ciclo olímpico. Palabras Clave: Mujer y deporte. Juegos olímpicos. Perfil periodístico. Enfoque de género. Prensa escrita. 2 Laura Nicole Smith Cadena Universidad de Cuenca ABSTRACT The purpose of this document is to present current situation of elite sportswomen in the media and capture it through three journalistic profiles. -

Havana and Trinidad
UC Berkeley UC Berkeley Electronic Theses and Dissertations Title Heritage Modern: Cityscape of the Late Socialist Political Economy in Trinidad, Cuba Permalink https://escholarship.org/uc/item/5kk721b7 Author Tanaka, Maki Publication Date 2011 Peer reviewed|Thesis/dissertation eScholarship.org Powered by the California Digital Library University of California Heritage Modern: Cityscape of the Late Socialist Political Economy in Trinidad, Cuba By Maki Tanaka A dissertation submitted in partial satisfaction of the requirements for the degree of Doctor of Philosophy in Anthropology in the Graduate Division of the University of California, Berkeley Committee in charge: Professor Nelson H. H. Graburn, Chair Professor James Holston Professor Joseph L. Scarpaci Professor Ananya Roy Spring 2011 Heritage Modern: Cityscape of the Late Socialist Political Economy in Trinidad, Cuba © 2011 by Maki Tanaka Abstract Heritage Modern: Cityscape of the Late Socialist Political Economy in Trinidad, Cuba By Maki Tanaka Doctor of Philosophy in Anthropology University of California, Berkeley Professor Nelson H. H. Graburn, Chair The overall theme of this dissertation is to understand, through the heritage cityscape of Trinidad, aspects of the processes of the reconfiguration of political economy in today’s Cuba. In late socialist Cuba, tourism is a key sector sustaining the revolution, and heritage cityscape constitutes one of the main tourist attractions. In this regard, the city of Trinidad provides a vantage point to analyze heritage practices and the tourism economy. I argue that the heritage cityscape of Trinidad manifests a tension between neoliberal and socialist rationalities, as the preservation office is converted into a cultural agency that depends on its own entrepreneurship. -

Facultad De Dirección De Empresas Carrera De Administración De Empresas Y Negocios
FACULTAD DE DIRECCIÓN DE EMPRESAS CARRERA DE ADMINISTRACIÓN DE EMPRESAS Y NEGOCIOS TESIS PREVIO A LA OBTENCIÓN DEL TÍTULO DE INGENIERO EN ADMINISTRACIÓN DE EMPRESAS Y DE NEGOCIOS UNIDAD DE INTELIGENCIA DE MERCADOS PARA LOS CLÚSTERS CUERO Y CALZADO, MADERERO Y TEXTILES Y CONFECCIONES DE LA PROVINCIA DE TUNGURAHUA AUTORA: FERNANDA ESTEFANÍA NAVAS PALLO ASESORA: Eco. IVONNE NARVÁEZ, MBA. Ambato – Ecuador 2014 DEDICATORIA Esta tesis está dedicada con mucho amor a mi hermana Nataly y mi abuelita Rosita y sobre todo a mi padres Edgar y Mercedes, los seres que me dieron la vida y me permitieron llegar a esta etapa, gracias a ustedes por la paciencia, comprensión y el esfuerzo realizado para educarme, inculcarme valores y por enseñarme que a pesar de las dificultades y carencias se puede lograr los que uno se propone. Ustedes han sido el pilar fundamental en este ciclo y son las personas que nunca me dejaran sola y me brindaran su apoyo incondicional en todo reto que se me plantee en la vida. Fernanda Estefanía Navas Pallo AGRADECIMIENTO En primer lugar agradezco a Dios por darme la vida, por regalarme una familia maravillosa, unos padres y hermana ejemplares, que nunca me dejaron sola, que estuvieron a mi lado, guiándome y siendo la razón principal para seguir adelante. A mi Universidad Regional Autónoma de los Andes “UNIANDES”, por darme la oportunidad de formarme no solo profesionalmente, sino también, espiritualmente, le agradezco mis conocimientos adquiridos de cada uno de los profesores en todo este transcurso estudiantil, los mismos que serán utilizados de la mejor manera en el transcurso de mi vida y a la vez le agradezco el haberme dado la oportunidad de conocer a personas excepcionales que han formado parte de mi vida y han sabido brindarme su amistad sincera. -

Resultados Oficiales
PANAMA INTERNATIONAL HALF MARATHON GATORADE SATURDAY 27TH CINTA COSTERA PLAZA ANAYANSI HORA 05.00 P.M HALF MARATHON 21.097 KM GEN CAT CHIP BIB GUNTIME CHIPTIME NOMBRE SEXO EDAD CATEGORIA PAIS 1 1 6 6 01:07:20 01:07:20 GEOFREY KENISI BUNDI M 28 ABIERTA MASCULINO KENIA 2 1 8 8 01:07:45 01:07:40 EMMANUEL MNAMGAT M 30 SENIOR MASCULINO KENIA 3 2 1 1 01:08:09 01:08:16 PETER LEMANYAN M 27 ABIERTA MASCULINO KENIA 4 3 5 5 01:08:15 01:08:15 DAVID KIPROTICH LANGAT M 27 ABIERTA MASCULINO KENIA 5 1 7 7 01:08:25 01:08:21 DIEGO COLORADO M 41 MASTER MASCULINO COLOMBIA 6 4 4 4 01:08:56 01:08:51 ENOC KIPKORIR M 25 ABIERTA MASCULINO KENIA 7 2 3 3 01:10:23 01:10:23 ALENE RETA M 33 SENIOR MASCULINO ETHIOPIA 8 3 2 2 01:10:48 01:10:42 PEDRO MORA M 37 SENIOR MASCULINO VENEZUELA 9 5 219 219 01:12:16 01:12:16 JOEL KIPTANUI M 27 ABIERTA MASCULINO KENIA 10 4 188 188 01:12:27 01:12:21 MARCO ANTONIO ERAZO MONTERO M 36 SENIOR MASCULINO ECUADOR 11 6 9 9 01:13:13 01:13:07 JORGE CASTELBLANCO M 27 ABIERTA MASCULINO PANAMA 12 7 189 189 01:13:33 01:13:28 ANGEL GERARDO CHASI TOALOMBO M 28 ABIERTA MASCULINO ECUADOR 13 1 17 17 01:17:23 01:17:17 KELLYS ARIAS F 25 ABIERTA FEMENINO COLOMBIA 14 1 13 13 01:17:41 01:17:35 MARGARETH TOROITICH F 34 SENIOR FEMENINO KENIA 15 5 187 187 01:17:55 01:17:48 XAVIER SIMBANA M 30 SENIOR MASCULINO ECUADOR 16 6 260 260 01:18:29 01:18:24 DAVID TELLO BROTONS M 34 SENIOR MASCULINO COLOMBIA 17 7 137 137 01:18:52 01:18:46 RAFAEL VEGA M 35 SENIOR MASCULINO PANAMA 18 8 117 117 01:19:12 01:19:12 CARLOS HINESTROSA M 19 ABIERTA MASCULINO PANAMA 19 2 227 -

Entries by Event and Season's Best
London World Championships 4-13 August 2017 ATHLETES by EVENT and SEASON BEST As of 29 July 2017 i = Indoor performance 205 2034 DATE of BIRTH Personal Best Season Best Qualification Best Countries Athletes MEN + WOMEN 1080 Athletes MEN 46 66 Countries Athletes 100 Metres Christian COLEMAN USA6 Mar 96 9.829.829.829.82 9.82 Yohan BLAKE JAM26 Dec 89 9.699.909.909.90 9.90 Akani SIMBINE RSA21 Sep 93 9.899.929.929.92 9.92 Christopher BELCHER USA29 Jan 94 9.939.939.939.93 9.93 sain BOLT JAM21 Aug 86 9.589.959.959.95 9.95 Justin GATLIN USA10 Feb 82 9.749.959.959.95 9.95 Thando ROTO RSA26 Sep 95 9.959.959.959.95 9.95 Jimmy VICA T FRA27 Feb 92 9.869.979.979.97 9.97 Ben Youssef MEIT' CI 11 Nov 86 9.969.989.989.98 9.98 Chi(indu JAH GBR5 Mar 94 9.969.989.989.98 9.98 Julian FORTE JAM7 Jan 93 9.999.999.999.99 9.99 Jaylen BACON USA5 Aug 96 10.0010.00 10.00 Andre DE GRASSE CAN10 Nov 94 9.9110.01 10.01 Seno(,Jay GIVANS JAM30 Dec 93 9.9610.02 10.02 Yoshihide KIRY JPN15 Dec 95 10.0110.04 10.04 Ce(hae GREENE ANT6 Oct 95 10.0110.05 10.05 Abdul Hakim SANI BRO.N JPN6 Mar 99 10.0510.05 10.05 David LIMA POR6 Sep 90 10.0510.05 10.05 James DASAOL GBR5 Sep 87 9.9110.06 10.06 Bin0tian S CHN29 Aug 89 9.9910.06 10.06 Micheal CAM1BELL JAM29 Nov 96 10.0710.07 10.07 Kukyoun0 KIM KOR19 Apr 91 10.0710.07 10.07 Keston BLEDMAN TTO8 Mar 88 9.8610.08 10.08 Aska CAMBRIDGE JPN31 May 93 10.0810.08 10.08 Shuhei TADA JPN24 Jun 96 10.0810.08 10.08 Reece 1RESCOD GBR29 Feb 96 10.0410.09 10.09 2henye 3IE CHN17 Aug 93 10.0810.09 10.09 Jak Ali HARVEY TUR4 May 89 9.9210.10 10.10 Julian -
Cronograma De Actividades De La Temporada 2014
Cronograma de Actividades de la Temporada 2014 Deportista: Ángela Tenorio Categoría. Juvenil Especialidad: 100 metros y 200 metros planos. Entrenador: Lic. Nelson Gutiérrez Pérez. Competencias Fundamentales. Juegos Nacionales Juveniles, Campeonato Mundial Juvenil, Campeonato Iberoamericano Actividad Días Alimentación Alojamiento Pasaje Hidratación Total 1 - Campamento de 10 3 persona x 3.00 x Gratis 7.00 x3 5.00 x 3 270.00 entrenamiento 3 comidas x 10dias personas 2 = personas x 10 42.00 Carpuela-Ibarra fecha = $270.00 $42.00 días =150.00 150.00 del 20 de enero al 22 de $472.00 febrero del 2014 Campamento en los 10 3 personas x 80.00 x10dias x 800 x3= 5.00 x 3 x10 = $2250.00 Estados Unidos del 75.00 diarios x 3 personas = $2.400.00 150.00 2400.00 15 de junio 27 de 10 días = $2400.00 Imprevisto 2400.00 lunio al 7 de Julio $2250.00 $1000.00 150.00 2014 1000.00 $8200.00 4 - IIAF Campeonato 20 3 personas x 80.00 x20dias x 800 x3= 5.00 x 3 x20 = $4500.00 Mundial Juvenil 2014 75.00 diarios x 3 personas = $2.400.00 150.00 4800.00 del 8 al 28 de julio. 20 días = $4800.00 Imprevisto 2400.00 UNITED STATES $4500.00 $1000.00 1000.00 $12.700.00 5 - Campamento de 30 3 personas por E 100.00 x 30 días 2000.00 E 5.00 x 30 días 6750.00 entrenamiento 75.00 diarios x 30 x 3 personas = E personas = $ x 3 = 450.00 9.000.00 Guadalajara 15 de días = E 6750.00 9000.00 6000.00 Imprevisto 6000.00 agosto al 15 de E 2000.00 450.00 septiembre 2014 2000.00 $24.200.00 Necesidades Medicinas: Valor $2500.00 de suplementos.( proteínas, aminoácidos, multivitaminas, Creatina). -

University of Florida Thesis Or Dissertation Formatting
CUBAN CHARANGA: CLASS, POPULAR MUSIC AND THE CREATION OF NATIONAL IDENTITY By RUTH M. “SUNNI” WITMER A DISSERTATION PRESENTED TO THE GRADUATE SCHOOL OF THE UNIVERSITY OF FLORIDA IN PARTIAL FULFILLMENT OF THE REQUIREMENTS FOR THE DEGREE OF DOCTOR OF PHILOSOPHY UNIVERSITY OF FLORIDA 2011 1 © 2011 Ruth M. “Sunni” Witmer 2 For my parents, E. Earl and Dora M. Witmer y mis abuelos, Manuel y María Margarita García 3 ACKNOWLEDGMENTS There are very few successes in life that are accomplished without the help of others. I would have never achieved what I have without the kind encouragement, collaboration, and support from the following individuals. I would first like to express my gratitude to my Ph.D. committee, Larry Crook, Kristen Stoner, Welson Tremura, and Charles Perrone for their years of steadfast support and guidance. I would also like to thank Martha Ellen Davis, Cristóbel Díaz Ayala, and Robin Moore for their additional contributions to my academic development. It has been an honor to have been mentored by such superb scholars and musicians. What I have learned about becoming a musician, a scholar, and friend, I have learned from all of you. In addition, I would like to thank the following scholars for their efforts in assisting me with my research: Richard Phillips and Paul Losch from the University of Florida’s Latin American Collection, Robena Cornwell and Michelle Wilbanks from the University of Florida’s Music Library, Lesbia Orta Varona from the University of Miami’s Cuban Heritage Collection, and Veronica González from Florida International University’s Cristóbal Diáz Ayala Collection. -

Of 35 Men Men
Men Men Marathon ( WR 2:02:57 Dennis Kipruto KIMETTO (KEN) Berlin, 28 Sep 2014 ) Marathon ( WR 2:02:57 Dennis Kipruto KIMETTO (KEN) Berlin, 28 Sep 2014 ) 2:03:32 Eliud KIPCHOGE 1 KEN 05 Nov 1984 1 Berlin 24 Sep 2017 2:06:56 Kelkile GEZAHEGN 30 ETH 1996 2 Frankfurt 29 Oct 2017 2:03:46 Guye ADOLA 2 ETH 20 Oct 1990 2 Berlin 24 Sep 2017 2:06:57 Stephen Kibiwott 31 KEN 09 Jan 1985 2 Paris 09 Apr 2017 CHEBOGUT 2:03:58 Wilson Kipsang KIPROTICH 3 KEN 15 Mar 1982 1 Tokyo 26 Feb 2017 2:07:01 Laban Kipngetich KORIR 6 Amsterdam 15 Oct 2017 2:04:11 Tamirat TOLA 4 ETH 11 Aug 1991 1 Dubai 20 Jan 2017 2:07:10 Festus TALAM 4 Rotterdam 09 Apr 2017 2:05:09 Lawrence CHERONO 5 KEN 07 Aug 1988 1 Amsterdam 15 Oct 2017 2:07:10 Dejene DEBELA 32 ETH 1995 4 Eindhoven 08 Oct 2017 2:05:13 Nobert Kipkoech KIGEN 6 KEN 24 Oct 1993 2 Amsterdam 15 Oct 2017 2:07:12 Solomon Kirwa YEGO 33 KEN 10 May 1987 3 Paris 09 Apr 2017 2:05:26 Abraham KIPTUM 7 KEN 1989 3 Amsterdam 15 Oct 2017 2:07:13 Edwin Kipngetich KOECH 34 KEN 1992 1 Milano 02 Apr 2017 2:05:39 Mule WASIHUN 8 ETH 20 Oct 1993 4 Amsterdam 15 Oct 2017 2:07:19 Lucas Kimeli ROTICH 35 KEN 16 Apr 1990 5 Rotterdam 09 Apr 2017 2:05:43 Amos Choge KIPRUTO 9 KEN 1992 5 Amsterdam 15 Oct 2017 2:07:21 Yitayal ATNAFU 36 ETH 20 Jan 1993 4 Paris 09 Apr 2017 2:05:48 Daniel Kinyua WANJIRU 10 KEN 26 May 1992 1 London 23 Apr 2017 2:07:21 Benson KIPRUTO 36 KEN 1991 2 Gyeongju 15 Oct 2017 2:05:50 Shura KITATA 11 ETH 09 Jun 1996 1 Frankfurt 29 Oct 2017 2:07:26 Tsegaye MEKONNEN 38 ETH 15 Jun 1995 1 Hamburg 23 Apr 2017 2:05:51 Gideon Kipkemoi -

Pan-American Games, Guadalajara 2011
PAN-AMERICAN GAMES Guadalajara, Mexico 2011 100 METRES (24 Oct) HEAT 1 (-1.00m) 1 Nilson de Oliveira Andre Brazil 10.33 2 David Lescay Cuba 10.36 3 Oshane Bailey Jamaica 10.41 4 Miguel López Puerto Rico 10.48 5 Rolando Palacios Honduras 10.49 6 Kael Becerra Chile 10.49 7 Linford Avila Belize 11.74 HEAT 2 (+1.20m) 1 Emmanuel Callender Trinidad and Tobago 10.13 2 Calesio Newman USA 10.30 3 Jamial Rolle Bahamas 10.45 4 Franklin Nazareno Ecuador 10.52 5 Adam Harris Guyana 10.62 6 Jorge Alonzo Mexico 10.78 HEAT 3 (-0.20m) 1 Michael Herrera Cuba 10.31 2 Harold Houston Bermuda 10.40 3 Adrian Griffith Bahamas 10.41 4 Monzavous Edwards USA 10.53 5 Darrel Brown Trinidad and Tobago 10.63 6 Miguel Wilken Argentina 10.66 HEAT 4 (-2.00m) 1 Kim Collins St.Kitts-Nevis 10.37 2 Carlos Rafael Jorge Dominican Republic 10.43 3 Ramon Gittens Barbados 10.45 4 Isidro Montoya Colombia 10.60 5 Lee Prowell Guyana 10.65 6 Courtney Williams St.Vincent 11.15 7 Jurgen Themen Surinam 11.71 HEAT 5 (-0.10m) 1 Lerone Clarke Jamaica 10.15 2 Alvaro Gómez Colombia 10.31 3 Jason Rogers St.Kitts-Nevis 10.35 4 Sandro Rodrigues Viana Brazil 10.38 5 Dontae Richards Canada 10.61 6 Adrian Durant Virgin Islands 10.64 Juan Reyes Mexico Disq NON-PARTICIPANTS Jervis Myvette Belize Bruno Tenorio de Barros Brazil Pan-American Games, Guadalajara 2011 - 1 - 100 METRES (24 Oct) SEMI-FINALS HEAT 1 (-1.90m) 1 Lerone Clarke Jamaica 10.17 2 Carlos Rafael Jorge Dominican Republic 10.30 3 Alvaro Gómez Colombia 10.40 4 Calesio Newman USA 10.42 5 Jason Rogers St.Kitts-Nevis 10.44 6 Sandro Rodrigues