Nisterprogramm
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Nister-Wiesensee-Tour Themenroute / Rundtour / Teilweise Bahntrassen-Radweg
Nister-Wiesensee-Tour Themenroute / Rundtour / teilweise Bahntrassen-Radweg Start/Ziel: Bad Marienberg Fahrtrichtung: Gegen den Uhrzeigersinn Distanz: 32 km Zeit: 2 Std. 40 Min. (bei 12 km/h) Hm ↑: 418 m Hm ↓: 418 m Anforderung: ▪ Mittel, wegen des heftigen Anstiegs vom Abzweig zur Hardter Mühle nach Dreisbach ▪ Bad Marienberg Stadtzentrum, der Bahnhof Nistertal-Bad Marienberg Bf. ist jedoch Anreise: (dem Radweg Bad Marienberg-Tour folgend) 6 km vom Start im Zentrum entfernt Die Rundtour verbindet Bad Marienberg, das Tal der Nister und die Freizeitregion am Wiesensee. Im Sommer an Badesachen denken! Von dem Kurort Bad Marienberg führt die Strecke ins Nistertal. Durch den Anstieg über Dreisbach auf die Hochfläche des Kurz- Westerwaldes erhält die Tour eine sportliche Note. Die fast vollständige Umrundung des beschreibung: Wiesensees bildet den Höhepunkt der Route. Es folgen Hellenhahn-Schellenberg und Fehl-Ritzhausen, ehe man auf einem Bahntrassen-Radweg nach Bad Marienberg zurückkehrt. Die Tour führt von Bad Marienberg nach Langenbach hinab, wo die Schwarze und Große Nister überquert werden. In Nähe der Hardter Mühle verlässt der Radweg das Nistertal und verläuft steil ansteigend über Dreisbach auf die weite Westerwaldhochfläche. Über Ailertchen und Halbs wird danach das Nordufer des Wiesensees erreicht. Die folgende Runde um den herrlich gelegenen See bietet vielfältige Sport- und Freizeitmöglichkeiten vom Baden über Tretbootfahren, Segeln und Surfen bis zum Golfen. Weg- Selbstverständlich ist auch ein entsprechendes gastronomisches Angebot vorhanden. Der beschreibung: See bietet sich aber auch zum entspannten Verweilen an. Nach dem touristisch frequentierten Seegebiet hat man auf der folgenden Fahrt durch die hügelige Landschaft die Natur praktisch wieder für sich. Die Route zieht sich durch Hellenhahn-Schellenberg über die Anhöhe des Wißnerbergs zur Eisenburger Mühle, wo erneut die Nister überquert wird. -

Themenroute / Rundtour / Teilweise Bahntrassen-Radweg
WW1 Themenroute / Rundtour / teilweise Bahntrassen-Radweg Start/Ziel: Hachenburg Bahnhof Fahrtrichtung: Gegen den Uhrzeigersinn Distanz: 214 km (davon 4 km in NRW) Zeit: 17 Std. 55 Min. (bei 12 km/h) Hm ↑: 3.212 m Hm ↓: 3.212 m ▪ Schwer, wegen der Länge, der Höhenunterschiede und des hohen Streckenanteils auf Anforderung: nicht asphaltierten Belägen ▪ Hachenburg Bf. (Westerwald-Sieg-Bahn RB 90 Siegen-Limburg/Lahn) ▪ Anreise: Niedererbach und Dreikirchen Bf. (Unterwesterwaldbahn RB 29 Limburg/Lahn- Siershahn) sowie Westerburg Bf. (Westerwald-Sieg-Bahn RB 90 Siegen-Limburg/Lahn) Der WW1 führt als große Fahrradrunde durch den Westerwald. Umfassender lässt sich die Region im Rahmen einer 4-Tages-Tour kaum erradeln. Der Themenradweg bietet neben Kurz- großartigen Natur- und Landschaftserlebnissen eine Vielzahl kultureller Höhepunkte. beschreibung: Unterwegs lernt man die Vielfältigkeit und den Charme des Westerwaldes und seiner Menschen kennen. Die sportliche Rundtour erfordert jedoch gute Kondition! Der Radweg verlässt Hachenburg nach einem Schlenker in Richtung Altstadt und folgt dem Rothenbach durch den Hatterter Grund. Nach Wahlrod geht es über einen Hügel hinweg Weg- zum Waldsee Maroth, der zum Baden einlädt. Von Ort zu Ort zieht sich die Route über beschreibung: weite Feld-, Wiesen- und Weideflächen nach Selters, dass sich für eine Pause anbietet. Im Hachenburg Saynbachtal erwartet den Radfahrer eine Straßenpassage, ehe die Tour im Steilanstieg bis durch ein Waldgebiet nach Wirscheid und Sessenbach führt. Begleitet von herrlichen Grenzau: Panoramablicken auf die Montabaurer Höhe endet die Etappe mit der Serpentinenabfahrt 50 km nach Grenzau. Von Grenzau verläuft der Radweg im Herzen des Kannenbäckerlandes, Deutschlands berühmtester Keramik- und Tonregion, nach Höhr-Grenzhausen. Auf die Kannenbäckerstadt folgt ein Bahntrassen-Radweg, von dem sich ein Abstecher zum Weg- Limesturm Hillscheid lohnt. -

Kleine Nister-Tour Themenroute / Rundtour Streckencharakter: Radwege Mit Hohem Landschaftserlebnis
Kleine Nister-Tour Themenroute / Rundtour Streckencharakter: Radwege mit hohem Landschaftserlebnis Start/Ziel: Kirburg Fahrtrichtung: Gegen den Uhrzeigersinn Distanz: 21 km Zeit: 1 Std. 45 Min. (bei 12 km/h) Hm ↑: 320 m Hm ↓: 320 m ▪ Leicht, jedoch mit einem langen Anstieg von der Jagdwiese nach Kirburg und einem Anforderung: hohen Streckenanteil auf nicht asphaltierten Belägen ▪ Kirburg (ohne Bahnanschluss) ▪ Anreise: Kein Bahnhof an der Strecke, nächstgelegener Bahnhof ist Unnau-Korb, von dort der Bad Marienberg-Tour 8,5 km (mit Steilanstieg zum Wildpark!) nach Kirburg folgen Die Namensgeberin der Tour entspringt am Stegskopf und vereinigt sich nach knapp 25 km mit der Großen Nister. Der Radweg überquert die Kleine Nister viermal und begleitet den Fluss sowohl ganz nah als auch in einiger Entfernung vom Lautzenbrücker Weiher bis Kurz- zur Jagdwiese. Ein Großteil der Route führt fernab allen Trubels durch schattenspendende beschreibung: Waldgebiete. Während der Holzernte im Herbst und Winter sowie bei Nässe können die Forstwege matschig sein. Im Vordergrund der Tour steht das Naturerlebnis. Die Kleine Nister-Tour führt nach dem Start in Kirburg über eine offene Hochfläche hinweg. Ein Gedenkstein erinnert an das Gefecht von Kirburg vom 19.04.1797, als sich österreichische und französische Truppen gegenüberstanden. Nach dem Weiler Hohensayn erreicht der Radweg beim Lautzenbrücker Weiher die Kleine Nister. Es folgt ein kurzer Streckenabschnitt entlang des ehemaligen Truppenübungsplatzes Daaden, ehe die Route in dem weitläufigen Neunkhausener Wald die Langenbachermühle streift. Nach der nächsten Nisterquerung verlässt der Radweg beim Geisenberg das weite Waldgebiet. Weg- beschreibung: Mit Mörlen, Nauroth und Niederdorf folgen drei Dörfer, ehe die Strecke mit der Abfahrt von der Mörlener Mühle zur Jagdwiese ein Highlight bietet. -

RZ-Winterwandertag Rund Um Den Stöffel
Route 5: Postweiher 4 bis 4,5 Stunden, 157 Höhenmeter Enspel Abfahrt Bus vom Stöffel-Park zum Postweiher: 9.00 Uhr und 9.40 Uhr Die WesterwaldSteig-Tour „Von der Lochum Seenplatte zur Stöffelmaus“ star- tet am Postweiher. Vorbei an der äl- Linden testen Steinkirche im Westerwald Rotenhain und an der munter plätschernden Wiedquelle in Linden, führt der We- sterwaldSteig abwechselnd durch Dreifelder Wald und Koppel dem Gräbersberg Weiher entgegen. Beim Naturdenkmal Wel- Dreifelden terstein legt der Steig eine Schleife im Wald ein. Der Rundgang um den Basaltblock führt in die Sagenwelt der Heinzelmännchen. Weiter geht es über den Monsberg und über Wiesen hinunter ins Tal in Richtung Stöffel-Park. RZ-Winterwandertag Wölferlingen circa 17 km rund um den Stöffel. Worauf Sie sich jetzt schon freuen können: 5 geführte Wanderungen, davon erstmals 4 neue Routen Freier Eintritt in den Stöffel-Park in Enspel (stoeffelpark.de) Regionale Spezialitäten Glühwein-Bar Enspel im Jetzt Kaffee und Kuchen Gewinnspiel der Rhein-Zeitung und ihrer Heimatausgaben Informationsstand des Westerwald-Touristik-Service und Westerwald anmelden! des Westerwald-Vereins Sonntag, 5. Januar 2020 Ausreichend kostenlose Parkmöglichkeiten finden Sie direkt am Stöffel-Park. Weitere Informationen sowie das Anmeldeformular zum RZ-Wandertag Geführte Wanderungen ab 9.00 Uhr bei westerwald.info, telefonische Rückfragen unter 0 26 02 / 3 00 10. am Stöffel-Park Bitte beachten Sie, dass Sie nur mit vorheriger Anmeldung einen garantierten Platz im Bus erhalten! Rhein-Zeitung.de Unter Naturgenuss im Westerwald Route 3: Höhn auf fünf traumhaften Strecken. 3,5 Stunden, 250 Höhenmeter Der zentrale Startpunkt der Wanderungen ist der Stöffel-Park in Enspel. -

Wie Das Erloschene Adelsgeschlecht Von Rennenberg Wieder Zu Dem Ursprünglichen Namen Gelangte
Wie das erloschene Adelsgeschlecht von Rennenberg wieder zu dem ursprünglichen Namen gelangte Die Edler von Rennenberg – Freiherren von Rennenberg – Grafen von Rennenberg – Grafen von Lalaing und von Rennenberg sowie die Fürsten zu Salm-Kyrburg. – Am 01.03.1917 wurde die Witwe des letzten Fürsten zu Salm-Kyrburg (das Geschlecht starb im Schloss Rennenberg nahe Linz aus) mit den Kindern von Amts wegen wieder in den Freiherrenstand (Freifrau, Freiin, Freiherr von Rennenberg) versetzt. Sollte es ein Affront sein? Wesentliche Begebenheiten der Rennenberger geschahen im heutigen Belgien und in den Niederlanden. – Im „Achtzigjährigen niederländischen Unabhängigkeits- oder Freiheitskrieg“ (1568 bis 1648) gegen Spanien galt Graf Georg von Rennenberg seit den Geschehnissen am und nach dem 03.03.1580 als „der große Verräter“. – Die Rennenberger waren einst nicht nur im Erzbistum Köln mit herausragenden geistlichen und kommunalen Ämtern betraut, doch Spitzenpositionen blieben ihnen versagt. Von H.H.Mohr Das edelfreie Geschlecht und ernannt, deren Aufgabe es war, in einem Gau die die Lehnsherren von Rennenberg Rechtsprechung auszuüben und militärische und zivile Funktionen zu übernehmen. Von den edelfreien Der am 17.09.2006 verstorbene Geschichtsforscher des Geschlechtern, die das Jahr 1000 „überstanden“ und Westerwaldes und ehemalige Direktor des Hessischen zwischenzeitlich aufgrund ihrer Grafschaftsrechte und Staatsarchivs, Dr. Hellmuth Gensicke, meinte in seinem sonstigen Regalien langsam eine Territorialherrschaft 1957/1958 erschienenen Buch „Landesgeschichte des aufgebaut hatten, wurden die späteren Reichsfürsten, Westerwaldes“ explizit: „Sicher scheint, dass die Grafen und Edelherren (Freiherrn) – auch Dynasten Rennenberger als einheimisches edelfreies Geschlecht genannt, wobei der „freie Herr“ kein Titel sondern eine zu den Vasallen von Mechthilds (Regentin unseres Standesbezeichnung war, die die Grafen einschloss, die Gefildes, Gräfin Mechthild von Sayn geborene Gräfin von nicht fürstlichen Ranges waren. -

Brückenfestival- 10.00 Uhr: Modefachgeschäft Inh
SEITE 22 Westerwald NR. 154 . DONNERSTAG, 6. JULI 2017 Der Weg ins Berufsleben ist frei Abschluss Realschule plus und Fachoberschule Hachenburger Löwe hat Schüler verabschiedet M Hachenburg. Die Realschule plus der Schülervertretung in den ver- und Fachoberschule Hachenburger gangenen Jahren geleistete Arbeit Löwe hat in einer Feierstunde die ein. André Schmitz als Schulel- Schüler der Berufsreife- und Se- ternsprecher verdeutlichte, dass der kundarstufe-1-Klassen verabschie- erworbene Schulabschluss ein ers- det. Wegen der Sanierungsarbei- ter Meilenstein im beruflichen Le- Posieren fürs Gruppenfoto: die Absolventen der Realschule plus und Fachoberschule Hachenburger Löwe. Foto: Schule ten an der Rundsporthalle fand die ben der Schüler sei. Die Glück- Feier in der Turnhalle der Schul- wünsche der Verbandsgemeinde straße statt. Zu Beginn gab Pfarrer überbrachte der Zweite Beigeord- Sie haben den Qualifizierten Sekundarabschluss Igeschafft Oliver Sigle einen religiösen Im- nete Helmut Kempf. Zum krönen- puls. Rektor Daniel Bongers freute den Abschluss präsentierte sich der Tom Andres (Linden), Yusuf Aydin Hassan Hamad (Hachenburg), Alina bach), Felix Löhmann (Atzelgift), ckum-Püschen), Lucas Schneiders sich mit den Jugendlichen und hob neu formierte Lehrerchor der Re- (Hachenburg), Elisabeth Bauer Hammerschmidt (Nister), Rieke Gina Lück (Rotenhain), Ronja Lütsch (Wahlrod), Julia Schnorr (Hattert), die guten Rahmenbedingungen für alschule plus und Fachoberschule (Astert), Esra Bayraktar (Hachen- Hanz (Hachenburg), Veronika Held (Wahlrod); Alexandra Mey (Ha- Luca Schumacher (Hachenburg), den Start in ihr Berufsleben hervor. mit dem Titel „Lehrer sind Schwei- burg), Aileen Bräuer (Höchsten- (Gehlert), Lea Herbst (Wied), Ka- chenburg), Maik Mohn (Müschen- Jan-Niklas Stahl (Berod), Leon Ajdina Dedic und Aileen Bräuer ne.“ bach), Bettina Bräul (Mündersbach), tharina Hergert (Hachenburg), Jas- bach), Luca Phil Neuer (Münders- Staude (Hattert), Lara Marie Strunk führten durch das Programm. -

20090514 Die Ausbreitung Der Wildkatze Im Westerwald Farbe AB3
Will & Liselott Masgeik-Stiftung 1 Will & Liselott Masgeik-Stiftung für Natur- und Landschaftsschutz Die Ausbreitung der Europäischen Wildkatze (Felis silvestris , SCHREBER 1777) im Westerwald - eine streng geschützte Art auf dem Vormarsch von PHILIPP SCHIEFENHÖVEL und NINA KLAR Arbeitsbericht Nr. 4, April 2010, S.1-18 Will & Liselott Masgeik-Stiftung 2 Inhaltsübersicht Abstract....................................................................................................................... 3 Kurzfassung................................................................................................................. 3 1. Einleitung ................................................................................................................ 4 2. Untersuchungsgebiet ............................................................................................... 5 Historische Wildkatzennachweise............................................................................. 6 3. Methoden................................................................................................................ 6 3.1. Lockstockmethode............................................................................................ 6 3.2. Beobachtungsnachweise und Totfundmeldungen der Wildkatze ....................... 6 3.3. Datenauswertung ............................................................................................. 7 4. Ergebnisse .............................................................................................................. -

Westerwälder Pedelec-Tag Am 1. Mai 2016
Flyer Pedelec 2016 endv_Layout 1 15.02.2016 08:43 Seite 1 Westerwälder Pedelec-Tag am 1. Mai 2016 Nehmen Sie die Anstiege des Westerwaldes mit Schwung. Erleben Sie Leichtigkeit und Fahrspaß! • Geführte Rundtouren mit dem Pedelec • Freier Eintritt in den Stöffel-Park in 57647 Enspel (www.stoeffelpark.de); kostenlose Parkplätze vorhanden Drei geführte Touren mit dem Pedelec • Verschiedene Streckenlängen und Anforderungsprofile • Während jeder Tour wird ein Zwischenstopp eingelegt rund um den Stöffel-Park! • Startgebühr inkl. Lunchpaket: 10,- E pro Person Eine gemeinsame Veranstaltung des Stöffel-Parks, • Leihgebühr Pedelec: 15,- E pro Rad. Reservierung erforderlich * der Verbandsgemeinden Bad Marienberg, Hachenburg, Rennerod und Westerburg • Teilnahme mit eigenem Pedelec möglich! Anmeldung erforderlich * sowie des Westerwald Touristik-Service. Mit Kaffee und Kuchen sowie regionalen Spezialitäten und Getränken ist im Stöffel-Park für das leibliche Wohl bestens gesorgt! ® * Anmeldung unter: [email protected], Tel.: 02602/3001-0 www.westerwald.info Langenbach (Bruchertseifen) Molzhain Schutzbach Gebhardshain Niederdreisbach Selbach (Sieg) Burbach Dickendorf Helmeroth Daaden Flögert Steinebach / Sieg Burbach Elkenroth Weitefeld Obermörsbach Idelberg Emmerzhausen Lützeln Oberdreisbach Ehrlich Kundert Mauden Rosenheim (Landkreis Altenkirchen)Altenkirchen) Siegerlandflughafen Heimborn FriedewaldFriedewald, WWesterwaldesterwald NeunkhausenNeunkhausen LangenbachLangenbach beibei LuckeLuckenbachach Kirburgrburg Limbachch NaurothNauroth, WesterwaldWesterwald -

Landschaftsplanverzeichnis Rheinland-Pfalz
Landschaftsplanverzeichnis Rheinland-Pfalz Dieses Verzeichnis enthält die dem Bundesamt für Naturschutz gemeldeten Datensätze mit Stand 15.11.2010. Für Richtigkeit und Vollständigkeit der gemeldeten Daten übernimmt das BfN keine Gewähr. Titel Landkreise Gemeinden [+Ortsteile] Fläche Einwohner Maßstäbe Auftraggeber Planungsstellen Planstand weitere qkm Informationen LP Adenau Ahrweiler Adenau 257 13.000 10.000 VG Adenau Brandenfels 1974; 1974 Od 130 LP Adenau (1.FS) Ahrweiler Adenau 257 13.000 5.000 VG Adenau, Uni. Inst. f. Städtebau, Uni 1988; 1989 10.000 Bonn Bonn / Oyen LP Adenau (2.FS) Ahrweiler Adenau 258 15.423 10.000 VG Adenau Nick, C+S Consult 1996 LP Altenahr Ahrweiler Ahrbrück, Altenahr, Berg, Dernau, 153 11.200 10.000 VG Ahrweiler Brandenfels u. Pahl 1984 Heckenbach, Hönningen, Kalenborn, Kesseling, Kirchsahr, Lind, Mayschoß, Rech LP Altenahr (FS) Ahrweiler Ahrbrück, Altenahr, Berg, Dernau, 154 12.000 5.000 VG Altenahr Bauabteilung i.B. Heckenbach, Hönningen, 10.000 Kalenborn, Kesseling, Kirchsahr, Lind, Mayschoß, Rech LP Bad Breisig Ahrweiler Bad Breisig, Brohl-Lützing, 50 10.100 5.000 VG Bad Breisig LSRP 1984 Gönnersdorf, Waldorf 10.000 LP Bad Breisig (FS) Ahrweiler Bad Breisig, Brohl-Lützing, 42 13.027 5.000 VG Bad Breisig Sprengnetter u. i.B. Gönnersdorf, Waldorf 10.000 Partner LP Bad Ahrweiler Bad Neuenahr-Ahrweiler 64 28.300 10.000 ST Bad Neuenahr Penker 1976; 1976 Neuenahr-Ahrweiler 50.000 LP Bad Ahrweiler Bad Neuenahr-Ahrweiler 63 27.456 10.000 ST Bad Neuenahr Terporten i.B. Neuenahr-Ahrweiler (FS) LP Brohltal Ahrweiler -
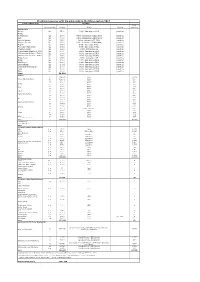
Stocking Measures with Big Salmonids in the Rhine System 2017
Stocking measures with big salmonids in the Rhine system 2017 Country/Water body Stocking smolt Kind and stage Number Origin Marking equivalent Switzerland Wiese Lp 3500 Petite Camargue B1K3 genetics Rhine Riehenteich Lp 1.000 Petite Camargue K1K2K4K4a genetics Birs Lp 4.000 Petite Camargue K1K2K4K4a genetics Arisdörferbach Lp 1.500 Petite Camargue F1 Wild genetics Hintere Frenke Lp 2.500 Petite Camargue K1K2K4K4a genetics Ergolz Lp 3.500 Petite Camargue K7C1 genetics Fluebach Harbotswil Lp 1.300 Petite Camargue K7C1 genetics Magdenerbach Lp 3.900 Petite Camargue K5 genetics Möhlinbach (Bachtele, Möhlin) Lp 600 Petite Camargue B7B8 genetics Möhlinbach (Möhlin / Zeiningen) Lp 2.000 Petite Camargue B7B8 genetics Möhlinbach (Zuzgen, Hellikon) Lp 3.500 Petite Camargue B7B8 genetics Etzgerbach Lp 4.500 Petite Camargue K5 genetics Rhine Lp 1.000 Petite Camargue B2K6 genetics Old Rhine Lp 2.500 Petite Camargue B2K6 genetics Bachtalbach Lp 1.000 Petite Camargue B2K6 genetics Inland canal Klingnau Lp 1.000 Petite Camargue B2K6 genetics Surb Lp 1.000 Petite Camargue B2K6 genetics Bünz Lp 1.000 Petite Camargue B2K6 genetics Sum 39.300 France L0 269.147 Allier 13457 Rhein (Alt-/Restrhein) L0 142.000 Rhine 7100 La 31.500 Rhine 3150 L0 5.000 Rhine 250 Doller La 21.900 Rhine 2190 L0 2.500 Rhine 125 Thur La 12.000 Rhine 1200 L0 2.500 Rhine 125 Lauch La 5.000 Rhine 500 Fecht und Zuflüsse L0 10.000 Rhine 500 La 39.000 Rhine 3900 L0 4.200 Rhine 210 Ill La 17.500 Rhine 1750 Giessen und Zuflüsse L0 10.000 Rhine 500 La 28.472 Rhine 2847 L0 10.500 Rhine 525 -

Autobahn Bundesstraße Kreisstraße Gemeindestraße
Burbach Ahlhausen Ndr.- Ober- Mörsbach Stein- Wingert Ehrlich Kundert Hommels- Neunk- Heimborn berg Malberg hausen Giesenhausen Limbach Heuzert Kroppach Luckenbach Atzelgift Liebenscheid Bhf. Ingelbach Astert Mörlen Langenbach b. Kirburg Marz- Müschenbach Streithausen hausen Weißenberg Nister Stein-Neukirch Lautzenbrücken Mudenbach Oberhattert Norken Kirburg Löhnfeld Borod Hof Hattert Mittelhattert Bölsberg Salzburg Brett- Willingen Pfuhl hausen Stangenrod Bad Marienberg Nisterau Hanwerth Niederhattert (Westerwald) Wahlrod Korb Oberroßbach Laad Hütte Hachenburg Stockhausen - Dehlingen Zinhain Nister-Möhrendorf Winkelbach Unnau Illfurth Fehl-Ritzhausen Waigandshain Merkelbach Gehlert Langen- Zehnhausen bei Rennerod Wied Hirtscheid bach Eichenstruth Homberg Alpenrod Erbach Niederroßbach Hardt Großseifen Höchstenbach Emmerichenhain Welken- Hahn bei Marienberg bach Nistertal Rehe Büdingen Schönberg Höhn-Urdorf Neustadt Neuhochstein Enspel Dreisbach Höhn Steinebach an der Wied Hellenhahn-Schellenberg Todtenberg Roßbach Lochum Oellingen Langenbaum Stockum Rennerod Mündersbach Schmidthahn Linden Püschen Stockum-Püschen Rotenhain Ailertchen Pottum Dreifelden Halbs Westernohe Freirachdorf Bellingen Hölzenhausen Schenkelberg Waldmühlen Hinterkirchen Stahlhofen a. Wiesensee Maroth Langenhahn Oberrod Hergenroth Hartenfels Seck Winnen Hintermühlen Herschbach Westerburg Elsoff (Westerwald) Steinen Hüblingen Wölferlingen Mittelhofen Rothenbach Brandscheid Freilingen Gershasen Rückeroth Düringen Marienrachdorf Kölbingen Gemünden Zürbach Obersayn Irmtraut -

AB6 Vorkommen Sechs Ausgewählter Heuschreckenarten Im Westerwald
Will und Liselott Masgeik-Stiftung 1 Will und Liselott Masgeik-Stiftung für Natur- und Landschaftsschutz Vorkommen sechs ausgewählter Heuschreckenarten entlang eines Höhengradienten im Westerwald, Rhein-Lahn-Kreis und Westerwaldkreis, Rheinland-Pfalz von SYBILLE HENNEMANN und PHILIPP SCHIEFENHÖVEL Arbeitsbericht Nr. 6, Oktober 2010, S.1- 23 Will und Liselott Masgeik-Stiftung 2 Inhaltsübersicht 1. Einleitung ................................................................................................................ 3 2. Die untersuchten Heuschreckenarten ....................................................................... 4 2.1. Leptophyes punctatissima (Bosc, 1792) Punktiere Zartschrecke .......................... 4 2.2 Phaneroptera falcata (Poda, 1761) Gemeine Sichelschrecke................................ 5 2.3. Tettigonia cantans (Fuessly, 1775) Zwitscherschrecke ........................................ 6 2.4. Tettigonia viridissima (Linnaeus, 1758) Grünes Heupferd ................................... 7 2.5. Pholidoptera griseoaptera (De Geer, 1773) Gewöhnliche Strauchschrecke ......... 7 2.6. Nemobius sylvestris (Bosc, 1792) Waldgrille....................................................... 8 3. Untersuchungsraum Westerwald ............................................................................. 9 3.1. Untersuchungsgebiete im Westerwald ............................................................ 10 4. Methoden ............................................................................................................. 14