Diplomarbeit
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

World Journal of Pharmaceutical Research Prasad Et Al
World Journal of Pharmaceutical Research Prasad et al. World Journal of Pharmaceutical Research SJIF Impact Factor 7.523 Volume 6, Issue 14, 551-557. Research Article ISSN 2277– 7105 CHEMICAL COMPOSITION OF THE ESSENTIAL OIL OF ANAPHALIS MARGARITACEA FROM MUNSYARI, PITHORAGARH, INDIA Chandan Ram, Pushpa Joshi and Kundan Prasad* Department of Chemistry, D.S.B. Campus, K. U., Nainital, Uttarakhand – 263002. Article Received on ABSTRACT 02 Sept. 2017, Anaphalis margaritacea shows antiasthmatic, anticoughing, Revised on 24 Sept. 2017, Accepted on 15 Oct. 2017 expectorant and antiphlogistic activity. The leaves of Anaphalis DOI: 10.20959/wjpr201714-9923 margaritacea were collected in the month of September 2015 from Kalamuni (Munsyari)near Pithoragarh, location of Kumaon Himalayas. *Corresponding Author The plant Anaphalis margaritacea including leaves, stem, and flowers Kundan Prasad were extracted by hydro distillation method for 6 hours using Department of Chemistry, Clevenger apparatus. The hydro-distilled essential oil of Anaphalis D.S.B. Campus, K. U., margaritacea has been examined by means of gas chromatography- Nainital, Uttarakhand – mass spectrometry (GC-MS).77 constituents have been identified 263002. representing 94.08% of the total oil. The main compounds in major amounts were E-caryophyllene (21.22%), δ-Cadinene(6.51%), Caryophyllene oxide (6.36%), Cubenol (4.08%), γ-Cadinene(2.32%), α-Pinene (2.22%) and Ledol (1.55%). KEYWORDS: (E)-caryophyllene, Anaphalis margaritacea, Essential oil, GC-MS. 1. INTRODUCTION As a part of an ongoing study of the essential oilcomposition of Munsyari forest plants, Anaphalis margaritacea was investigated. A.margaritacea belongs to Gnaphalieae (Family Asteraceae), a small tribe of 22 genera and 320 species, which occur worldwide (Ahmed et. -

Serpentine Geoecology of Eastern North America: a Review
RHODORA, Vol. 111, No. 945, pp. 21–108, 2009 E Copyright 2009 by the New England Botanical Club SERPENTINE GEOECOLOGY OF EASTERN NORTH AMERICA: A REVIEW NISHANTA RAJAKARUNA College of the Atlantic, 105 Eden Street, Bar Harbor, ME 04609 Current Address: Department of Biological Sciences, One Washington Square, San Jose´ State University, San Jose´, CA 95192-0100 e-mail: [email protected] TANNER B. HARRIS University of Massachusetts, Fernald Hall, 270 Stockbridge Road, Amherst, MA 01003 EARL B. ALEXANDER 1714 Kasba Street, Concord, CA 94518 ABSTRACT. Serpentine outcrops are model habitats for geoecological studies. While much attention has been paid to serpentine outcrops worldwide, the literature on eastern North American serpentine and associated biota is scant. This review examines the available literature, published and unpublished, on geoecological studies conducted on serpentine in eastern North America, from Newfoundland through Que´bec and New England south to Alabama. Most serpentine outcrops in the region have been mapped, but there have been few intensive mineralogical and pedological investigations. The limited soil analyses available suggest elevated levels of heavy metals such as Ni, near-neutralpH values, and Ca:Mg ratios , 1, characteristic of serpentine soils worldwide. Botanical studies to date have largely focused on floristic surveys and the influence of fire exclusion and grazing on indigenous vegetation. To date, 751 taxa of vascular plants belonging to 92 families have been reported from serpentine outcrops in the region. Two taxa, Agalinis acuta and Schwalbea americana, are federally endangered in the United States while many others are listed as rare, endangered, or imperiled in one or more states or provinces. -

Taxonomicko-Chorologická Studie Rodu Gnaphalium L. S.L. V České Republice
Katedra botaniky Přírodovědecké fakulty Univerzity Karlovy oddělení systematiky a ekologie cévnatých rostlin Taxonomicko-chorologická studie rodu Gnaphalium L. s.l. v České republice (A taxonomical and chorological study of the genus Gnaphalium L. s.l. in the Czech Republic) Komprimovaný soubor s redukovaným rozlišením obrázků (grafů), v případě zájmu o původní velikost, kontaktujte autora nebo nahlédněte do původního dokumentu uloženého na Přírodovědecké fakultě UK. Informace k rozšíření druhu Gnaphalium luteoalbum byly doplněny a publikovány ve Zprávách Čes. Bot. Společ. v roce 2004 (p. 171-183). Daniel Hrčka Diplomová práce Praha 2000 Poděkování Poděkování V úvodu své diplomové práce bych chtěl poděkovat především svému vedoucímu diplomové práce doc. dr. Bohdanu Křísovi, CSc. za vstřícný přístup a ochotu poradit při řešení dílčích taxonomických, ale i organizačních otázek. Za poskytnuté konzultace v otázkách morfometrické analýzy jsem zavázán RNDr. Karolu Marholdovi. Dobrými radami mi byli nápomocni také RNDr. Iva Bufková ze Správy NP Šumava (rozšíření druhu G. norvegicum na Šumavě) a RNDr. Jan Štursa ze Správy Krnapu (výskyt druhu G. supinum v Krkonoších). Za informace o nálezech druhu G. luteo-album jsem zavázán řadě botaniků, zejména bych chtěl poděkovat Ing. Čestmíru Deylovi, p. Václavu Chánovi, p. Rudolfu Kúrkovi, p. Pavlu Kusákovi a Mgr. Janu Sudovi. Za upozornění na možné křížence v Krkonoších děkuji RNDr. Františku Krahulcovi, CSc. Zavázán jsem též kolegům a kolegyním z oddělení, kteří se zájmem sledovali vývoj mojí diplomové práce od jejího zrodu a s ještě větším zájmem v jejích dokončovacích úpravách. Pavlíně T. a Tomášovi Č. děkuji za doprovod při pátrání po protěžích, Pavlíně také za spolupráci při sepisování druhů. -

1 Anleitung Für Die Geographische Artendatenbank Nachdem Sie Die
Anleitung für die geographische Artendatenbank Nachdem Sie die Anwendung gestartet haben, können Sie mit den entsprechenden Werkzeugen zur gewünschten geographischen Lage finden. Im linken Auswahlmenü wählen Sie bitte "Artenfunde digitalisieren". Mit dem Button können Sie einen Punkt in die Karte setzen. Bitte beachten Sie unbedingt, dass bevor ein Punkt gesetzt wird alles geladen ist. Es müssen ungefähr 1,4 MB (Artenliste mit ca. 19.000 Arten) geladen werden. Links erscheint dann ein Disketten Symbol . Nach klick auf das Symbol erscheint ein Fenster, in dem die erforderlichen Angaben einzutragen sind. Die Felder bis „Ort des Fundes“ sind Pflichtfelder, hier müssen unbedingt Eingaben gemacht werden. 1 Die Eingabe über Autor und E-Mail des Autors sowie Bemerkungen sollten ebenso eingegeben werden. Diese Angaben werden in der Datenbank gespeichert, jedoch nicht veröffentlicht. Diese Angaben dienen intern dazu, die Wertigkeit der Eingaben beurteilen zu können. Es stehen z.B. beim "Artenname" Pulldown-Listen zur Verfügung, dadurch wird eine einheitliche Eingabe garantiert. Es stehen ca. 19.000 Arten zur Verfügung. Sollte es für eine Art keinen deutschen Namen geben, steht der wissenschaftliche Name zur Verfügung. Die Liste ist alphabetisch sortiert. Außerdem werden in der Liste keine ü,ö,ä und ß verwendet. Die Namen werden mit Umlauten geschrieben. Die vollständige Liste finden Sie im Anhang zu dieser Anleitung. Das Datum ist im Format JJJJ-MM-TT (z.B. 2012-01-27) einzugeben. Das wäre der 27. Januar 2012. Beenden Sie alle Eingaben durch drücken auf "Speichern". Während Ihrer aktuellen Internetsitzung haben Sie die Möglichkeit mit dem Button die Eingabe des Datensatzes wieder aus der Datenbank zu löschen. -

An Empirical Assessment of a Single Family‐Wide Hybrid Capture Locus
APPLICATION ARTICLE An empirical assessment of a single family-wide hybrid capture locus set at multiple evolutionary timescales in Asteraceae Katy E. Jones1,14 , Tomáš Fér2 , Roswitha E. Schmickl2,3 , Rebecca B. Dikow4 , Vicki A. Funk5 , Sonia Herrando-Moraira6 , Paul R. Johnston7,8,9, Norbert Kilian1 , Carolina M. Siniscalchi10,11 , Alfonso Susanna6 , Marek Slovák2,12 , Ramhari Thapa10,11, Linda E. Watson13 , and Jennifer R. Mandel10,11 Manuscript received 27 February 2019; revision accepted PREMISE: Hybrid capture with high-throughput sequencing (Hyb-Seq) is a powerful tool for 5 September 2019. evolutionary studies. The applicability of an Asteraceae family-specific Hyb-Seq probe set and 1 Botanischer Garten und Botanisches Museum Berlin, Freie the outcomes of different phylogenetic analyses are investigated here. Universität Berlin, Königin-Luise-Str. 6–8, 14195 Berlin, Germany 2 Department of Botany, Faculty of Science, Charles University, METHODS: Hyb-Seq data from 112 Asteraceae samples were organized into groups at differ- Benátská 2, CZ 12800 Prague, Czech Republic ent taxonomic levels (tribe, genus, and species). For each group, data sets of non-paralogous 3 Institute of Botany, The Czech Academy of Sciences, Zámek 1, CZ loci were built and proportions of parsimony informative characters estimated. The impacts 25243 Průhonice, Czech Republic of analyzing alternative data sets, removing long branches, and type of analysis on tree reso- 4 Data Science Lab, Office of the Chief Information lution and inferred topologies were investigated in tribe Cichorieae. Officer, Smithsonian Institution, Washington, D.C. 20013-7012, USA RESULTS: Alignments of the Asteraceae family-wide Hyb-Seq locus set were parsimony infor- 5 Department of Botany, National Museum of Natural mative at all taxonomic levels. -

Medicinal and Aromatic Plants Diversity of Asteraceae in Uttarakhand
Nature and Science, 2010 Bisht and Purohit, Medicinal Plants Diversity Medicinal and Aromatic Plants Diversity of Asteraceae in Uttarakhand Vinod Kumar Bisht*1 &Vineet Purohit1 1Herbal Research & Development Institute, Gopeshwar - 246 401, Uttarakhand, India. *E-mail: [email protected]; [email protected] Abstract: Geographically Uttarakhand represents six eco-climatic regions from 300 m asl to 7817 m asl, and abode to a variety of medicinal and aromatic plants, and their products are being used by local communities from time immemorial. Asteraceae is the largest family of medicinal and aromatic plants in Uttarakhand. The species of the family are growing from low altitude of Tarai Bhabar to the alpine. There are annual, biennial or perennial herbs, under shrubs, shrubs. This paper includes the database on various aspects of medicinal plants of the family Asteraceae in the state. The database on various aspects includes species richness, genera richness, medicinal use and altitude for the different species of the family Asteraceae. “Nature and Science. 2010;8(3):121-128]. (ISSN: 1545-0740)”. Key Words: asteraceae, diversity, medicinal and aromatic plants Introduction and tropical mountains. Some of the plants in Asteraceae are Uttarakhand lies between 28053’24” and 31027’50” medically important and are also commonly featured in N latitudes and 77034’27” and 81002’22” E longitude and medical and phytochemical journals. Many members of the covers an area of 53,483 Km2. The state is divisible into four family are grown as ornamental plants for their flowers. major geological formations: Siwalik (outer) Himalaya, Uttarakhand represents the reservoir of 85 species Lesser (lower) Himalaya, Greater (main) Himalaya and of the family Asteraceae, which are being used by the local Trans Himalaya with six eco-climatic regions: Sub-tropical people from time immemorial in traditional health care (<1500 m), warm temperate (1500-2500 m), cool temperate system. -

Samenkatalog Graz 2016.Pdf
SAMENTAUSCHVERZEICHNIS Index Seminum Seed list Catalogue de graines des Botanischen Gartens der Karl-Franzens-Universität Graz Ernte / Harvest / Récolte 2016 Herausgegeben von Christian BERG, Kurt MARQUART & Jonathan WILFLING ebgconsortiumindexseminum2012 Institut für Pflanzenwissenschaften, Januar 2017 Botanical Garden, Institute of Plant Sciences, Karl- Franzens-Universität Graz 2 Botanischer Garten Institut für Pflanzenwissenschaften Karl-Franzens-Universität Graz Holteigasse 6 A - 8010 Graz, Austria Fax: ++43-316-380-9883 Email- und Telefonkontakt: [email protected], Tel.: ++43-316-380-5651 [email protected], Tel.: ++43-316-380-5747 Webseite: http://garten.uni-graz.at/ Zitiervorschlag : BERG, C., MARQUART, K. & Wilfling, J. (2017): Samentauschverzeichnis – Index Seminum – des Botanischen Gartens der Karl-Franzens-Universität Graz, Samenernte 2016. – 54 S., Karl-Franzens-Universität Graz. Personalstand des Botanischen Gartens Graz: Institutsleiter: Ao. Univ.-Prof. Mag. Dr. Helmut MAYRHOFER Wissenschaftlicher Gartenleiter: Dr. Christian BERG Gartenverwalter: Jonathan WILFLING, B. Sc. Gärtnermeister: Friedrich STEFFAN GärtnerInnen: Doris ADAM-LACKNER Viola BONGERS Magarete HIDEN Franz HÖDL Kurt MARQUART Franz STIEBER Ulrike STRAUSSBERGER Monika GABER Gartenarbeiter: Philip FRIEDL René MICHALSKI Oliver KROPIWNICKI Gärtnerlehrlinge: Gabriel Buchmann (1. Lehrjahr) Bahram EMAMI (3. Lehrjahr) Mario MARX (3. Lehrjahr) 3 Inhaltsverzeichnis / Contents / Table des matières Abkürzungen / List of abbreviations / Abréviations -

THE IRISH RED DATA BOOK 1 Vascular Plants
THE IRISH RED DATA BOOK 1 Vascular Plants T.G.F.Curtis & H.N. McGough Wildlife Service Ireland DUBLIN PUBLISHED BY THE STATIONERY OFFICE 1988 ISBN 0 7076 0032 4 This version of the Red Data Book was scanned from the original book. The original book is A5-format, with 168 pages. Some changes have been made as follows: NOMENCLATURE has been updated, with the name used in the 1988 edition in brackets. Irish Names and family names have also been added. STATUS: There have been three Flora Protection Orders (1980, 1987, 1999) to date. If a species is currently protected (i.e. 1999) this is stated as PROTECTED, if it was previously protected, the year(s) of the relevant orders are given. IUCN categories have been updated as follows: EN to CR, V to EN, R to V. The original (1988) rating is given in brackets thus: “CR (EN)”. This takes account of the fact that a rare plant is not necessarily threatened. The European IUCN rating was given in the original book, here it is changed to the UK IUCN category as given in the 2005 Red Data Book listing. MAPS and APPENDIX have not been reproduced here. ACKNOWLEDGEMENTS We are most grateful to the following for their help in the preparation of the Irish Red Data Book:- Christine Leon, CMC, Kew for writing the Preface to this Red Data Book and for helpful discussions on the European aspects of rare plant conservation; Edwin Wymer, who designed the cover and who, as part of his contract duties in the Wildlife Service, organised the computer applications to the data in an efficient and thorough manner. -

Анатомия И Морфология Anatomy and Morphology
86 Turczaninowia 2013, 16 (3) : 86–95 АНАТОМИЯ И МОРФОЛОГИЯ ANATOMY AND MORPHOLOGY УДК 582.998 (581.471) DOI: http:/dx.doi.org/10.14258/turczaninowia.16.3.15 Э.В. Бойко E.V. Boyko ПАПИЛЛЫ НА ПОВЕРХНОСТИ СЕМЯНОК ВИДОВ ASTERACEAE PAPILLAE ON THE SURFACE OF THE SEEDS OF SPECIES OF ASTERACEAE Аннотация. Методом сканирующей электронной микроскопии (СЭМ) исследована скульптура по- верхности семянок 371 вида из 168 родов, 21 трибы, пяти подсемейств семейства Asteraceae. У 75 видов из 45 родов, относящихся к 8 трибам, а также у Symphyllocarpus exilis (вида с неустановленным таксономическим положением в системе семейства) было выявлено наличие папилл. На поверхности семянок большинства видов трибы Cichorieae находятся папиллы разнообразного строения. Только у видов этой трибы папиллы об- разуют гребни (виды подтрибы Hypochaeridinae) и на поверхности экзокарпия многих видов находятся окру- глые гладкие гранулы эпикутикулярного воска, отсутствующие у видов других триб. На поверхности семянок видов триб Anthemideae, Astereae, Athroismeae, Calenduleae, Gnaphalieae, Heliantheae, Senecioneae папиллы имеются только у некоторых видов. У исследованных нами видов триб Barnadesieae, Mutisieae, Cynareae, Vernonieae, Arctotideae, Inuleae, Helenieae, Coreopsideae, Tageteae, Madieae, Millerieae, Eupatorieae папиллы не обнаружены. Длина, форма папилл, их расположение на поверхности семянки различны у разных видов и могут быть использованы как таксономический признак. Ключевые слова: Asteraceae, семянки, папиллы, морфология, сканирующая электронная микроскопия (СЭМ), систематика. Summary. The sculpture of the surface of cypselae (scanning electron microscopy) of 371 species of 168 gene ra, 21 tribes, five subfamilies of the family Asteraceae was investigated. 75 species of 45 genera belonging to 8 tribes and the species Symphyllocarpus exilis with uncertain taxonomic position, papillae were detected. Papillae of diverse structure have been revealed on the surface of the cypselae of the majority of Cichorieae species. -

Washington Flora Checklist a Checklist of the Vascular Plants of Washington State Hosted by the University of Washington Herbarium
Washington Flora Checklist A checklist of the Vascular Plants of Washington State Hosted by the University of Washington Herbarium The Washington Flora Checklist aims to be a complete list of the native and naturalized vascular plants of Washington State, with current classifications, nomenclature and synonymy. The checklist currently contains 3,929 terminal taxa (species, subspecies, and varieties). Taxa included in the checklist: * Native taxa whether extant, extirpated, or extinct. * Exotic taxa that are naturalized, escaped from cultivation, or persisting wild. * Waifs (e.g., ballast plants, escaped crop plants) and other scarcely collected exotics. * Interspecific hybrids that are frequent or self-maintaining. * Some unnamed taxa in the process of being described. Family classifications follow APG IV for angiosperms, PPG I (J. Syst. Evol. 54:563?603. 2016.) for pteridophytes, and Christenhusz et al. (Phytotaxa 19:55?70. 2011.) for gymnosperms, with a few exceptions. Nomenclature and synonymy at the rank of genus and below follows the 2nd Edition of the Flora of the Pacific Northwest except where superceded by new information. Accepted names are indicated with blue font; synonyms with black font. Native species and infraspecies are marked with boldface font. Please note: This is a working checklist, continuously updated. Use it at your discretion. Created from the Washington Flora Checklist Database on September 17th, 2018 at 9:47pm PST. Available online at http://biology.burke.washington.edu/waflora/checklist.php Comments and questions should be addressed to the checklist administrators: David Giblin ([email protected]) Peter Zika ([email protected]) Suggested citation: Weinmann, F., P.F. Zika, D.E. Giblin, B. -
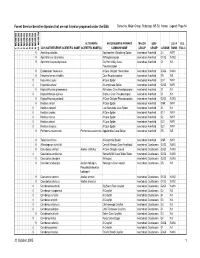
Sensitive Species That Are Not Listed Or Proposed Under the ESA Sorted By: Major Group, Subgroup, NS Sci
Forest Service Sensitive Species that are not listed or proposed under the ESA Sorted by: Major Group, Subgroup, NS Sci. Name; Legend: Page 94 REGION 10 REGION 1 REGION 2 REGION 3 REGION 4 REGION 5 REGION 6 REGION 8 REGION 9 ALTERNATE NATURESERVE PRIMARY MAJOR SUB- U.S. N U.S. 2005 NATURESERVE SCIENTIFIC NAME SCIENTIFIC NAME(S) COMMON NAME GROUP GROUP G RANK RANK ESA C 9 Anahita punctulata Southeastern Wandering Spider Invertebrate Arachnid G4 NNR 9 Apochthonius indianensis A Pseudoscorpion Invertebrate Arachnid G1G2 N1N2 9 Apochthonius paucispinosus Dry Fork Valley Cave Invertebrate Arachnid G1 N1 Pseudoscorpion 9 Erebomaster flavescens A Cave Obligate Harvestman Invertebrate Arachnid G3G4 N3N4 9 Hesperochernes mirabilis Cave Psuedoscorpion Invertebrate Arachnid G5 N5 8 Hypochilus coylei A Cave Spider Invertebrate Arachnid G3? NNR 8 Hypochilus sheari A Lampshade Spider Invertebrate Arachnid G2G3 NNR 9 Kleptochthonius griseomanus An Indiana Cave Pseudoscorpion Invertebrate Arachnid G1 N1 8 Kleptochthonius orpheus Orpheus Cave Pseudoscorpion Invertebrate Arachnid G1 N1 9 Kleptochthonius packardi A Cave Obligate Pseudoscorpion Invertebrate Arachnid G2G3 N2N3 9 Nesticus carteri A Cave Spider Invertebrate Arachnid GNR NNR 8 Nesticus cooperi Lost Nantahala Cave Spider Invertebrate Arachnid G1 N1 8 Nesticus crosbyi A Cave Spider Invertebrate Arachnid G1? NNR 8 Nesticus mimus A Cave Spider Invertebrate Arachnid G2 NNR 8 Nesticus sheari A Cave Spider Invertebrate Arachnid G2? NNR 8 Nesticus silvanus A Cave Spider Invertebrate Arachnid G2? NNR -

Designed Plant Communities for Challenging Urban Environments in Southern Finland - Based on the German Mixed Planting System Sara Seppänen
Designed plant communities for challenging urban environments in southern Finland - based on the German mixed planting system Sara Seppänen Independent Project • 30 credits Landscape Architecture – Master´s Programme Alnarp 2019 Designed plant communities for challenging urban environments in southern Finland - based on the German mixed planting system Sara Seppänen Supervisor: Karin Svensson, SLU, Department of Landscape Architecture, Planning and Management Examiner: Jitka Svensson, SLU, Department of Landscape Architecture, Planning and Management Co-examiner: Anders Westin, SLU, Department of Landscape Architecture, Planning and Management Credits: 30 Project Level: A2E Course title: Independent Project in Landscape Architecture Course code: EX0852 Programme: Landscape Architecture – Master´s Programme Place of publication: Alnarp Year of publication: 2019 Cover art: Sara Seppänen Online publication: http://stud.epsilon.slu.se Keywords: designed plant community, ecological planting, dynamic planting, naturalistic planting, mixed planting system, planting design, urban habitats SLU, Swedish University of Agricultural Sciences Faculty of Landscape Architecture, Horticulture and Crop Production Science Department of Landscape Architecture, Planning and Management Abstract Traditional perennial borders require a lot of maintenance and climate to get an understanding of what is required of a plant to are therefore not so common in public areas in Finland. There is survive in these conditions. a need for low-maintenance perennial plantings that can tolerate The thesis looks into the difference between traditional the dry conditions in urban areas. Especially areas close to horticultural perennial plantings and designed plant communities, traffic, such as the middle of roundabouts and traffic islands need such as the German mixed plantings. easily manageable vegetation and they are therefore normally covered in grass or mass plantings of shrubs.