Your Name Here
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Notes on Coccinellid Beetles (Coleoptera: Coccinellidae) from Forest Ecosystem of Uttarakhand, India
Journal of Biological Control, 33(1): 1-6,2019, DOI: 10.18311/jbc/2019/23214 Volume: 33 No. 1 (March) 2019 Coccinellid beetles from Uttarakhand forests - 1 Spider fauna in maize ecosystem - 27 Research Article Notes on coccinellid beetles (Coleoptera: Coccinellidae) from forest ecosystem of Uttarakhand, India AKHILESH KUMAR MISHRA* and MOHD. YOUSUF Forest Protection Division (Forest Entomology Discipline), Forest Research Institute, P.O. New Forest, Dehra Dun – 248006, Uttarakhand, India *Corresponding author E-mail: [email protected] ABSTRACT: Present study on diversity of coccinellid beetles comprises a significant group of predatory beetles which are being utilized in biological control of insect pests from more than one hundred years ago throughout the world. An extensive survey and collection of coccinellid beetles was carried out by following the sweep net and handpicking method during a period of two years, June 2016 to May2018, in Uttarakhand, India. Collection of beetles was also made at different altitudes. All the collected beetles have been identified up to species level. In total, fifteen species of coccinellid beetles were identified as Aiolocaria hexaspilota (Hope), Anegleis cardoni (Weise), Brumoides suturalis (Fabricius), Coccinella septempunctata Linnaeus, C. transversalis Fabricius, Harmonia dimidiata (Fabricius), Henosepilachna vigintioctopunctata (Fabricius), Hippodamia variegata (Goeze), Illeis confusa Timberlake, Menochilus sexmaculatus (Fabricius), Micraspis allardi (Mulsant), Micraspis univittata (Hope), Oenopia sexareata (Mulsant), Platynaspidius saundersi (Crotch) and Propylea dissecta (Mulsant). H. vigintioctopunctata is phytophagous while I. confusa is mycophagous; all other species are predatory feeding on mealy bugs and aphids occurring on forest tree species. Out of all identified species, four species A. hexaspilota, I. confusa, O. sexareata and P. -

COLEOPTERA COCCINELLIDAE) INTRODUCTIONS and ESTABLISHMENTS in HAWAII: 1885 to 2015
AN ANNOTATED CHECKLIST OF THE COCCINELLID (COLEOPTERA COCCINELLIDAE) INTRODUCTIONS AND ESTABLISHMENTS IN HAWAII: 1885 to 2015 JOHN R. LEEPER PO Box 13086 Las Cruces, NM USA, 88013 [email protected] [1] Abstract. Blackburn & Sharp (1885: 146 & 147) described the first coccinellids found in Hawaii. The first documented introduction and successful establishment was of Rodolia cardinalis from Australia in 1890 (Swezey, 1923b: 300). This paper documents 167 coccinellid species as having been introduced to the Hawaiian Islands with forty-six (46) species considered established based on unpublished Hawaii State Department of Agriculture records and literature published in Hawaii. The paper also provides nomenclatural and taxonomic changes that have occurred in the Hawaiian records through time. INTRODUCTION The Coccinellidae comprise a large family in the Coleoptera with about 490 genera and 4200 species (Sasaji, 1971). The majority of coccinellid species introduced into Hawaii are predacious on insects and/or mites. Exceptions to this are two mycophagous coccinellids, Calvia decimguttata (Linnaeus) and Psyllobora vigintimaculata (Say). Of these, only P. vigintimaculata (Say) appears to be established, see discussion associated with that species’ listing. The members of the phytophagous subfamily Epilachninae are pests themselves and, to date, are not known to be established in Hawaii. None of the Coccinellidae in Hawaii are thought to be either endemic or indigenous. All have been either accidentally or purposely introduced. Three species, Scymnus discendens (= Diomus debilis LeConte), Scymnus ocellatus (=Scymnobius galapagoensis (Waterhouse)) and Scymnus vividus (= Scymnus (Pullus) loewii Mulsant) were described by Sharp (Blackburn & Sharp, 1885: 146 & 147) from specimens collected in the islands. There are, however, no records of introduction for these species prior to Sharp’s descriptions. -

Taxonomic Redescription of the Species of Sub- Family Chilocorinae
International Journal of Chemical Studies 2018; 6(6): 1465-1469 P-ISSN: 2349–8528 E-ISSN: 2321–4902 IJCS 2018; 6(6): 1465-1469 Taxonomic redescription of the species of sub- © 2018 IJCS Received: 26-09-2018 family Chilocorinae (Coleoptera: Coccinellidae) Accepted: 30-10-2018 from Jammu and Kashmir, India Ajaz Ahmad Kundoo Division of Entomology, Sher-e-Kashmir University of Ajaz Ahmad Kundoo, Akhtar Ali Khan, Ishtiyaq Ahad, NA Bhat, MA Agricultural Sciences and Chatoo and Khalid Rasool Technology of Kashmir, Wadura Campus, Baramullah, Jammu and Kashmir, India Abstract Ladybugs are diverse group of living organisms. They belong to family Coccinellidae of order Akhtar Ali Khan Coleoptera. The family has been subdivided into six subfamilies: Sticholotidinae, Chilochorinae, Division of Entomology, Scymninae, Coccidulinae, Coccinellinae and Epilachninae. These are universal predators and occupy Sher-e-Kashmir University of important place in biological control. In this paper four species of the subfamily Chilocorinae have been Agricultural Sciences and collected and rediscribed as no taxonomic work has been done on this group in Kashmir, India. This Technology of Kashmir, paper provides a detailed taxonomy of Chilocorus infernalis, Chilocorus rubidus, Pricibrumus Shalimar Campus, Jammu and uropygialis and Platynaspidius saundersi on the basis of advanced taxonomic character that is male Kashmir, India genitalia. Detailed description of adults, male genitalia and taxonomic keys are provided for each species Ishtiyaq Ahad along with color plates. Division of Entomology, Sher-e-Kashmir University of Keywords: Chilocorinae, Kashmir, male genitalia, taxonomy, taxonomic keys. Agricultural Sciences and Technology of Kashmir, Wadura Introduction Campus, Baramullah, Jammu Coccinellids are commonly known as ladybird beetles. -
Wikipedia Beetles Dung Beetles Are Beetles That Feed on Feces
Wikipedia beetles Dung beetles are beetles that feed on feces. Some species of dung beetles can bury dung times their own mass in one night. Many dung beetles, known as rollers , roll dung into round balls, which are used as a food source or breeding chambers. Others, known as tunnelers , bury the dung wherever they find it. A third group, the dwellers , neither roll nor burrow: they simply live in manure. They are often attracted by the dung collected by burrowing owls. There are dung beetle species of different colours and sizes, and some functional traits such as body mass or biomass and leg length can have high levels of variability. All the species belong to the superfamily Scarabaeoidea , most of them to the subfamilies Scarabaeinae and Aphodiinae of the family Scarabaeidae scarab beetles. As most species of Scarabaeinae feed exclusively on feces, that subfamily is often dubbed true dung beetles. There are dung-feeding beetles which belong to other families, such as the Geotrupidae the earth-boring dung beetle. The Scarabaeinae alone comprises more than 5, species. The nocturnal African dung beetle Scarabaeus satyrus is one of the few known non-vertebrate animals that navigate and orient themselves using the Milky Way. Dung beetles are not a single taxonomic group; dung feeding is found in a number of families of beetles, so the behaviour cannot be assumed to have evolved only once. Dung beetles live in many habitats , including desert, grasslands and savannas , [9] farmlands , and native and planted forests. They are found on all continents except Antarctica. They eat the dung of herbivores and omnivores , and prefer that produced by the latter. -

Coleopteran Survey in the Kah-Nyawvillage ,Chaungzon
Dagon University Commemoration of 25th Anniversary Silver Jubilee Research Journal 2019, Vol.9, No.2 245 Coleopteran survey in the Kah-nyawvillage ,Chaungzon Township, Mon State Nu NuTun1 Abstract A survey of beetle faunal occurrences and composition was studied in the Kah-nyawvillage,Chaungzon Township, Mon State during December 2017 to October 2018.Beetles were collected by standard trapping method and bare hand collection methods in only one site with two crops growing season. A total of 22 species of beetles representing 7 families of Cerambycidae, Chrysomelidae, Coccinellidae, Bolboceratidae, Carabidae, Scarabaeidae, and Hydrophilidae were recorded in this study. Among these families, family Coccinellidae was the most diverse beetles recorded in the study area, while the family Hydrophilidae ,Bolboceratidae and Cerambycidaewere the least diverse beetle recorded with one species only. Keywords: Coleoptera, beetles, growing season Introduction Insects are the largest group of animals in the world. The numbers of insects are more or less the same amount compared to the numbers of all other animals together. The beetles, described in the world are about four hundred thousand species and it is about 40% of total known insects of the world. One of the most distinctive features of the Coleoptera is the structure of the wings. Most beetles have four wings, with the front pair thickened, leathery or hard and brittle, and usually meeting in a straight line down the middle of the back and covering the hind wings (hence the order names coleo-sheath, ptera-wings). The hind wings are membranous, usually longer than the front wings, and when not in used are folded up under the front wings. -

Impacts of Weed Management on Ladybird
Impacts of weed management on ladybird (Coleoptera: Coccinellidae) abundance and diversity on resident vegetation in a citrus orchard Marie Rothé, Nina Pelletier, Anna-Morgane Touneji-Catouaria, Christian Bockstaller, Fabrice Le Bellec, Alain Ratnadass To cite this version: Marie Rothé, Nina Pelletier, Anna-Morgane Touneji-Catouaria, Christian Bockstaller, Fabrice Le Bellec, et al.. Impacts of weed management on ladybird (Coleoptera: Coccinellidae) abundance and diversity on resident vegetation in a citrus orchard. International Journal of Tropical Insect Science, Cambridge University Press (CUP), 2019, 39 (4), pp.325-331. 10.1007/s42690-019-00055-0. hal- 02460146 HAL Id: hal-02460146 https://hal.archives-ouvertes.fr/hal-02460146 Submitted on 29 Jan 2020 HAL is a multi-disciplinary open access L’archive ouverte pluridisciplinaire HAL, est archive for the deposit and dissemination of sci- destinée au dépôt et à la diffusion de documents entific research documents, whether they are pub- scientifiques de niveau recherche, publiés ou non, lished or not. The documents may come from émanant des établissements d’enseignement et de teaching and research institutions in France or recherche français ou étrangers, des laboratoires abroad, or from public or private research centers. publics ou privés. Impacts of weed management on ladybird (Coleoptera: Coccinellidae) abundance and diversity on resident vegetation in a citrus orchard Marie Rothé, Nina Pelletier, Anna- Morgane Touneji-Catouaria, Christian Bockstaller, Fabrice Le Bellec & Alain Ratnadass International Journal of Tropical Insect Science e-ISSN 1742-7592 Int J Trop Insect Sci DOI 10.1007/s42690-019-00055-0 1 23 Your article is protected by copyright and all rights are held exclusively by African Association of Insect Scientists. -

Surveying for Terrestrial Arthropods (Insects and Relatives) Occurring Within the Kahului Airport Environs, Maui, Hawai‘I: Synthesis Report
Surveying for Terrestrial Arthropods (Insects and Relatives) Occurring within the Kahului Airport Environs, Maui, Hawai‘i: Synthesis Report Prepared by Francis G. Howarth, David J. Preston, and Richard Pyle Honolulu, Hawaii January 2012 Surveying for Terrestrial Arthropods (Insects and Relatives) Occurring within the Kahului Airport Environs, Maui, Hawai‘i: Synthesis Report Francis G. Howarth, David J. Preston, and Richard Pyle Hawaii Biological Survey Bishop Museum Honolulu, Hawai‘i 96817 USA Prepared for EKNA Services Inc. 615 Pi‘ikoi Street, Suite 300 Honolulu, Hawai‘i 96814 and State of Hawaii, Department of Transportation, Airports Division Bishop Museum Technical Report 58 Honolulu, Hawaii January 2012 Bishop Museum Press 1525 Bernice Street Honolulu, Hawai‘i Copyright 2012 Bishop Museum All Rights Reserved Printed in the United States of America ISSN 1085-455X Contribution No. 2012 001 to the Hawaii Biological Survey COVER Adult male Hawaiian long-horned wood-borer, Plagithmysus kahului, on its host plant Chenopodium oahuense. This species is endemic to lowland Maui and was discovered during the arthropod surveys. Photograph by Forest and Kim Starr, Makawao, Maui. Used with permission. Hawaii Biological Report on Monitoring Arthropods within Kahului Airport Environs, Synthesis TABLE OF CONTENTS Table of Contents …………….......................................................……………...........……………..…..….i. Executive Summary …….....................................................…………………...........……………..…..….1 Introduction ..................................................................………………………...........……………..…..….4 -

Dysdercus Cingulatus
Prelims (F) Page i Monday, August 25, 2003 9:52 AM Biological Control of Insect Pests: Southeast Asian Prospects D.F. Waterhouse (ACIAR Consultant in Plant Protection) Australian Centre for International Agricultural Research Canberra 1998 Prelims (F) Page ii Monday, August 25, 2003 9:52 AM The Australian Centre for International Agricultural Research (ACIAR) was established in June 1982 by an Act of the Australian Parliament. Its primary mandate is to help identify agricultural problems in developing countries and to commission collaborative research between Australian and developing country researchers in fields where Australia has special competence. Where trade names are used this constitutes neither endorsement of nor discrimination against any product by the Centre. ACIAR MONOGRAPH SERIES This peer-reviewed series contains the results of original research supported by ACIAR, or deemed relevant to ACIAR’s research objectives. The series is distributed internationally, with an emphasis on the Third World ©Australian Centre for International Agricultural Research GPO Box 1571, Canberra, ACT 2601. Waterhouse, D.F. 1998, Biological Control of Insect Pests: Southeast Asian Prospects. ACIAR Monograph No. 51, 548 pp + viii, 1 fig. 16 maps. ISBN 1 86320 221 8 Design and layout by Arawang Communication Group, Canberra Cover: Nezara viridula adult, egg rafts and hatching nymphs. Printed by Brown Prior Anderson, Melbourne ii Prelims (F) Page iii Monday, August 25, 2003 9:52 AM Contents Foreword vii 1 Abstract 1 2 Estimation of biological control -

Current State of Knowledge on Wolbachia Infection Among Coleoptera: a Systematic Review
Current state of knowledge on Wolbachia infection among Coleoptera: a systematic review Łukasz Kajtoch1 and Nela Kotásková2 1 Institute of Systematics and Evolution of Animals Polish Academy of Sciences, Krakow, Poland 2 Faculty of Science, University of Ostrava, Ostrava, Czech Republic ABSTRACT Background. Despite great progress in studies on Wolbachia infection in insects, the knowledge about its relations with beetle species, populations and individuals, and the effects of bacteria on these hosts, is still unsatisfactory. In this review we summarize the current state of knowledge about Wolbachia occurrence and interactions with Coleopteran hosts. Methods. An intensive search of the available literature resulted in the selection of 86 publications that describe the relevant details about Wolbachia presence among beetles. These publications were then examined with respect to the distribution and taxonomy of infected hosts and diversity of Wolbachia found in beetles. Sequences of Wolbachia genes (16S rDNA, ftsZ) were used for the phylogenetic analyses. Results. The collected publications revealed that Wolbachia has been confirmed in 204 beetle species and that the estimated average prevalence of this bacteria across beetle species is 38.3% and varies greatly across families and genera (0–88% infected members) and is much lower (c. 13%) in geographic studies. The majority of the examined and infected beetles were from Europe and East Asia. The most intensively studied have been two groups of herbivorous beetles: Curculionidae and Chrysomelidae. Coleoptera harbor Wolbachia belonging to three supergroups: F found in only three species, and A and B found in similar numbers of beetles (including some doubly infected); however Submitted 14 November 2017 the latter two were most prevalent in different families. -
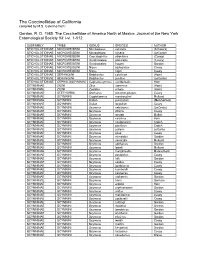
The Coccinellidae of California Compiled by M.S
The Coccinellidae of California compiled by M.S. Caterino from: Gordon, R. D. 1985. The Coccinellidae of America North of Mexico. Journal of the New York Entomological Society 93: i-vi, 1-912. SUBFAMILY TRIBE GENUS SPECIES AUTHOR STICHOLOTIDINAE MICROWEISEINI Microweisea suturalis (Schwarz) STICHOLOTIDINAE MICROWEISEINI Microweisea misella (LeConte) STICHOLOTIDINAE MICROWEISEINI Coccidophilus atronitens (Casey) STICHOLOTIDINAE MICROWEISEINI Gnathoweiea planiceps (Casey) STICHOLOTIDINAE MICROWEISEINI Gnathoweiea hageni Gordon STICHOLOTIDINAE MICROWEISEINI Nipus biplagiatus Casey STICHOLOTIDINAE MICROWEISEINI Nipus niger Casey STICHOLOTIDINAE SERANGIINI Delphastus catalinae (Horn) STICHOLOTIDINAE SERANGIINI Delphastus pusillus (LeConte) STICHOLOTIDINAE CEPHALOSCYMNINI Cephaloscymnus occidentalis Horn SCYMNINAE ZILINI Zilus aterrimus (Horn) SCYMNINAE ZILINI Zagloba ornata (Horn) SCYMNINAE STETHORINI Stethorus punctum picipes Casey SCYMNINAE SCYMNINI Cryptolaemus montrouzieri Mulsant SCYMNINAE SCYMNINI Didion punctatum (Melsheimer) SCYMNINAE SCYMNINI Didion longulum Casey SCYMNINAE SCYMNINI Scymnus nebulosus (LeConte) SCYMNINAE SCYMNINI Scymnus dificilis Casey SCYMNINAE SCYMNINI Scymnus fenderi Malkin SCYMNINAE SCYMNINI Scymnus caurinus Horn SCYMNINAE SCYMNINI Scymnus coniferarum Crotch SCYMNINAE SCYMNINI Scymnus pacificus Crotch SCYMNINAE SCYMNINI Scymnus pallens LeConte SCYMNINAE SCYMNINI Scymnus gilae Casey SCYMNINAE SCYMNINI Scymnus mimoides Gordon SCYMNINAE SCYMNINI Scymnus cervicalis Mulsant SCYMNINAE SCYMNINI Scymnus apithanus Gordon -

Developmental Biology and Feeding Efficiency of Menochilus Sexmaculatus (Coleoptera: Coccinellidae)(Fabricius) Reared on Aphis Craccivora (Hemiptera: Aphididae)(Koch)
Tropical Agricultural Research Vol. 27 (2): 115 – 122 (2016) Developmental Biology and Feeding Efficiency of Menochilus sexmaculatus (Coleoptera: Coccinellidae) (Fabricius) reared on Aphis craccivora (Hemiptera: Aphididae) (Koch) T.D.C. Priyadarshani*, K.S. Hemachandra1, U.G.A.I. Sirisena2and H.N.P. Wijayagunasekara1 Postgraduate Institute of Agriculture University of Peradeniya Sri Lanka ABSTRACT: Menochilus sexmaculatus (Fabricius) predates on soft bodied, plants sap feeding insect pests. This species is a potential biocontrol agent to use in augmentative release programmes and requires more biological and ecological data. The objective of this study was to examine the development biology of M.sexmaculatus and to assess its suitability as a biocontrol agent. The study was conducted in the Entomology Research Laboratory, Department of Agricultural Biology, Faculty of Agriculture, University of Peradeniya from January to June, 2015. All the experiments were conducted under laboratory conditions at 27ºC and 80 % RH. Mean incubation period of eggs was 3.0 ± 0.4 days. The total larval duration was 7.1 ± 0.5 days; L1, L2, L3 and L4 durations were 2.1 ± 0.3, 1.1 ± 0.4, 1.9 ± 0.3 and 1.9 ± 0.3 days, respectively. The pre-pupal and pupal periods were 1.1 ± 0.3 and 3.1± 0.3 days, respectively. Mean longevity of male and female beetles were 38.0 ± 0.6 and 47.3 ± 1.0 days, respectively. Mean pre-oviposition period was 3.0 ± 0.1 days and the oviposition period was 43.3 ± 1.0 days. The mean body length of L1, L2, L3 and L4 instars were 1.9 ± 0.1, 2.7 ± 0.3, 6.0 ± 0.1 and 7.8 ± 0.5 mm while, the mean width were 0.4± 0.1, 0.9 ± 0.0, 1.2 ± 0.1 and 3.3 ± 0.1 mm. -

Taxonomic Study on Ladybird Beetle (Coleoptera: Coccinellidae) Fauna of Tando Jam, Sindh
INT. J. BIOL. BIOTECH., 13 (1): 43-47, 2016. TAXONOMIC STUDY ON LADYBIRD BEETLE (COLEOPTERA: COCCINELLIDAE) FAUNA OF TANDO JAM, SINDH Raheem Bux Mashori1*, Imran Khatri1, Maqsood Anwar Rustamani1, Nazeer Ahmed Panhwar1 and Zubair Ahmed2 1Department of Entomology, Sindh Agriculture University, Tando Jam, 2Department of Zoology, Federal Urdu University of Arts, Science & Technology, Karachi Corresponding Author: Raheem Bux Mashori; Email: [email protected] ABSTRACT Coccinellid beetles were collected from various localities of Tandojam, Sindh. This study indicated the occurrence of nine species belonging to three subfamilies of family Coccinellidae. 1. Cheilomenes sexmaculata (Fabricius, 1781) | 2. Hippodamia variegata (Goeze, 1777) | Tribe – Coccinellini Latreile, 1807 of subfamily 3. Coccinella septempunctata Linnaeus, 1758 | Coccinellinae Latreile, 1807 4. Coccinella transversalis Fabricius, 1781 | 5. Coccinella undecimpunctata Linnaeus 1758 | 6. Harmonia axyridis Tytthaspis 16-punctata (Pallas, 1773) | 7. Bulaea lichatschovi (Hummel 1827) - Tribe Bulaeini Savoyskaya, 1969 of subfamily Coccinellinae Latreile, 1807 8. Brumoides suturalis (Fabricius, 1798) - Tribe Chilocorini Mulsant, 1846 of subfamily Chilocorinae Mulsant, 1846 9. Henosepilachna vigintioctopunctata (Fabricius, 1775) - Tribe Epilachnini Mulsant 1846 of subfamily Epilachninae Mulsant 1846. Key words: Coccinellidae, Tando Jam, ladybird beetles INTRODUCTION The family Coccinellidae, designated as Ladybirds or Ladybugs (Kovar, 1996; Hunt et al., 2007). The Coccinellid (latin word) means "scarlet" (Brown, 2007). The name "ladybird" originated in Britain where the insects became known as 'Our Lady's bird' or the Lady beetle (Samaha, 2010). It is interesting that Linnaeus – the great naturalist’s first zoological contribution to the nomenclature was on Coccinella. He described this genus in 1758 with its 36 European representatives. Laterille put this genus under newly established Coccinellidae.