Mme SLIMANE TAMACHA Farah
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Holothuriidae 1165
click for previous page Order Aspidochirotida - Holothuriidae 1165 Order Aspidochirotida - Holothuriidae HOLOTHURIIDAE iagnostic characters: Body dome-shaped in cross-section, with trivium (or sole) usually flattened Dand dorsal bivium convex and covered with papillae. Gonads forming a single tuft appended to the left dorsal mesentery. Tentacular ampullae present, long, and slender. Cuvierian organs present or absent. Dominant spicules in form of tables, buttons (simple or modified), and rods (excluding C-and S-shaped rods). Key to the genera and subgenera of Holothuriidae occurring in the area (after Clark and Rowe, 1971) 1a. Body wall very thick; podia and papillae short, more or less regularly arranged on bivium and trivium; spicules in form of rods, ovules, rosettes, but never as tables or buttons ......→ 2 1b. Body wall thin to thick; podia irregularly arranged on the bivium and scattered papillae on the trivium; spicules in various forms, with tables and/or buttons present ...(Holothuria) → 4 2a. Tentacles 20 to 30; podia ventral, irregularly arranged on the interradii or more regularly on the radii; 5 calcified anal teeth around anus; spicules in form of spinose rods and rosettes ...........................................Actinopyga 2b. Tentacles 20 to 25; podia ventral, usually irregularly arranged, rarely on the radii; no calcified anal teeth around anus, occasionally 5 groups of papillae; spicules in form of spinose and/or branched rods and rosettes ............................→ 3 3a. Podia on bivium arranged in 3 rows; spicules comprise rocket-shaped forms ....Pearsonothuria 3b. Podia on bivium not arranged in 3 rows; spicules not comprising rocket-shaped forms . Bohadschia 4a. Spicules in form of well-developed tables, rods and perforated plates, never as buttons .....→ 5 4b. -

SPC Beche-De-Mer Information Bulletin #39 – March 2019
ISSN 1025-4943 Issue 39 – March 2019 BECHE-DE-MER information bulletin v Inside this issue Editorial Towards producing a standard grade identification guide for bêche-de-mer in This issue of the Beche-de-mer Information Bulletin is well supplied with Solomon Islands 15 articles that address various aspects of the biology, fisheries and S. Lee et al. p. 3 aquaculture of sea cucumbers from three major oceans. An assessment of commercial sea cu- cumber populations in French Polynesia Lee and colleagues propose a procedure for writing guidelines for just after the 2012 moratorium the standard identification of beche-de-mer in Solomon Islands. S. Andréfouët et al. p. 8 Andréfouët and colleagues assess commercial sea cucumber Size at sexual maturity of the flower populations in French Polynesia and discuss several recommendations teatfish Holothuria (Microthele) sp. in the specific to the different archipelagos and islands, in the view of new Seychelles management decisions. Cahuzac and others studied the reproductive S. Cahuzac et al. p. 19 biology of Holothuria species on the Mahé and Amirantes plateaux Contribution to the knowledge of holo- in the Seychelles during the 2018 northwest monsoon season. thurian biodiversity at Reunion Island: Two previously unrecorded dendrochi- Bourjon and Quod provide a new contribution to the knowledge of rotid sea cucumbers species (Echinoder- holothurian biodiversity on La Réunion, with observations on two mata: Holothuroidea). species that are previously undescribed. Eeckhaut and colleagues P. Bourjon and J.-P. Quod p. 27 show that skin ulcerations of sea cucumbers in Madagascar are one Skin ulcerations in Holothuria scabra can symptom of different diseases induced by various abiotic or biotic be induced by various types of food agents. -

Europa, Glorieuses, Juan De Nova), Mozambique Channel, France Chantal Conand, Thierry Mulochau, Sabine Stöhr, Marc Eléaume, Pascale Chabanet
Inventory of echinoderms in the Iles Eparses (Europa, Glorieuses, Juan de Nova), Mozambique Channel, France Chantal Conand, Thierry Mulochau, Sabine Stöhr, Marc Eléaume, Pascale Chabanet To cite this version: Chantal Conand, Thierry Mulochau, Sabine Stöhr, Marc Eléaume, Pascale Chabanet. Inventory of echinoderms in the Iles Eparses (Europa, Glorieuses, Juan de Nova), Mozambique Channel, France. Acta Oecologica, Elsevier, 2016, 72, pp.53-61. 10.1016/j.actao.2015.06.007. hal-01306705 HAL Id: hal-01306705 https://hal.univ-reunion.fr/hal-01306705 Submitted on 26 Apr 2016 HAL is a multi-disciplinary open access L’archive ouverte pluridisciplinaire HAL, est archive for the deposit and dissemination of sci- destinée au dépôt et à la diffusion de documents entific research documents, whether they are pub- scientifiques de niveau recherche, publiés ou non, lished or not. The documents may come from émanant des établissements d’enseignement et de teaching and research institutions in France or recherche français ou étrangers, des laboratoires abroad, or from public or private research centers. publics ou privés. Inventory of echinoderms in the Iles Eparses (Europa, Glorieuses, Juan de Nova), Mozambique Channel, France * C. Conand a, b, , T. Mulochau c,S.Stohr€ d,M.Eleaume b, P. Chabanet e a Ecomar, UniversitedeLaReunion, 97715 La Reunion, France b Departement Milieux et Peuplements Aquatiques, MNHN, 47 rue Cuvier, 75005 Paris, France c BIORECIF, 3 ter rue de l'albatros, 97434 La Reunion, France d Swedish Museum of Natural History, Frescativagen€ 40, 114 18 Stockholm, Sweden e IRD, BP 50172, 97492 Ste Clotilde, La Reunion, France abstract The multidisciplinary programme BioReCIE (Biodiversity, Resources and Conservation of coral reefs at Eparses Is.) inventoried multiple marine animal groups in order to provide information on the coral reef health of the Iles Eparses. -

La Bêche-De-Mer, Bulletin D'information De La CPS N°30
Secrétariat général ISSN 1025-742X de la Communauté du Pacifique Numéro 30 – Septembre 2010 LA BÊCHE-DE-MER bulletin d’information Sommaire Éditorial Renforcer les capacités de gestion durable Le présent numéro de La Bêche-de-mer vous propose huit articles sur l’élevage et des ressources en holothuries dans l’océan Indien occidental la taxonomie des holothuries ainsi que sur la situation de la pêche d’holothuries N. Muthiga et al. p. 3 dans divers pays. De toute évidence, la gestion des ressources en holothuries est Signes d’une surpêche aiguë des ressources désormais prise au sérieux dans la plupart des pays. De nombreuses études de en holothuries dans le Sultanat d’Oman terrain ont révélé que, partout et sans exception aucune, les populations sauvages K.M. Al-Rashdi and M.R. Claereboudt p. 10 d’holothuries visées par la pêche sont appauvries. Les écologistes ont émis des État des lieux de la pêche des holothuries au Sri Lanka recommandations aux ministères de tutelle dans tous les pays producteurs de D.C.T. Dissanayake et al. p. 14 bêche-de-mer. Les prochaines années nous diront si ces recommandations sont Méthodes de ramassage et de transfor- suivies et si des méthodes d’exploitation sans extraction, comme l’aquaculture, mation des holothuries : quelle est leur connaissent un essor suffisant. incidence sur la qualité et la valeur des bêches-de-mer produites aux Îles Fidji ? Le premier article, rédigé par Nyawira Muthiga et al. (p. 3), résume les recom- R. Ram et al. p. 21 mandations issues d’un projet régional sur les holothuries, financé par une sub- Effet de la température de l’eau sur la survie et la croissance des juvéniles vention MASMA (Marine Science for Management, les sciences de la mer au ser- endobenthiques de Holothuria scabra vice de la gestion) et dirigé par la Wildlife Conservation Society et l’Université de (Echinodermata : Holothuroidea) élevés La Réunion. -

High-Value Components and Bioactives from Sea Cucumbers for Functional Foods—A Review
Mar. Drugs 2011, 9, 1761-1805; doi:10.3390/md9101761 OPEN ACCESS Marine Drugs ISSN 1660-3397 www.mdpi.com/journal/marinedrugs Review High-Value Components and Bioactives from Sea Cucumbers for Functional Foods—A Review Sara Bordbar 1, Farooq Anwar 1,2 and Nazamid Saari 1,* 1 Faculty of Food Science and Technology, Universiti Putra Malaysia, Serdang, Selangor 43400, Malaysia; E-Mails: [email protected] (S.B.); [email protected] (F.A.) 2 Department of Chemistry and Biochemistry, University of Agriculture, Faisalabad 38040, Pakistan * Author to whom correspondence should be addressed; E-Mail: [email protected]; Tel.: +60-389-468-385; Fax: +60-389-423-552. Received: 3 August 2011; in revised form: 30 August 2011 / Accepted: 8 September 2011 / Published: 10 October 2011 Abstract: Sea cucumbers, belonging to the class Holothuroidea, are marine invertebrates, habitually found in the benthic areas and deep seas across the world. They have high commercial value coupled with increasing global production and trade. Sea cucumbers, informally named as bêche-de-mer, or gamat, have long been used for food and folk medicine in the communities of Asia and Middle East. Nutritionally, sea cucumbers have an impressive profile of valuable nutrients such as Vitamin A, Vitamin B1 (thiamine), Vitamin B2 (riboflavin), Vitamin B3 (niacin), and minerals, especially calcium, magnesium, iron and zinc. A number of unique biological and pharmacological activities including anti-angiogenic, anticancer, anticoagulant, anti-hypertension, anti-inflammatory, antimicrobial, antioxidant, antithrombotic, antitumor and wound healing have been ascribed to various species of sea cucumbers. Therapeutic properties and medicinal benefits of sea cucumbers can be linked to the presence of a wide array of bioactives especially triterpene glycosides (saponins), chondroitin sulfates, glycosaminoglycan (GAGs), sulfated polysaccharides, sterols (glycosides and sulfates), phenolics, cerberosides, lectins, peptides, glycoprotein, glycosphingolipids and essential fatty acids. -

The Echinoderm Newsletter
! ""'".--'"-,,A' THE ECHINODERM NEWSLETTER NUlIlber 24. 1999 Editor: Cynthia Ahearn Smithsonian Institution National Museum of Natural History Room W-31S, Mail Stop 163 Washington D.C. 20560-0163 U.S.A. [email protected] Distributed by: David Pawson Smithsonian Institution National Museum of Natural History Room W-323, Mail Stop 163 Washington D.C. 20560-0163 U.S.A. The newsletter contains information concerning meetings and conferences, publications of interest to echinoderm biologists, titles of theses on echinoderms, and research interests, and addresses of echinoderm biologists. Individuals who desire to receive the newsletter should send their name, address and research interests to the editor. scientific literature. and a published document. Koehler, 1899 '•.:.•/'i9 VIRTUAL ECHINODERM NEWSLETTER http://www.nmnh.si.edu/iz/echinoderm • TABLE OF CONTENTS Echinoderm Specialists Addresses; (p-); Fax (f-); e-mail numbers 1 Current Research 39 Papers Presented at Meetings (by country or region) Algeria 63 Australia 64 Europe. .................................................................64 Hong Kong 67 India 67 Jamaica ',' 67 Malaysia 68 Mexico 68 New Zealand 68 Pakistan 68 Russia 68 South America 69 United States 69 Papers Presented at Meetings (by conference) SYmposium on Cenozoic Paleobiology, Florida 71 Annual Meeting of Society for Integrative and Comparative Biology 71 Sixty-Ninth Annual Meeting of the Zoological Society of Japan 73 XIX Congreso de Ciencias del Mar, Chile 76 Evo 1uti on '99......................................................... 77 Fifth Florida Echinoderm Festival 78 10th International Echinoderm Conference 79 Theses and Dissertations 80 Announcements, Notices and Conference Announcements 86 Information Requests and Suggestions 88 Ailsa's Section Contribution by Lucia Campos-Creasey 90 Echinoderms in Literature 91 How I Began Studying Echinoderms - part 9 92 Obituaries Maria da Natividade Albuquerque 93 Alan S. -

Mémoire De Fin D'études Qualité Nutritionnelle
République Algérienne Démocratique et Populaire جامعة عبد الحميد بن باديس Université Abdelhamid Ibn Badis-Mostaganem مستغانم Faculté des Sciences de la كلية علوم الطبيعة و الحياة Nature et de la Vie DEPARTEMENT DES SCIENCES DE LA MER ET DE L’AQUACULTURE MéMoire de fin d’études Présenté par Belkacem Nour-el Houda Pour l’obtention du diplôme de Master en hydrobiologie marine et continentale Spécialité : Bioressources Marines Thème Qualité nutritionnelle (teneurs en composés organiques, lipidiques et protéique) et valorisation de l’holothurie royale Parastichopus regalis Soutenue publiquement le /09/2020 Devant le Jury Président Prof. BENAMAR Nerdjess U. Mostaganem Encadreur Prof. MEZALI Karim U. Mostaganem Examinateur Dr. BELBACHIR Nor-Eddine U. Mostaganem Thème réalisé au Laboratoire de de Protection, Valorisation des Ressources Marines et Littorales et Systématique Moléculaire (Université de Mostaganem) 2019/2020 Remerciements Grand remerciement à Allah sans lui nous ne nous pouvons jamais être ce que nous sommes, il nous a donné la santé, la volonté et le pouvoir de faire ce travail et arriver à ce stade. Je remercie chaleureusement mon promoteur, Prof MEZALI Karim (Directeur du laboratoire de Protection, Valorisation des Ressources Marine Littoral et Systématique Moléculaire) qui m’a aidé grâce à ses précieux conseils, ses critiques constructives et son encouragement. C’est avec un grand plaisir que je rédige mes chaleureux remerciements d’avoir grandement contribué, à améliorer le document final. Mes remerciements s’adressent également à Mlle KHODJA Ihcene, Doctorante au niveau du département des sciences de la mer et de l’Aquaculture pour son aide durant la partie expérimentale au niveau du PVRMLSM et lors de la rédaction de ce modeste mémoire. -

Zootaxa, Actinopyga (Holothuroidea: Aspidochirotida: Holothuriidae)
Zootaxa 1138: 53–68 (2006) ISSN 1175-5326 (print edition) www.mapress.com/zootaxa/ ZOOTAXA 1138 Copyright © 2006 Magnolia Press ISSN 1175-5334 (online edition) A new Indo-West Pacific species of Actinopyga (Holothuroidea: Aspidochirotida: Holothuriidae) YVES SAMYN1, DIDIER VANDENSPIEGEL2 & CLAUDE MASSIN3 1Belgian National Focal Point to the Global Taxonomy Initiative, Royal Belgian Institute of Natural Sciences, Vautierstraat 29, B-1000 Brussels, Belgium. E-mail: [email protected] 2Department of Invertebrates, Royal Museum for Central Africa, Leuvensesteenweg 13, B-3080 Tervuren, Belgium 3Department of Invertebrates,Section Malacology, Royal Belgian Institute of Natural Sciences, Vautierstraat 29, B-1000 Brussels, Belgium Abstract Actinopyga is one of the five genera commonly recognised in the family Holothuriidae. This small genus has sixteen species currently considered valid. The present paper describes a new Indo-West Pacific species, Actinopyga caerulea, of which the most striking character is its bluish coloration. The ossicle assemblage of the new species resembles mostly that of A. bannwarthi Panning, 1944 and A. flammea Cherbonnier, 1979. Key words: Echinodermata, Holothuroidea, Actinopyga, new species, Indo-Pacific Introduction Recent expeditions (in 2003 and 2004) to the Union des Comores, an archipelago in the northern Mozambique Channel, yielded several specimens of a species that had previously been photographed at several localities in the Pacific Ocean (Erhardt & Moosleitner 1995; Erhardt & Baensch 1998; Lane pers. comm.; Myers pers. comm.; Colin pers. comm.; see also plate 1). Cherbonnier & Féral (1984) recorded, and later Féral and Cherbonnier (1986) published a photograph of a specimen from New Caledonia which they identified incorrectly as Actinopyga crassa Panning, 1944. Other specimens have been photographed and no voucher material collected, making definitive identification impossible. -

Rapid Biodiversity Assessment of REPUBLIC of NAURU
RAPID BIODIVERSITY ASSESSMENT OF REPUBLIC OF NAURU JUNE 2013 NAOERO GO T D'S W I LL FIRS SPREP Library/IRC Cataloguing-in-Publication Data McKenna, Sheila A, Butler, David J and Wheatley, Amanda. Rapid biodiversity assessment of Republic of Nauru / Sheila A. McKeena … [et al.] – Apia, Samoa : SPREP, 2015. 240 p. cm. ISBN: 978-982-04-0516-5 (print) 978-982-04-0515-8 (ecopy) 1. Biodiversity conservation – Nauru. 2. Biodiversity – Assessment – Nauru. 3. Natural resources conservation areas - Nauru. I. McKeena, Sheila A. II. Butler, David J. III. Wheatley, Amanda. IV. Pacific Regional Environment Programme (SPREP) V. Title. 333.959685 © SPREP 2015 All rights for commercial / for profit reproduction or translation, in any form, reserved. SPREP authorises the partial reproduction or translation of this material for scientific, educational or research purposes, provided that SPREP and the source document are properly acknowledged. Permission to reproduce the document and / or translate in whole, in any form, whether for commercial / for profit or non-profit purposes, must be requested in writing. Secretariat of the Pacific Regional Environment Programme P.O. Box 240, Apia, Samoa. Telephone: + 685 21929, Fax: + 685 20231 www.sprep.org The Pacific environment, sustaining our livelihoods and natural heritage in harmony with our cultures. RAPID BIODIVERSITY ASSESSMENT OF REPUBLIC OF NAURU SHEILA A. MCKENNA, DAVID J. BUTLER, AND AmANDA WHEATLEY (EDITORS) NAOERO GO T D'S W I LL FIRS CONTENTS Organisational Profiles 4 Authors and Participants 6 Acknowledgements -

Reproductive Cycle of the Traditionally Exploited Sea Cucumber Holothuria Tubulosa (Holothuroidea: Aspidochirotida) in Pagasitikos Gulf, Western Aegean Sea, Greece
Turkish Journal of Zoology Turk J Zool (2014) 38: 306-315 http://journals.tubitak.gov.tr/zoology/ © TÜBİTAK Research Article doi:10.3906/zoo-1302-31 Reproductive cycle of the traditionally exploited sea cucumber Holothuria tubulosa (Holothuroidea: Aspidochirotida) in Pagasitikos Gulf, western Aegean Sea, Greece 1,2, 1 1 Georgios KAZANIDIS *, Alexios LOLAS , Dimitris VAFIDIS 1 Department of Ichthyology and Aquatic Environment, School of Agricultural Sciences, University of Thessaly, Nea Ionia, Magnesia, Greece 2 Current address: Oceanlab, University of Aberdeen, Newburgh, Aberdeenshire, UK Received: 15.02.2013 Accepted: 17.12.2013 Published Online: 21.03.2014 Printed: 18.04.2014 Abstract: The reproductive cycle of the traditionally exploited sea cucumber Holothuria tubulosa was investigated in the Pagasitikos Gulf (39°18′457″N, 23°05′869″E) from June 2007 to July 2008. The study examined the microscopic characteristics of the gonads and was based on maturity index (MI) and oocytes’ size-frequency distribution. The reproductive cycle was found to be synchronous between sexes, following an annual pattern. The minimum MI values were recorded in December and January, marking the onset of the reproductive cycle. During the spring, MI increased due to gamete development and proliferation. Mature specimens were prominent in summer while spawning occurred between July and September. The maximum MI values were recorded in mid-autumn, when most specimens were at the postspawning stage. The oocytes’ size-frequency distribution showed analogous seasonal variability. The present findings are crucial for establishing an efficient management strategy for this commercial and ecosystem-engineering species, since its exploitation in Greek waters has not been under official control for more than a century. -

Evaluation Report
EVALUATION REPORT Watamu Marine Protected Area Location: Kenyan Coast, Western Indian Ocean Blue Park Status: Nominated (2020), Evaluated (2021) MPAtlas.org ID: 68812840 Manager(s): Kenya Wildlife Service (KWS) MAPS 2 1. ELIGIBILITY CRITERIA 1.1 Biodiversity Value 4 1.2 Implementation 8 2. AWARD STATUS CRITERIA 2.1 Regulations 11 2.2 Design, Management, and Compliance 12 3. SYSTEM PRIORITIES 3.1 Ecosystem Representation 17 3.2 Ecological Spatial Connectivity 18 SUPPLEMENTAL INFORMATION: Evidence of MPA Effects 20 SUPPLEMENTAL INFORMATION: Additional species of 20 conservation concern MAPS Figure 1: Watamu Marine Protected Area includes Watamu Marine National Park (dark blue, indicating that it is fully protected), Watamu Marine National Reserve (light blue, indicating that it is highly protected), and half of Malindi-Watamu Marine National Reserve (light blue lined; it is also highly protected). Watamu Marine National Park is a no-take marine refuge which provides coral reefs and a variety of marine species with total protection from extractive exploitation. The adjacent Watamu Marine National Reserve protects the estuary known as Mida Creek and allows limited fishing. The Malindi-Watamu Marine National Reserve, located on the coastal side of Watamu Marine National Park, also allows limited fishing. See Section 2.1 for more information about the regulations of each zone. (Source: Kenya Wildlife Service, 2015) - 2 - Figure 2: Watamu National Marine Park (pink) sees high visitor use. The Watamu Marine Reserve (yellow) is a Medium Use Zone. The portion of the Malindi-Watamu Reserve within Watamu MPA (olive green) is a Low Use Zone, with respect to recreational activities. -
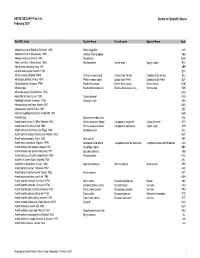
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste