Memoire De Fin D'etude Theme
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Pdf (306.01 K)
REVIEW ARTICLE RECORDS OF PHARMACEUTICAL AND BIOMEDICAL SCIENCES Review article on chemical constituents and biological activity of Thymelaea hirsuta. Ahmed M Badawya, Hashem A Hassaneanb, Amany K. Ibrahimb, Eman S. Habibb, Safwat A. Ahmedb* aDepartment of Pharmacognosy, Faculty of Pharmacy, Sinai University, El-Arish, Egypt, b Department of Pharmacognosy, Faculty of Pharmacy, Suez Canal University, Ismailia, Egypt 41522. Abstract Received on: 07.04. 2019 Thymelaea hirsuta a perennial, evergreen and dioecious shrub, which is native Revised on: 30. 04. 2019 to North Africa. T. hirsuta is a widespread invasive weed and is commonly known as “Methnane”. Along the history, T. hirsuta, family Thymelaeaceae, Accepted on: 10. 04. 2019 has been recognized as an important medicinal plant. Much research has been carried out on the medical applications of Methnane. The choice of the plant was based on the good previous biological study of T. hirsuta plant extract to Correspondence Author: use as anticancer, hepatoprotective and anti-diapetic. Several species of Tel:+ 01092638387 Thymelaeaceae have been the subject of numerous phytochemical studies. Initially, interest may have been due to the marked toxicity of these plants, but E-mail address: the widespread use of some species medicinally has certainly played a part in [email protected] sustaining this interest. Keywords: Thymelaea hirsuta , Chemical constituents, Biological activity 1.Introduction: Near East: Lebanon and Palestine. The choice of the plant was based on the good previous Thymelaea hirsuta a perennial, evergreen and biological study of T. hirsuta plant extract to use dioecious shrub, which is native to North Africa. T. as anticancer, hepatoprotective and anti-diabetic. -
Qrno. 1 2 3 4 5 6 7 1 CP 2903 77 100 0 Cfcl3
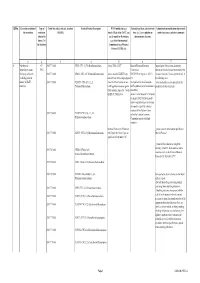
QRNo. General description of Type of Tariff line code(s) affected, based on Detailed Product Description WTO Justification (e.g. National legal basis and entry into Administration, modification of previously the restriction restriction HS(2012) Article XX(g) of the GATT, etc.) force (i.e. Law, regulation or notified measures, and other comments (Symbol in and Grounds for Restriction, administrative decision) Annex 2 of e.g., Other International the Decision) Commitments (e.g. Montreal Protocol, CITES, etc) 12 3 4 5 6 7 1 Prohibition to CP 2903 77 100 0 CFCl3 (CFC-11) Trichlorofluoromethane Article XX(h) GATT Board of Eurasian Economic Import/export of these ozone destroying import/export ozone CP-X Commission substances from/to the customs territory of the destroying substances 2903 77 200 0 CF2Cl2 (CFC-12) Dichlorodifluoromethane Article 46 of the EAEU Treaty DECISION on August 16, 2012 N Eurasian Economic Union is permitted only in (excluding goods in dated 29 may 2014 and paragraphs 134 the following cases: transit) (all EAEU 2903 77 300 0 C2F3Cl3 (CFC-113) 1,1,2- 4 and 37 of the Protocol on non- On legal acts in the field of non- _to be used solely as a raw material for the countries) Trichlorotrifluoroethane tariff regulation measures against tariff regulation (as last amended at 2 production of other chemicals; third countries Annex No. 7 to the June 2016) EAEU of 29 May 2014 Annex 1 to the Decision N 134 dated 16 August 2012 Unit list of goods subject to prohibitions or restrictions on import or export by countries- members of the -

Romanian Journal of Biology Plant Biology
ROMANIAN JOURNAL OF BIOLOGY PLANT BIOLOGY VOLUME 62, No. 1 2017 CONTENTS A. CIUBOTARU, A. TONIUC, C. TOMA, Vera Alexeevna Poddubnaia-Arnoldi, Commemoration of the 115 years since the birth of the great embryologist ......... 3 MĂDĂLIN ENACHE, Professor Masahiro Kamekura at his 70th anniversary. A life dedicated to research of halophilic and haloalkaliphilic bacterial and archaeal microorganisms ............................................................................... 9 I. VICOL, Chorology of Stigmidium genus in Romania ............................................ 19 B. DEVLA, S.K. SINGH, S. BIMAL, P. DAS, M. THIRUMAL, A.K. PRASAD, R. BIMAL, A report on antileishmanial (promastigote stage of Leishmania donovani) activity of deuteromycota fungus Fusarium oxysporum f.sp. cubense .......................................................................................................... 23 S. MIRZAVASH AZAR, L. MALEK MOHAMADI, Survey of affected ecological factors to Juniperus excelsa regeneration in Ghasemlou valley by employing the eco-phytosociological method ................................................ 31 J.S.R. ALURI, P.R. CHAPPIDI, Pollination ecology of Alternanthera paronychioides and Gomphrena serrata (Fmily: Amaranthaceae; Sub- family Gomphrenoideae) ............................................................................... 43 BOOK REVIEW I.I. ARDELEAN, Engineering of microorganisms for the production of chemicals and biofuels from renewable resources .......................................................... 57 ROM. -

May-June 2016 Green Dragon NL
GREEN DRAGON TALES · MAY-JUNE 2016 · PAGE 1 IN THIS ISSUE: • Desirable Daphnes • Our May Plant Sale! • Membership Update • Potting Tips • Wurster Garden Update • From the Chair • News from National • Seedling Exchange Report • Upcoming ACNARGS Programs • Trough Workshop May 28 • Calendar of other garden programs • Garden Tour June 18 • Photo of the Month • Daphne Plant List Visit our blog: acnargs.blogspot.com May/June 2016 MAY 14: PARTICIPATE IN THE ACNARGS PLANT SALE! OUR BIGGEST FUNDRAISER OF THE YEAR! David Mitchell, Plant Sales Chair We are participating again in the Cooperative Extension Garden Fair and Plant Sale on May 14. Now is the time to pot up your divisions for our sale tables. Please use only soilless potting mix and remember to label every pot (common name and botanical, if known). The May plant sale will return to the Ithaca High School on May 14. Our tables/booth are located in the new gym, same as last year, exact location TBD, so look for us. Sale hours are 9:00 a.m. to 2:00 p.m. (although we may sell out earlier). Set up is Friday beginning at 4 p.m. until about 7 p.m. and Saturday beginning at 8 a.m. You may arrive early Saturday to drop off plants and help complete the setup. This year we appreciate, if you can, to sign-up to help in advance. We most need people for set-up and clean-up. Of course, you are encouraged to jump in to volunteer at any time; there's always something to do. -

Final Report (Years 1-5) July 2007
Darwin Initiative: Project: 162 / 11 / 025 Cross-border conservation strategies for Altai Mountain endemics (Russia, Mongolia, Kazakhstan) Final Report (Years 1-5) July 2007 CONTENTS: DARWIN PROJECT INFORMATION 3 1 PROJECT BACKGROUND/RATIONALE 3 2 PROJECT SUMMARY 4 3 SCIENTIFIC, TRAINING, AND TECHNICAL ASSESSMENT 8 3.1 RESEARCH 8 Methodology 8 Liaison with local authorities and Regional Ecological Committees 9 Data storage and analysis 10 Results 11 3.2 TRAINING AND CAPACITY BUILDING ACTIVITIES. 14 4 PROJECT IMPACTS 15 5 PROJECT OUTPUTS 18 6 PROJECT EXPENDITURE 19 7 PROJECT OPERATION AND PARTNERSHIPS 19 8 ACTIONS TAKEN IN RESPONSE TO ANNUAL REPORT REVIEWS (IF APPLICABLE) 22 9 DARWIN IDENTITY 23 Project 162 / 11 / 025: Altai Mountains. Final Report, August 2007 1 10 LEVERAGE 23 11 SUSTAINABILITY AND LEGACY 24 12 VALUE FOR MONEY 25 APPENDIX I: PROJECT CONTRIBUTION TO ARTICLES UNDER THE CONVENTION ON BIOLOGICAL DIVERSITY (CBD) 27 APPENDIX II: OUTPUTS 29 APPENDIX III: PUBLICATIONS 35 APPENDIX IV: DARWIN CONTACTS 42 APPENDIX V: LOGICAL FRAMEWORK 44 APPENDIX VI: SELECTED TABLES 45 APPENDIX VII: COPIES OF INFORMATION LEAFLETS 52 APPENDIX VIII: PUBLICATIONS WITH SUMMARIES IN ENGLISH 53 APPENDIX IX: COPIES OF OUTPUTS SUPPLIED AS PDF 68 Project 162 / 11 / 025: Altai Mountains. Final Report, August 2007 2 Darwin Initiative for the Survival of Species Final Report Darwin Project Information Project Reference No. 162 / 11 / 025 Project Title Cross-border conservation strategies for Altai Mountain Endemics (Russia, Mongolia, Kazakhstan) Country(ies) UK, Russia, Mongolia, Kazakhstan UK Contractor University of Sheffield Partner Organisation (s) Tomsk State University (Russia); Hovd branch of Mongolian State University; Altai Botanical Gardens (Leninogorsk, Kazakhstan) Darwin Grant Value £184,316.84 Start/End dates 01.04.2002 – 31.03.2007 Reporting period and report 01.04.2005 – 31.03.2007 (Final report) number Project website http://www.ecos.tsu.ru/altai* Author(s), date Dr. -

Buchbesprechungen 247-296 ©Verein Zur Erforschung Der Flora Österreichs; Download Unter
ZOBODAT - www.zobodat.at Zoologisch-Botanische Datenbank/Zoological-Botanical Database Digitale Literatur/Digital Literature Zeitschrift/Journal: Neilreichia - Zeitschrift für Pflanzensystematik und Floristik Österreichs Jahr/Year: 2006 Band/Volume: 4 Autor(en)/Author(s): Mrkvicka Alexander Ch., Fischer Manfred Adalbert, Schneeweiß Gerald M., Raabe Uwe Artikel/Article: Buchbesprechungen 247-296 ©Verein zur Erforschung der Flora Österreichs; download unter www.biologiezentrum.at Neilreichia 4: 247–297 (2006) Buchbesprechungen Arndt KÄSTNER, Eckehart J. JÄGER & Rudolf SCHUBERT, 2001: Handbuch der Se- getalpflanzen Mitteleuropas. Unter Mitarbeit von Uwe BRAUN, Günter FEYERABEND, Gerhard KARRER, Doris SEIDEL, Franz TIETZE, Klaus WERNER. – Wien & New York: Springer. – X + 609 pp.; 32 × 25 cm; fest gebunden. – ISBN 3-211-83562-8. – Preis: 177, – €. Dieses imposante Kompendium – wohl das umfangreichste Werk zu diesem Thema – behandelt praktisch alle Aspekte der reinen und angewandten Botanik rund um die Ackerbeikräuter. Es entstand in der Hauptsache aufgrund jahrzehntelanger Forschungs- arbeiten am Institut für Geobotanik der Universität Halle über Ökologie und Verbrei- tung der Segetalpflanzen. Im Zentrum des Werkes stehen 182 Arten, die ausführlich behandelt werden, wobei deren eindrucksvolle und umfassende „Porträt-Zeichnungen“ und genaue Verbreitungskarten am wichtigsten sind. Der „Allgemeine“ Teil („I.“) beginnt mit der Erläuterung einiger (vor allem morpholo- gischer, ökologischer, chorologischer und zoologischer) Fachausdrücke, darauf -

Number 3, Spring 1998 Director’S Letter
Planning and planting for a better world Friends of the JC Raulston Arboretum Newsletter Number 3, Spring 1998 Director’s Letter Spring greetings from the JC Raulston Arboretum! This garden- ing season is in full swing, and the Arboretum is the place to be. Emergence is the word! Flowers and foliage are emerging every- where. We had a magnificent late winter and early spring. The Cornus mas ‘Spring Glow’ located in the paradise garden was exquisite this year. The bright yellow flowers are bright and persistent, and the Students from a Wake Tech Community College Photography Class find exfoliating bark and attractive habit plenty to photograph on a February day in the Arboretum. make it a winner. It’s no wonder that JC was so excited about this done soon. Make sure you check of themselves than is expected to seedling selection from the field out many of the special gardens in keep things moving forward. I, for nursery. We are looking to propa- the Arboretum. Our volunteer one, am thankful for each and every gate numerous plants this spring in curators are busy planting and one of them. hopes of getting it into the trade. preparing those gardens for The magnolias were looking another season. Many thanks to all Lastly, when you visit the garden I fantastic until we had three days in our volunteers who work so very would challenge you to find the a row of temperatures in the low hard in the garden. It shows! Euscaphis japonicus. We had a twenties. There was plenty of Another reminder — from April to beautiful seven-foot specimen tree damage to open flowers, but the October, on Sunday’s at 2:00 p.m. -

Samenkatalog Graz 2016.Pdf
SAMENTAUSCHVERZEICHNIS Index Seminum Seed list Catalogue de graines des Botanischen Gartens der Karl-Franzens-Universität Graz Ernte / Harvest / Récolte 2016 Herausgegeben von Christian BERG, Kurt MARQUART & Jonathan WILFLING ebgconsortiumindexseminum2012 Institut für Pflanzenwissenschaften, Januar 2017 Botanical Garden, Institute of Plant Sciences, Karl- Franzens-Universität Graz 2 Botanischer Garten Institut für Pflanzenwissenschaften Karl-Franzens-Universität Graz Holteigasse 6 A - 8010 Graz, Austria Fax: ++43-316-380-9883 Email- und Telefonkontakt: [email protected], Tel.: ++43-316-380-5651 [email protected], Tel.: ++43-316-380-5747 Webseite: http://garten.uni-graz.at/ Zitiervorschlag : BERG, C., MARQUART, K. & Wilfling, J. (2017): Samentauschverzeichnis – Index Seminum – des Botanischen Gartens der Karl-Franzens-Universität Graz, Samenernte 2016. – 54 S., Karl-Franzens-Universität Graz. Personalstand des Botanischen Gartens Graz: Institutsleiter: Ao. Univ.-Prof. Mag. Dr. Helmut MAYRHOFER Wissenschaftlicher Gartenleiter: Dr. Christian BERG Gartenverwalter: Jonathan WILFLING, B. Sc. Gärtnermeister: Friedrich STEFFAN GärtnerInnen: Doris ADAM-LACKNER Viola BONGERS Magarete HIDEN Franz HÖDL Kurt MARQUART Franz STIEBER Ulrike STRAUSSBERGER Monika GABER Gartenarbeiter: Philip FRIEDL René MICHALSKI Oliver KROPIWNICKI Gärtnerlehrlinge: Gabriel Buchmann (1. Lehrjahr) Bahram EMAMI (3. Lehrjahr) Mario MARX (3. Lehrjahr) 3 Inhaltsverzeichnis / Contents / Table des matières Abkürzungen / List of abbreviations / Abréviations -

Schema Frontespizio Teso Dottorato
Università degli Studi di Cagliari PHD DEGREE Earth and Environmental Sciences and Technologies Cycle XXXII TITLE OF THE PHD THESIS The endemic vascular plant species of Egypt: distribution patterns and implications for conservation Scientific Disciplinary Sector(s) (BIO/03- Environmental and Applied Botany) PhD Student Mohamed Abdelaal Lotfy Sadek Coordinator of the PhD Programme Prof. Giorgio Ghiglieri Supervisor Prof. Gianluigi Bacchetta Co-supervisors: Dotts. Giuseppe Fenu & Mauro Fois Final exam. Academic Year 2018 – 2019 Thesis defence: February 2020 Session Table of Contents TABLE OF CONTENTS General introduction 1 Study area 3 Research objectives 6 References 7 CHAPTER I- Critical checklist of the endemic vascular plants of Egypt 10 1. Introduction 11 2. Materials and methods 12 3. Results 13 3.1 . Floristic analysis of the egyptian exclusive flora 13 3.2. Distribution of the exclusive endemic vascular flora of Egypt 14 4. Discussion 16 5. Conclusion 21 6. References 27 CHAPTER II- Biogeographical characterization of Egypt based on environmental 31 features and endemic vascular plants distribution 1. Introduction 32 2. Materials and methods 34 2.1. Study area 34 2.2. Datasets and environmental clustering 35 2.3. Biogeographic regionalization 37 3. Results 38 3.1. Environmental clusters 38 3.2. Biogeographical sectors and subsectors of Egypt 39 4. Discussion 40 5. Conclusion 45 6. References 46 CHAPTER III- Using MaxEnt modeling to predict the potential distribution of 52 the endemic plant Rosa arabica Crep. in Egypt 1. Introduction 53 2. Materials and methods 54 2.1. Study area and target species 54 2.2. Data source and variables selection 56 2.3. -

Trees, Shrubs, and Perennials That Intrigue Me (Gymnosperms First
Big-picture, evolutionary view of trees and shrubs (and a few of my favorite herbaceous perennials), ver. 2007-11-04 Descriptions of the trees and shrubs taken (stolen!!!) from online sources, from my own observations in and around Greenwood Lake, NY, and from these books: • Dirr’s Hardy Trees and Shrubs, Michael A. Dirr, Timber Press, © 1997 • Trees of North America (Golden field guide), C. Frank Brockman, St. Martin’s Press, © 2001 • Smithsonian Handbooks, Trees, Allen J. Coombes, Dorling Kindersley, © 2002 • Native Trees for North American Landscapes, Guy Sternberg with Jim Wilson, Timber Press, © 2004 • Complete Trees, Shrubs, and Hedges, Jacqueline Hériteau, © 2006 They are generally listed from most ancient to most recently evolved. (I’m not sure if this is true for the rosids and asterids, starting on page 30. I just listed them in the same order as Angiosperm Phylogeny Group II.) This document started out as my personal landscaping plan and morphed into something almost unwieldy and phantasmagorical. Key to symbols and colored text: Checkboxes indicate species and/or cultivars that I want. Checkmarks indicate those that I have (or that one of my neighbors has). Text in blue indicates shrub or hedge. (Unfinished task – there is no text in blue other than this text right here.) Text in red indicates that the species or cultivar is undesirable: • Out of range climatically (either wrong zone, or won’t do well because of differences in moisture or seasons, even though it is in the “right” zone). • Will grow too tall or wide and simply won’t fit well on my property. -

PLANTS from the GENUS DAPHNE: a REVIEW of ITS TRADITIONAL USES, PHYTOCHEMISTRY, BIOLOGICAL and PHARMACOLOGICAL ACTIVITY Miroslav M
REVIEW PAPER REVIJALNI RAD REVIEW PAPER REVIJALNI RAD REVIEW PAPER PLANTS FROM THE GENUS DAPHNE: A REVIEW OF ITS TRADITIONAL USES, PHYTOCHEMISTRY, BIOLOGICAL AND PHARMACOLOGICAL ACTIVITY Miroslav M. Sovrlić and Nedeljko T. Manojlović Department of Pharmacy, Faculty of Medical Sciences, University of Kragujevac, Serbia BILJNE VRSTE RODA DAPHNE: PREGLED UPOTREBE U TRADICIONALNOJ MEDICINI, FITOHEMIJA, BIOLOŠKE I FARMAKOLOŠKE AKTIVNOSTI Miroslav M. Sovrlić i Nedeljko T. Manojlović Odsek za farmaciju, Fakultet medicinskih nauka, Univerzitet u Kragujevcu, Srbija Received / Primljen: 04. 02. 2016. Accepted / Prihvaćen: 19. 03. 2016. ABSTRACT SAŽETAK Plants have an important role in maintaining people’s Biljke imaju bitnu ulogu u održavanju zdravlja ljudi i po- health and improving the quality of human life. Th ey are an boljšanju kvaliteta ljudskog života. One su bitna komponenta important component of people’s diet, but they are also used ishrane ljudi, ali se koriste i u ostalim sferama ljudskog života in other spheres of human life as a therapeutic resources, in- nalazeći primenu kao lekovita sredstva, konzervansi, sastoj- gredients of cosmetic products, paints and others. Th e Daph- ci kozmetičkih preparata, boja i ostalo. Rod Daphne pripada ne genus belongs to family Th ymeleaceae which includes 44 familiji Th ymeleaceae koja obuhvata 44 rodova sa približno families with approximately 500 herbal species. Th e plant 500 biljnih vrsta. Biljne vrste roda Daphne se koriste u kine- species of the genus Daphne are used in the traditional medi- skoj tradicionalnoj medicini i tradicionalnoj medicini tropskog cine in China and tropical part of Africa for the treatment of dela afrike u tretmanu različitih oboljenja. -

Plant Biodiversity of Zarm-Rood Rural
ﻋﺒﺎس ﻗﻠﯽﭘﻮر و ﻫﻤﮑﺎران داﻧﺸﮕﺎه ﮔﻨﺒﺪ ﮐﺎووس ﻧﺸﺮﯾﻪ "ﺣﻔﺎﻇﺖ زﯾﺴﺖ ﺑﻮم ﮔﯿﺎﻫﺎن" دوره ﭘﻨﺠﻢ، ﺷﻤﺎره دﻫﻢ، ﺑﻬﺎر و ﺗﺎﺑﺴﺘﺎن 96 http://pec.gonbad.ac.ir ﺗﻨﻮع ﮔﯿﺎﻫﯽ دﻫﺴﺘﺎن زارمرود، ﺷﻬﺮﺳﺘﺎن ﻧﮑﺎ (ﻣﺎزﻧﺪران) ﻋﺒﺎس ﻗﻠﯽﭘﻮر1*، ﻧﺴﯿﻢ رﺳﻮﻟﯽ2، ﻣﺠﯿﺪ ﻗﺮﺑﺎﻧﯽ ﻧﻬﻮﺟﯽ3 1داﻧﺸﯿﺎر ﮔﺮوه زﯾﺴﺖﺷﻨﺎﺳﯽ، داﻧﺸﮑﺪه ﻋﻠﻮم، داﻧﺸﮕﺎه ﭘﯿﺎم ﻧﻮر، ﺗﻬﺮان 2 داﻧﺶآﻣﻮﺧﺘﻪ ﮐﺎرﺷﻨﺎﺳﯽارﺷﺪ ﻋﻠﻮم ﮔﯿﺎﻫﯽ، داﻧﺸﮑﺪه ﻋﻠﻮم، داﻧﺸﮕﺎه ﭘﯿﺎم ﻧﻮر، ﺗﻬﺮان 3اﺳﺘﺎدﯾﺎر ﭘﮋوﻫﺶ، ﻣﺮﮐﺰ ﺗﺤﻘﯿﻘﺎت ﮔﯿﺎﻫﺎن داروﯾﯽ، ﭘﮋوﻫﺸﮑﺪه ﮔﯿﺎﻫﺎن داروﯾﯽ ﺟﻬﺎد داﻧﺸﮕﺎﻫﯽ، ﮐﺮج ﺗﺎرﯾﺦ درﯾﺎﻓﺖ: 12/10/1394؛ ﺗﺎرﯾﺦ ﭘﺬﯾﺮش: 1395/12/19 ﭼﮑﯿﺪه1 دﻫﺴﺘﺎن ز ارمرود در ﺑﺨﺶ ﻫﺰارﺟﺮﯾﺐ ﺷﻬﺮﺳﺘﺎن ﻧﮑﺎ (اﺳﺘﺎن ﻣﺎزﻧﺪران)، ﻗﺮار دارد. اﯾﻦ دﻫﺴﺘﺎن ﻣﻨﻄﻘـﻪ اي ﮐﻮﻫﺴﺘﺎﻧﯽ ﺑﺎ ﻣﺴﺎﺣﺘﯽ ﺣﺪود 609 ﮐﯿﻠﻮﻣﺘﺮ ﻣﺮﺑﻊ، در داﻣﻨﻪ ارﺗﻔﺎﻋﯽ 1700 ﺗﺎ 2100 ﻣﺘﺮ از ﺳﻄﺢ درﯾﺎ ﻗـﺮار ﮔﺮﻓﺘـﻪ اﺳﺖ. ﺑﺮاي ﻣﻄﺎﻟﻌﻪ ﻓﻠﻮر ﻣﻨﻄﻘﻪ، ﻧﻤﻮﻧﻪﻫﺎي ﮔﯿﺎﻫﯽ ﻃﯽ ﺳﺎلﻫﺎي 1391 و1392، ﺟﻤﻊآوري و ﺑﺎ اﺳـﺘﻔﺎده از ﻣﻨـﺎﺑﻊ ﻣﻌﺘﺒﺮ ﻓﻠﻮرﺳﺘﯿﮏ ﺷﻨﺎﺳﺎﯾﯽ ﺷﺪﻧﺪ. در ﻣﺠﻤﻮع 172 ﮔﻮﻧﻪ، ﻣﺘﻌﻠﻖ ﺑﻪ 146 ﺟﻨﺲ از 69 ﺗﯿﺮه ﺷﻨﺎﺳﺎﯾﯽ ﺷـﺪ. ﺗ ﯿـ ﺮه Fabaceae ﺑﺎ داﺷﺘﻦ 12 ﺟﻨﺲ و 16 ﮔﻮﻧﻪ از ﺑﺰرﮔﺘﺮﯾﻦ ﺗﯿ ﺮهﻫﺎي ﻣﻨﻄﻘﻪ ﻣﺤﺴﻮب ﻣ ﯽﺷﻮد. از ﻧﻈﺮ ﺷﮑﻞ زﯾﺴـﺘ ﯽ، 37 درﺻﺪ از ﮔﻮﻧﻪﻫﺎ ﻫﻤ ﯽﮐﺮﯾﭙﺘﻮﻓﯿﺖ، 26 درﺻﺪ ﻓﺎﻧﺮوﻓﯿﺖ، 19 درﺻﺪ ﮐﺮﯾﭙﺘﻮﻓﯿﺖ، 17 درﺻﺪ ﺗﺮوﻓﯿﺖ و 1 درﺻﺪ ﮐﺎﻣ ﻪﻓﯿﺖ ﻫﺴﺘﻨﺪ. ﻓﺮاواﻧﯽ ﮔﻮﻧﻪﻫﺎي ﻓﺎﻧﺮوﻓﯿﺖ ﺑﺎ وﺿﻌﯿﺖ ﻃﺒﯿﻌﯽ ﭘﻮﺷﺶ ﮔﯿﺎﻫﯽ ﻣﻨﻄﻘﻪ ﯾﻌﻨﯽ ﻏﻠﺒﻪ رﯾﺨﺘﺎر ﺟﻨﮕﻠﯽ ﻫﻤﺨﻮاﻧﯽ دارد. ﺑﺮ اﺳﺎس ﺗﻮزﯾﻊ ﺟﻐﺮاﻓﯿﺎي ﮔﯿﺎﻫﯽ، 36 درﺻﺪ از ﮔﻮﻧﻪﻫﺎ ﻋﻨﺼﺮ روﯾﺸﯽ ﻧﺎﺣﯿﻪ ارو - ﺳـ ﯿﺒﺮي، Downloaded from pec.gonbad.ac.ir at 6:30 +0330 on Friday October 1st 2021 23 درﺻﺪ از ﮔﻮ ﻧﻪﻫﺎ ﭼﻨﺪ ﻧﺎﺣﯿ ﻪاي، 16 درﺻﺪ ﺑﻪ ﻃﻮر ﻣﺸﺘﺮك ﻋﻨﺼﺮ روﯾﺸﯽ ﻧﺎﺣﯿﻪ ارو - ﺳﯿﺒﺮي و اﯾﺮان- ﺗﻮراﻧﯽ، 14 درﺻﺪ اﯾﺮان – ﺗﻮراﻧﯽ و 2 درﺻﺪ ﺟﻬﺎن وﻃﻨﯽ ﻣ ﯽﺑﺎﺷﻨﺪ.