Tilapia Lima – Perú Tels
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

View/Download
CICHLIFORMES: Cichlidae (part 3) · 1 The ETYFish Project © Christopher Scharpf and Kenneth J. Lazara COMMENTS: v. 6.0 - 30 April 2021 Order CICHLIFORMES (part 3 of 8) Family CICHLIDAE Cichlids (part 3 of 7) Subfamily Pseudocrenilabrinae African Cichlids (Haplochromis through Konia) Haplochromis Hilgendorf 1888 haplo-, simple, proposed as a subgenus of Chromis with unnotched teeth (i.e., flattened and obliquely truncated teeth of H. obliquidens); Chromis, a name dating to Aristotle, possibly derived from chroemo (to neigh), referring to a drum (Sciaenidae) and its ability to make noise, later expanded to embrace cichlids, damselfishes, dottybacks and wrasses (all perch-like fishes once thought to be related), then beginning to be used in the names of African cichlid genera following Chromis (now Oreochromis) mossambicus Peters 1852 Haplochromis acidens Greenwood 1967 acies, sharp edge or point; dens, teeth, referring to its sharp, needle-like teeth Haplochromis adolphifrederici (Boulenger 1914) in honor explorer Adolf Friederich (1873-1969), Duke of Mecklenburg, leader of the Deutsche Zentral-Afrika Expedition (1907-1908), during which type was collected Haplochromis aelocephalus Greenwood 1959 aiolos, shifting, changing, variable; cephalus, head, referring to wide range of variation in head shape Haplochromis aeneocolor Greenwood 1973 aeneus, brazen, referring to “brassy appearance” or coloration of adult males, a possible double entendre (per Erwin Schraml) referring to both “dull bronze” color exhibited by some specimens and to what -

“Jumbo”: Representa Um Potencial Para Introdução De Espécies No Brasil?
Oecologia Australis 23(3):519-535, 2019 https://doi.org/10.4257/oeco.2019.2303.11 AQUARISMO “JUMBO”: REPRESENTA UM POTENCIAL PARA INTRODUÇÃO DE ESPÉCIES NO BRASIL? João Daniel Ferraz1,2*, Armando César Rodrigues Casimiro1,2, Alan Deivid Pereira1,2, Diego Azevedo Zoccal Garcia2, Lucas Ribeiro Jarduli2,3, André Lincoln Barroso Magalhães4 & Mário Luís Orsi2 1 Universidade Estadual de Londrina, Programa de Pós-Graduação em Ciências Biológicas, Rodovia Celso Garcia Cid, PR 445, Km 380, Campus Universitário, CP 10.011, CEP 86057-970, Londrina, PR, Brasil. 2 Universidade Estadual de Londrina, Laboratório de Ecologia de Peixes e Invasões Biológicas, Rodovia Celso Garcia Cid, PR 445, Km 380, Campus Universitário, CP 10.011, CEP 86057-970, Londrina, PR, Brasil. 3 Centro Universitário das Faculdades Integradas de Ourinhos, Rodovia BR 153, Km 338, CEP 19909-100, Bairro Água do Cateto, Ourinhos, SP, Brasil. 4 Universidade Federal de São João Del Rei, Programa de Pós-Graduação em Tecnologias para o Desenvolvimento Sustentável, Rod. MG 443, KM 7,CEP 36420-000, Fazenda do Cadete, Ouro Branco, MG, Brasil. E-mails: [email protected] (*autor correspondente); [email protected]; [email protected]; [email protected]; [email protected]; [email protected]; [email protected] RESUMO: O aquarismo é um hobby difundido mundialmente, com registros desde as civilizações antigas. No Brasil, a prática tem aumentado seu prestígio e representatividade. Dentre as modalidades do aquarismo de água doce, o “jumbo” tem se tornado popular, e sua prática tem gerado ampla divulgação via Internet. A modalidade se caracteriza pela escolha de espécies de peixes de médio a grande porte com comportamento agressivo e predatório, o que representa ameaça aos ambientes naturais principalmente como consequência do descarte inadequado das espécies. -

Territoriality and Landscape of Aggression
University of Louisville ThinkIR: The University of Louisville's Institutional Repository Electronic Theses and Dissertations 12-2013 Territoriality and landscape of aggression. Piyumika Sureshni Suriyampola University of Louisville Follow this and additional works at: https://ir.library.louisville.edu/etd Recommended Citation Suriyampola, Piyumika Sureshni, "Territoriality and landscape of aggression." (2013). Electronic Theses and Dissertations. Paper 1410. https://doi.org/10.18297/etd/1410 This Doctoral Dissertation is brought to you for free and open access by ThinkIR: The University of Louisville's Institutional Repository. It has been accepted for inclusion in Electronic Theses and Dissertations by an authorized administrator of ThinkIR: The University of Louisville's Institutional Repository. This title appears here courtesy of the author, who has retained all other copyrights. For more information, please contact [email protected]. TERRITORIALITY AND LANDSCAPE OF AGGRESSION By Piyumika Sureshni Suriyampola B.Sc. University of Peradeniya, 2006 M.S. University of Louisville, 2013 A Dissertation Submitted to the Faculty of the College of Arts and Sciences of the University of Louisville in Partial Fulfillment of the Requirements for the Degree of Doctor of Philosophy Department of Biology University of Louisville Louisville, Kentucky December 2013 Copyright 2013 by Piyumika Sureshni Suriyampola All rights reserved TERRITORIALITY AND LANDSCAPE OF AGGRESSION By Piyumika Sureshni Suriyampola B.Sc. University of Peradeniya, 2006 -

Species Index
Species index Aeromonas hydrophila, 241 Chanos chanos, 154,155,463 Alcolapia, 5,7,28,62 Chironomidae, 147 Alestes, 135,150 Chydoras, 143 Alestes longipinnis, 47 Cichla,3 Amblypharyngodon melettinus, 156 C. ocellaris, 200,243 Anabaena, 62,72,149 Cichlasoma managuense, 243 A. cylindrica, 74,75,78 Cichlid,1,2,3,4,15,46,50,65,67,79, A. falcatus, 75 90,134,149,150,151,153,156 A. £os-aquae, 72,75 Cichlidae,2,3,90 Anhinga, 149 Citharinus, 129,132,134,136,140 Ankistrdesmus, 62,72 Cladocera, 73 Clarias, 135,136,138,147,149,243 Bagrus,135,138 Clarias gariepinus, 135,142,146,153, B. docmac, 136,142 382 B. bayad, 136 C. macrocephlus, 382 B. meridionalis, 149 Clupea harengus, 209 Barbus, 135,147 Coptodon, 6,14 Botryococcus brauni, 72 Ctenopoma, 153 Cyprinus carpio, 107,335 Caridina, 143,144 C. niloticus, 153 Dagetia,6 Cepaea nemoralis, 340 Danakilia, 1,5,6,8,9,49,62,228 Ceratophyllum, 149 D. franchetti,6 C. demersum, 72,113 Daphnia magna, 72,7 3 Channa obscura, 135 Dimidiochromis kiwinge, 35 C. striata,270 Distichodus, 129,136,150 C. guntheri, 14 Chilochromis duponti, 14 Eichhornia, 135 Chlamydomonas sp., 72,75 E. crassipes, 143 Chlorella, 72 Embiotocidae,2 Chromidotilapia, 3 Enantiopus melanogenys, 41 Chrysichthys nigrdigitatus, 134 Ephemeroptera,147 489 490 Species index Etroplus, 3,92 Mugil sp.,152 E. maculatus, 4 Mugil cephalus, 155 Myaka, 1,7,26 Gadus morhua, 209 M. myaka, 7 Gastropoda, 147 Mycobacterium, 438 Glossogobius, 153 Gobiocichla, 1,5,7 Najas, 144 G. ethelwynne,7 N. guadalupensis, 72 Grammatotria lemairei, 63 Navicula, 149 Gymnarchus niloticus, 132 Neotilapia, 5,7 Nilotilapia, 5 Haplochromis, 11,147 Nitzschia, 72 Haplochromine,4,15,34,35,42,44,46, Nyasalapia, 5,7,12,16,27,33,41,43 53,61,129,140,142,151,191 Haplochromini,1,3,14 Odonata, 147 Haplochromis nigripinnis, 138 Onchorhynchus mykiss, 335 H. -

First Record of Heterotilapia Buttikoferi (Hubrecht, 1881)
Acta Fish. Aquat. Res. (2017) 5 (3): vii-xi. DOI 10.2312/ActaFish.2017.5.3.vii-xi NOTA CIENTÍFICA Acta of Acta of Fisheries and Aquatic Resources First record of Heterotilapia buttikoferi (Hubrecht, 1881) (Perciformes, Cichlidae), from Pentecoste, state of Ceará, Brazil Primeiro registro de Heterotilapia buttikoferi (Hubrecht, 1881) (Perciformes, Cichlidae), em Pentecoste, estado do Ceará, Brasil Thiago Campos de Santana1*, José Milton Barbosa2, Augusto Leandro de Sousa Silva1, Alexia Leticia Pacheco Lindoso3, Emilio Furtado Sousa3, Erivânia Gomes Teixeira3 1Programa de Pós-Graduação em Recursos Aquáticos e Pesca, Universidade Estadual do Maranhão - UEMA 2Departamento de Engenharia de Pesca, Universidade Federal de Sergipe - UFS 3Departamento de Engenharia de Pesca, Universidade Estadual do Maranhão - UEMA *Email: [email protected] Received: 30 de novembro de 2017 / Accepted: 6 de dezembro de 2017 / Published: 9 de dezembro de 2017 Abstract This note reports the record of the species Resumo Esta nota relata o registro da espécie Heterotilapia buttikoferi (Hubrecht, 1881) captured Heterotilapia buttikoferi (Hubrecht, 1881) capturada in January 2012 at the Pereira de Miranda reservoir, em Janeiro de 2012 no açude Pereira de Miranda, Pentecoste, Ceará State, Brazil. This is the second Pentecoste, estado do Ceará, Brasil. Este é o segundo documented record of the presence of the species in registro documentado da presença da espécie no Brazil and the first for the Northeast of Brazil. Brasil e o primeiro para o Nordeste do Brasil. Keywords: Pisces, Tilapiini, Exotic species, Pereira de Palavras-chave: Pisces, Tilapiini, espécie exótica, Açude Miranda reservoir. Pereira de Miranda. Occurrence of Heterotilapia buttikoferi Heterotilapia buttikoferi (Hubrecht, 1881) is a freshwater species, belonging to the family Cichlidae and subfamily Pseudocrenilabrinae (Eschmeyer, Fricke & van der Laan, 2017), popularly known in Brazil as "tilápia zebra" or "zebrinha" and globally as "zebra tilapia". -

Bayesian Node Dating Based on Probabilities of Fossil Sampling Supports Trans-Atlantic Dispersal of Cichlid Fishes
Supporting Information Bayesian Node Dating based on Probabilities of Fossil Sampling Supports Trans-Atlantic Dispersal of Cichlid Fishes Michael Matschiner,1,2y Zuzana Musilov´a,2,3 Julia M. I. Barth,1 Zuzana Starostov´a,3 Walter Salzburger,1,2 Mike Steel,4 and Remco Bouckaert5,6y Addresses: 1Centre for Ecological and Evolutionary Synthesis (CEES), Department of Biosciences, University of Oslo, Oslo, Norway 2Zoological Institute, University of Basel, Basel, Switzerland 3Department of Zoology, Faculty of Science, Charles University in Prague, Prague, Czech Republic 4Department of Mathematics and Statistics, University of Canterbury, Christchurch, New Zealand 5Department of Computer Science, University of Auckland, Auckland, New Zealand 6Computational Evolution Group, University of Auckland, Auckland, New Zealand yCorresponding author: E-mail: [email protected], [email protected] 1 Supplementary Text 1 1 Supplementary Text Supplementary Text S1: Sequencing protocols. Mitochondrial genomes of 26 cichlid species were amplified by long-range PCR followed by the 454 pyrosequencing on a GS Roche Junior platform. The primers for long-range PCR were designed specifically in the mitogenomic regions with low interspecific variability. The whole mitogenome of most species was amplified as three fragments using the following primer sets: for the region between position 2 500 bp and 7 300 bp (of mitogenome starting with tRNA-Phe), we used forward primers ZM2500F (5'-ACG ACC TCG ATG TTG GAT CAG GAC ATC C-3'), L2508KAW (Kawaguchi et al. 2001) or S-LA-16SF (Miya & Nishida 2000) and reverse primer ZM7350R (5'-TTA AGG CGT GGT CGT GGA AGT GAA GAA G-3'). The region between 7 300 bp and 12 300 bp was amplified using primers ZM7300F (5'-GCA CAT CCC TCC CAA CTA GGW TTT CAA GAT GC-3') and ZM12300R (5'-TTG CAC CAA GAG TTT TTG GTT CCT AAG ACC-3'). -

Heterotilapia Buttikoferi
Heterotilapia buttikoferi Heterotilapia buttikoferi est une espèce de poissons de la famille des Cichlidae. C'est un poisson Heterotilapia buttikoferi d'eau douce tropicale qui peut être élevé en aquarium. Sommaire Taximonie Description de l'espèce Comportement Reproduction Maintenance en captivité Au zoo Heterotilapia buttikoferi en aquarium Galerie Notes et références Classification Article connexe Règne Animalia Liens externes Embranchement Chordata Classe Actinopterygii Taximonie Ordre Perciformes Le groupe des Tilapia s'est vu révisé en 2013 par Dunz Famille Cichlidae et Schliewen et a donc subi quelques modifications de 1 Genre Heterotilapia taxonomie . Espèce Description de l'espèce Heterotilapia buttikoferi (Hubrecht, 1881) D'une taille adulte de 30 cm environ, ce tilapia, au corps rayé verticalement de jaune et noir ou de bleu et noir, Statut de conservation UICN présente un dimorphisme sexuel : la femelle est un peu plus petite que le mâle. Comportement LC : Préoccupation mineure Comme la totalité des espèces de poissons de la famille des Cichlidae et du genre Tilapia, Tilapia buttikoferi est une espèce de poissons territoriale. Par définition, un couple formé et en reproduction défendra ses œufs, larves et jeunes éventuels, parfois jusqu’à la mort. Cette espèce doit être maintenue dans de grands volumes adaptés à sa taille et en compagnie d'espèces au comportement et taille similaires volumes adaptés à sa taille, et en compagnie d espèces au comportement et taille similaires. Reproduction Une fois qu'un couple formé est prêt à se reproduire, un territoire sera délimité. La ponte a lieu sur un support lisse préalablement nettoyé par les parents. La femelle peut pondre un millier d’œufs. -

Insight Into the Diversity of the Genus Coptodon
See discussions, stats, and author profiles for this publication at: https://www.researchgate.net/publication/292678428 Cichlids of the Banc d'Arguin National Park, Mauritania: Insight into the diversity of the genus Coptodon Article in Journal of Fish Biology · February 2016 DOI: 10.1111/jfb.12899 CITATIONS READS 0 193 11 authors, including: Andreas R Dunz Antoine Pariselle Zoologische Staatssammlung München Institute of Research for Development 6 PUBLICATIONS 68 CITATIONS 122 PUBLICATIONS 915 CITATIONS SEE PROFILE SEE PROFILE Camilo Carneiro Jean-Dominique Durand Aveiro University & Iceland University Institute of Research for Development 7 PUBLICATIONS 6 CITATIONS 134 PUBLICATIONS 2,135 CITATIONS SEE PROFILE SEE PROFILE Some of the authors of this publication are also working on these related projects: IRD / LIPI PARI project View project systematic of fish parasites View project All content following this page was uploaded by Jean-Dominique Durand on 23 February 2016. The user has requested enhancement of the downloaded file. All in-text references underlined in blue are added to the original document and are linked to publications on ResearchGate, letting you access and read them immediately. Journal of Fish Biology (2016) doi:10.1111/jfb.12899, available online at wileyonlinelibrary.com Cichlids of the Banc d’Arguin National Park, Mauritania: insight into the diversity of the genus Coptodon N. G. Kide*, A. Dunz†, J.-F. Agnèse‡, J. Dilyte§, A. Pariselle‡‖, C. Carneiro¶, E. Correia¶, J. C. Brito§, L. O. Yarba¶, Y. Kone** and J.-D. Durand§§ ‡‡ *Université Abdel Maleck Essaâdi - Faculté des Sciences, Département de Biologie, Laboratoire Biologie Appliqué et Pathologie, Tétouan, Morocco, †Bavarian State Collection of Zoology, Department of Ichthyology, Münchhausenstr. -
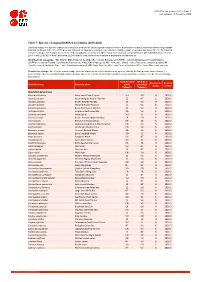
Table 7: Species Changing IUCN Red List Status (2019-2020)
IUCN Red List version 2020-3: Table 7 Last Updated: 10 December 2020 Table 7: Species changing IUCN Red List Status (2019-2020) Published listings of a species' status may change for a variety of reasons (genuine improvement or deterioration in status; new information being available that was not known at the time of the previous assessment; taxonomic changes; corrections to mistakes made in previous assessments, etc. To help Red List users interpret the changes between the Red List updates, a summary of species that have changed category between 2019 (IUCN Red List version 2019-3) and 2020 (IUCN Red List version 2020-3) and the reasons for these changes is provided in the table below. IUCN Red List Categories: EX - Extinct, EW - Extinct in the Wild, CR - Critically Endangered [CR(PE) - Critically Endangered (Possibly Extinct), CR(PEW) - Critically Endangered (Possibly Extinct in the Wild)], EN - Endangered, VU - Vulnerable, LR/cd - Lower Risk/conservation dependent, NT - Near Threatened (includes LR/nt - Lower Risk/near threatened), DD - Data Deficient, LC - Least Concern (includes LR/lc - Lower Risk, least concern). Reasons for change: G - Genuine status change (genuine improvement or deterioration in the species' status); N - Non-genuine status change (i.e., status changes due to new information, improved knowledge of the criteria, incorrect data used previously, taxonomic revision, etc.); E - Previous listing was an Error. IUCN Red List IUCN Red Reason for Red List Scientific name Common name (2019) List (2020) change version Category -

Taxonomy and Systematics the Inland Water Fishes of Africa
Taxonomy and systematics The inland water fishes of Africa l xonom y is the science of naming and describing organisms. It is a highly formalized science whose rules are established and revised regularly by an International Commission of Zoological Nomenclature created in 1895. The International Code of Zoological Nomenclature contains all the rules for designating animal species which are the same for all zoological groups. One of its basic principles is that the first name given to a species has priority over the others. It is not uncommon for taxonomic revisions of a group to reveal that some species had been described under different names, because the authors did not have access to all available informa tion or had made an error. In these conditions, the so-called priority rule must be applied. This sometimes leads to a change in the name used for the species up to that time. The situation may prove ev en more complex, as illustrated by the case of Schilbe mystus (see box " W ho is Schilbe mystus?"). Another well-known case of ambiguity is that of the mounted holotype of Synodontis xiphias described in 1864 by Gunther, which has a long and pointed snout similar to a swordfish. The species had never been recorded since then, for a perfectly good reason: an x-ray showed that the long snout was a fake nose, resulting from a metal frame used in mounting the animal (Poll, 1971) (figure 8.1). The holotype of Synodontis labeo Gunther, 1865, described later, belongs to the same species, but the name S. -

The Cichlid 16S Gene As a Phylogenetic Marker: Limits of Its Resolution for Analyzing Global Relationship
Vol. 9(1), pp. 1-7, March 2017 DOI: 10.5897/IJGMB2016.0131 Article Number: D2522A363715 International Journal of Genetics and Molecular ISSN 2006-9863 Copyright © 2017 Biology Author(s) retain the copyright of this article http://www.academicjournals.org/IJGMB Full Length Research Paper The cichlid 16S gene as a phylogenetic marker: Limits of its resolution for analyzing global relationship Olusola B. Sokefun Department of Zoology and Environmental Biology, Faculty of Science, Lagos State University, Ojo, Lagos, Nigeria Received 21 August, 2016; Accepted 15 December, 2016 The phylogenetic utility of the 16S gene in cichlids is assessed. Eighty-six (86) partial sequences belonging to 37 genera of cichlids from the Genbank was analyzed. The alignment had four hundred and sixty three (463) basepairs with 337 conserved sites and 126 variable sites. Base compositional bias is similar to that found in higher organism with Adenine having the highest average of 30.3%, followed by cytosine, guanine and thiamine with the average values of 26.1, 21.9 and 21.7% respectively. The most suitable evolutionary model is the K2+G+I model as this had the lowest Bayesian Information Criterion. There were 4 major indels at basepair positions 328 which is unique to the Heterotilapia buttikoferi, position 369 unique to Gramatoria lemarii, position 396 which is shared by Tilapia sparrmanii, T. guinasana and T. zilli. The indel at position 373 was found in all tested species except the Oreochromis mossambicus. The Tilapine general is the basal group in Cichlids. The 16S gene separates the Tilapia genera without any ambiguity but there were phylogenetic overlaps in the Sarotherodon and Oreochromis. -
Peces De Uruguay
PECES DEL URUGUAY LISTA SISTEMÁTICA Y NOMBRES COMUNES Segunda Edición corregida y ampliada © Hebert Nion, Carlos Ríos & Pablo Meneses, 2016 DINARA - Constituyente 1497 11200 - Montevideo - Uruguay ISBN (Vers. Imp.) 978-9974-594-36-4 ISBN (Vers. Elect.) 978-9974-594-37-1 Se autoriza la reproducción total o parcial de este documento por cualquier medio siempre que se cite la fuente. Acceso libre a texto completo en el repertorio OceanDocs: http://www.oceandocs.org/handle/1834/2791 Nion et al, Peces del Uruguay: Lista sistemática y nombres comunes/ Hebert, Carlos Ríos y Pablo Meneses.-Montevideo: Dinara, 2016. 172p. Segunda edición corregida y ampliada /Peces//Mariscos//Río de la Plata//CEIUAPA//Uruguay/ AGRIS M40 CDD639 Catalogación de la fuente: Lic. Aída Sogaray - Centro de Documentación y Biblioteca de la Dirección Nacional de Recursos Acuáticos ISBN (Vers. Imp.) 978-9974-594-36-4 ISBN (Vers. Elect.) 978-9974-594-37-1 Peces del Uruguay. Segunda Edición corregida y ampliada. Hebert, Carlos Ríos y Pablo Meneses. DINARA, Constituyente 1497 2016. Montevideo - Uruguay Peces del Uruguay Lista sistemática y nombres comunes Segunda Edición corregida y ampliada Hebert Nion, Carlos Ríos & Pablo Meneses MONTEVIDEO - URUGUAY 2016 Contenido Contenido i Introducción iii Mapa de Uruguay, aguas jurisdiccionales y Zona Común de Pesca Argentino-Uruguaya ix Agradecimientos xi Lista sistemática 19 Anexo I - Índice alfabético de especies 57 Anexo II - Índice alfabético de géneros 76 Anexo III - Índice alfabético de familias 87 Anexo IV - Número de especies