Oocyte Intercommunication
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Comparison of Orthologs Across Multiple Species by Various Strategies
COMPARISON OF ORTHOLOGS ACROSS MULTIPLE SPECIES BY VARIOUS STRATEGIES BY HUI LIU DISSERTATION Submitted in partial fulfillment of the requirements for the degree of Doctor of Philosophy in Biophysics and Computational Biology in the Graduate College of the University of Illinois at Urbana-Champaign, 2014 Urbana, Illinois Doctoral Committee: Professor Eric Jakobsson, Chair, Director of Research Professor Gene E. Robinson Associate Professor Saurabh Sinha Assistant Professor Jian Ma Abstract Thanks to the improvement of genome sequencing technology, abundant multi-species genomic data now became available and comparative genomics continues to be a fast prospering filed of biological research. Through the comparison of genomes of different organisms, we can understand what, at the molecular level, distinguishes different life forms from each other. It shed light on revealing the evolution of biology. And it also helps to refine the annotations and functions of individual genomes. For example, through comparisons across mammalian genomes, we can give an estimate of the conserved set of genes across mammals and correspondingly, find the species-specific sets of genes or functions. However, comparative genomics can be feasible only if a meaningful classification of genes exists. A natural way to do so is to delineate sets of orthologous genes. However, debates exist about the appropriate way to define orthologs. It is originally defined as genes in different species which derive from speciation events. But such definition is not sufficient to derive orthologous genes due to the complexity of evolutionary events such as gene duplication and gene loss. While it is possible to correctly figure out all the evolutionary events with the true phylogenetic tree, the true phylogenetic tree itself is impractical to be inferred. -

Celecoxib Treatment Alters the Gene Expression Profile of Normal Colonic Mucosa
1382 Celecoxib Treatment Alters the Gene Expression Profile of Normal Colonic Mucosa Oleg K. Glebov,1 Luz M. Rodriguez,1 Patrick Lynch,4 Sherri Patterson,4 Henry Lynch,5 Kenneth Nakahara,1 Jean Jenkins,1 Janet Cliatt,1 Casey-Jo Humbyrd,1 John DeNobile,3 Peter Soballe,3 Steven Gallinger,6 Aby Buchbinder,7 Gary Gordon,8 Ernest Hawk,2 and Ilan R. Kirsch1 1Genetics Branch, Center for Cancer Research; 2Division of Cancer Prevention, National Cancer Institute; 3Surgery Department, National Naval Medical Center, Bethesda, Maryland; 4University of Texas M.D. Anderson Cancer Center, Houston, Texas; 5Creighton University, Omaha, Nebraska; 6University of Toronto, Toronto, Ontario, Canada; 7Pharmacia, Peapack, New Jersey; and 8Ovation Pharma, Lincolnshire, Illinois Abstract A clinical trial was recently conducted to evaluate the safety Twenty-three of 25 pairs of colon biopsies taken before and efficacy of a selective inhibitor of cyclooxygenase-2 and after celecoxib treatment can be classified correctly (celecoxib) in hereditary nonpolyposis colon cancer by the pattern of gene expression in a leave-one-out patients. In a randomized, placebo-controlled phase I/II cross-validation. Immune response, particularly T- and B- multicenter trial, hereditary nonpolyposis colon cancer lymphocyte activation and early steps of inflammatory patients and gene carriers received either celecoxib at one reaction, cell signaling and cell adhesion, response to stress, of two doses or placebo. The goal was to evaluate the effects transforming growth factor-B signaling, and regulation of of these treatment arms on a number of endoscopic and apoptosis, are the main biological processes targeted by tissue-based biomarker end points after 12 months of celecoxib as shown by overrepresentation analysis of the treatment. -
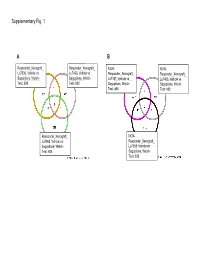
Supplementary Data
Supplementary Fig. 1 A B Responder_Xenograft_ Responder_Xenograft_ NON- NON- Lu7336, Vehicle vs Lu7466, Vehicle vs Responder_Xenograft_ Responder_Xenograft_ Sagopilone, Welch- Sagopilone, Welch- Lu7187, Vehicle vs Lu7406, Vehicle vs Test: 638 Test: 600 Sagopilone, Welch- Sagopilone, Welch- Test: 468 Test: 482 Responder_Xenograft_ NON- Lu7860, Vehicle vs Responder_Xenograft_ Sagopilone, Welch - Lu7558, Vehicle vs Test: 605 Sagopilone, Welch- Test: 333 Supplementary Fig. 2 Supplementary Fig. 3 Supplementary Figure S1. Venn diagrams comparing probe sets regulated by Sagopilone treatment (10mg/kg for 24h) between individual models (Welsh Test ellipse p-value<0.001 or 5-fold change). A Sagopilone responder models, B Sagopilone non-responder models. Supplementary Figure S2. Pathway analysis of genes regulated by Sagopilone treatment in responder xenograft models 24h after Sagopilone treatment by GeneGo Metacore; the most significant pathway map representing cell cycle/spindle assembly and chromosome separation is shown, genes upregulated by Sagopilone treatment are marked with red thermometers. Supplementary Figure S3. GeneGo Metacore pathway analysis of genes differentially expressed between Sagopilone Responder and Non-Responder models displaying –log(p-Values) of most significant pathway maps. Supplementary Tables Supplementary Table 1. Response and activity in 22 non-small-cell lung cancer (NSCLC) xenograft models after treatment with Sagopilone and other cytotoxic agents commonly used in the management of NSCLC Tumor Model Response type -

Nº Ref Uniprot Proteína Péptidos Identificados Por MS/MS 1 P01024
Document downloaded from http://www.elsevier.es, day 26/09/2021. This copy is for personal use. Any transmission of this document by any media or format is strictly prohibited. Nº Ref Uniprot Proteína Péptidos identificados 1 P01024 CO3_HUMAN Complement C3 OS=Homo sapiens GN=C3 PE=1 SV=2 por 162MS/MS 2 P02751 FINC_HUMAN Fibronectin OS=Homo sapiens GN=FN1 PE=1 SV=4 131 3 P01023 A2MG_HUMAN Alpha-2-macroglobulin OS=Homo sapiens GN=A2M PE=1 SV=3 128 4 P0C0L4 CO4A_HUMAN Complement C4-A OS=Homo sapiens GN=C4A PE=1 SV=1 95 5 P04275 VWF_HUMAN von Willebrand factor OS=Homo sapiens GN=VWF PE=1 SV=4 81 6 P02675 FIBB_HUMAN Fibrinogen beta chain OS=Homo sapiens GN=FGB PE=1 SV=2 78 7 P01031 CO5_HUMAN Complement C5 OS=Homo sapiens GN=C5 PE=1 SV=4 66 8 P02768 ALBU_HUMAN Serum albumin OS=Homo sapiens GN=ALB PE=1 SV=2 66 9 P00450 CERU_HUMAN Ceruloplasmin OS=Homo sapiens GN=CP PE=1 SV=1 64 10 P02671 FIBA_HUMAN Fibrinogen alpha chain OS=Homo sapiens GN=FGA PE=1 SV=2 58 11 P08603 CFAH_HUMAN Complement factor H OS=Homo sapiens GN=CFH PE=1 SV=4 56 12 P02787 TRFE_HUMAN Serotransferrin OS=Homo sapiens GN=TF PE=1 SV=3 54 13 P00747 PLMN_HUMAN Plasminogen OS=Homo sapiens GN=PLG PE=1 SV=2 48 14 P02679 FIBG_HUMAN Fibrinogen gamma chain OS=Homo sapiens GN=FGG PE=1 SV=3 47 15 P01871 IGHM_HUMAN Ig mu chain C region OS=Homo sapiens GN=IGHM PE=1 SV=3 41 16 P04003 C4BPA_HUMAN C4b-binding protein alpha chain OS=Homo sapiens GN=C4BPA PE=1 SV=2 37 17 Q9Y6R7 FCGBP_HUMAN IgGFc-binding protein OS=Homo sapiens GN=FCGBP PE=1 SV=3 30 18 O43866 CD5L_HUMAN CD5 antigen-like OS=Homo -

Target Gene Gene Description Validation Diana Miranda
Supplemental Table S1. Mmu-miR-183-5p in silico predicted targets. TARGET GENE GENE DESCRIPTION VALIDATION DIANA MIRANDA MIRBRIDGE PICTAR PITA RNA22 TARGETSCAN TOTAL_HIT AP3M1 adaptor-related protein complex 3, mu 1 subunit V V V V V V V 7 BTG1 B-cell translocation gene 1, anti-proliferative V V V V V V V 7 CLCN3 chloride channel, voltage-sensitive 3 V V V V V V V 7 CTDSPL CTD (carboxy-terminal domain, RNA polymerase II, polypeptide A) small phosphatase-like V V V V V V V 7 DUSP10 dual specificity phosphatase 10 V V V V V V V 7 MAP3K4 mitogen-activated protein kinase kinase kinase 4 V V V V V V V 7 PDCD4 programmed cell death 4 (neoplastic transformation inhibitor) V V V V V V V 7 PPP2R5C protein phosphatase 2, regulatory subunit B', gamma V V V V V V V 7 PTPN4 protein tyrosine phosphatase, non-receptor type 4 (megakaryocyte) V V V V V V V 7 EZR ezrin V V V V V V 6 FOXO1 forkhead box O1 V V V V V V 6 ANKRD13C ankyrin repeat domain 13C V V V V V V 6 ARHGAP6 Rho GTPase activating protein 6 V V V V V V 6 BACH2 BTB and CNC homology 1, basic leucine zipper transcription factor 2 V V V V V V 6 BNIP3L BCL2/adenovirus E1B 19kDa interacting protein 3-like V V V V V V 6 BRMS1L breast cancer metastasis-suppressor 1-like V V V V V V 6 CDK5R1 cyclin-dependent kinase 5, regulatory subunit 1 (p35) V V V V V V 6 CTDSP1 CTD (carboxy-terminal domain, RNA polymerase II, polypeptide A) small phosphatase 1 V V V V V V 6 DCX doublecortin V V V V V V 6 ENAH enabled homolog (Drosophila) V V V V V V 6 EPHA4 EPH receptor A4 V V V V V V 6 FOXP1 forkhead box P1 V -

Candidate Genes for Alcohol Preference Identified by Expression
Liang et al. Genome Biology 2010, 11:R11 http://genomebiology.com/2010/11/2/R11 RESEARCH Open Access Candidate genes for alcohol preference identified by expression profiling in alcohol-preferring and -nonpreferring reciprocal congenic rats Tiebing Liang1*, Mark W Kimpel2, Jeanette N McClintick3, Ashley R Skillman1, Kevin McCall4, Howard J Edenberg3, Lucinda G Carr1 Abstract Background: Selectively bred alcohol-preferring (P) and alcohol-nonpreferring (NP) rats differ greatly in alcohol preference, in part due to a highly significant quantitative trait locus (QTL) on chromosome 4. Alcohol consumption scores of reciprocal chromosome 4 congenic strains NP.P and P.NP correlated with the introgressed interval. The goal of this study was to identify candidate genes that may influence alcohol consumption by comparing gene expression in five brain regions of alcohol-naïve inbred alcohol-preferring and P.NP congenic rats: amygdala, nucleus accumbens, hippocampus, caudate putamen, and frontal cortex. Results: Within the QTL region, 104 cis-regulated probe sets were differentially expressed in more than one region, and an additional 53 were differentially expressed in a single region. Fewer trans-regulated probe sets were detected, and most differed in only one region. Analysis of the average expression values across the 5 brain regions yielded 141 differentially expressed cis-regulated probe sets and 206 trans-regulated probe sets. Comparing the present results from inbred alcohol-preferring vs. congenic P.NP rats to earlier results from the reciprocal congenic NP.P vs. inbred alcohol-nonpreferring rats demonstrated that 74 cis-regulated probe sets were differentially expressed in the same direction and with a consistent magnitude of difference in at least one brain region. -

Transcriptomic Analysis of Patients with Tetralogy of Fallot Reveals the Effect of Chronic Hypoxia on Myocardial Gene Expression
Ghorbel et al Congenital Heart Disease Transcriptomic analysis of patients with tetralogy of Fallot reveals the effect of chronic hypoxia on myocardial gene expression Mohamed T. Ghorbel, PhD, Myriam Cherif, PhD, Emma Jenkins, PhD, Amir Mokhtari, MRCS, Damien Kenny, MRCPCH, Gianni D. Angelini, FRCS, and Massimo Caputo, MD Objectives: In cyanotic patients undergoing repair of heart defects, chronic hypoxia is thought to lead to greater susceptibility to ischemia and reoxygenation injury. We sought to find an explanation to such a hypothesis by investigating the cardiac gene expression in patients with tetralogy of Fallot undergoing cardiac surgery. CHD Methods: The myocardial gene profile was investigated in right ventricular biopsy specimens obtained from 20 patients with a diagnosis of cyanotic (n ¼ 11) or acyanotic (n ¼ 9) tetralogy of Fallot undergoing surgical repair. Oligonucleotide microarray analyses were performed on the samples, and the array results were validated with Western blotting and enzyme-linked immunosorbent assay. Results: Data revealed 795 differentially expressed genes in cyanotic versus acyanotic hearts, with 198 upregu- lated and 597 downregulated. Growth/morphogenesis, remodeling, and apoptosis emerged as dominant func- tional themes for the upregulated genes and included the apoptotic gene TRAIL (tumor necrosis factor–related apoptosis-inducing ligand), the remodeling factor OPN (osteopontin), and the mitochondrial function gene COX11 (cytochrome-c oxidase 11). In contrast, transcription, mitogen-activated protein kinase signaling, and contractile machinery were the dominant functional classes for the downregulated genes, which included the calcium-handling gene NCX1 (sodium-calcium exchanger). Protein levels of COX11, NCX1, OPN, and LYZ (ly- sozyme) in the myocardium followed the same pattern obtained by means of transcriptomics. -

Supplementary Figure S1 A
Supplementary Figure S1 A B C 1 4 1 3 1 2 1 2 1 0 1 1 (Normalized signal values)] 2 (Normalized signal values) (Normalized 8 2 10 Log 6 AFFX-BioC AFFX-BioB AFFX-BioDn AFFX-CreX hDFs [Log 6 8 10 12 14 hOFs [Log2 (Normalized signal values)] Supplementary Figure S2 GLYCOLYSIS PENTOSE-PHOSPHATE PATHWAY Glucose Purine/pyrimidine Glucose-6-phosphate metabolism AMINO ACID Fluctose-6-phosphate AMPK METABOLISM TIGAR PFKFB2 methylgloxal GloI Ser, Gly, Thr Glyceraldehyde-3-phosphate ALDH Lactate PYRUVATE LDH METABOLISM acetic acid Ethanol Pyruvate GLYCOSPHINGOLIPID NADH BIOSYNTHESIS Ala, Cys DLD PDH PDK3 DLAT Fatty acid Lys, Trp, Leu, Acetyl CoA ACAT2 Ile, Tyr, Phe β-OXIDATION ACACA Citrate Asp, Asn Citrate Acetyl CoA Oxaloacetate Isocitrate MDH1 IDH1 Glu, Gln, His, ME2 TCA Pro, Arg 2-Oxoglutarate MDH1 CYCLE Pyruvate Malate ME2 GLUTAMINOLYSIS FH Succinyl-CoA Fumalate SUCLA2 Tyr, Phe Var, Ile, Met Supplementary Figure S3 Entrez Gene Symbol Gene Name hODs hDFs hOF-iPSCs GeneID 644 BLVRA biliverdin reductase A 223.9 259.3 253.0 3162 HMOX1 heme oxygenase 1 1474.2 2698.0 452.3 9365 KL klotho 54.1 44.8 36.5 nicotinamide 10135 NAMPT 827.7 626.2 2999.8 phosphoribosyltransferase nuclear factor (erythroid- 4780 NFE2L2 2134.5 1331.7 1006.2 derived 2) related factor 2 peroxisome proliferator- 5467 PPARD 1534.6 1352.9 330.8 activated receptor delta peroxisome proliferator- 5468 PPARG 524.4 100.8 63.0 activated receptor gamma 5621 PRNP prion protein 4059.0 3134.1 1065.5 5925 RB1 retinoblastoma 1 882.9 805.8 739.3 23411 SIRT1 sirtuin 1 231.5 216.8 1676.0 7157 TP53 -
WO 2015/066640 Al 7 May 2015 (07.05.2015) P O P C T
(12) INTERNATIONAL APPLICATION PUBLISHED UNDER THE PATENT COOPERATION TREATY (PCT) (19) World Intellectual Property Organization International Bureau (10) International Publication Number (43) International Publication Date WO 2015/066640 Al 7 May 2015 (07.05.2015) P O P C T (51) International Patent Classification: (81) Designated States (unless otherwise indicated, for every C12N 15/09 (2006.01) kind of national protection available): AE, AG, AL, AM, AO, AT, AU, AZ, BA, BB, BG, BH, BN, BR, BW, BY, (21) International Application Number: BZ, CA, CH, CL, CN, CO, CR, CU, CZ, DE, DK, DM, PCT/US2014/063736 DO, DZ, EC, EE, EG, ES, FI, GB, GD, GE, GH, GM, GT, (22) International Filing Date: HN, HR, HU, ID, IL, IN, IR, IS, JP, KE, KG, KN, KP, KR, 3 November 20 14 (03 .11.20 14) KZ, LA, LC, LK, LR, LS, LU, LY, MA, MD, ME, MG, MK, MN, MW, MX, MY, MZ, NA, NG, NI, NO, NZ, OM, (25) Filing Language: English PA, PE, PG, PH, PL, PT, QA, RO, RS, RU, RW, SA, SC, (26) Publication Language: English SD, SE, SG, SK, SL, SM, ST, SV, SY, TH, TJ, TM, TN, TR, TT, TZ, UA, UG, US, UZ, VC, VN, ZA, ZM, ZW. (30) Priority Data: 61/898,928 1 November 2013 (01. 11.2013) US (84) Designated States (unless otherwise indicated, for every 61/898,932 1 November 2013 (01. 11.2013) US kind of regional protection available): ARIPO (BW, GH, GM, KE, LR, LS, MW, MZ, NA, RW, SD, SL, ST, SZ, (71) Applicant: THE RESEARCH INSTITUTE AT NA¬ TZ, UG, ZM, ZW), Eurasian (AM, AZ, BY, KG, KZ, RU, TIONWIDE CHILDREN'S HOSPITAL [US/US]; 700 TJ, TM), European (AL, AT, BE, BG, CH, CY, CZ, DE, Children's Drive, Columbus, Ohio 53305 (US). -

A Novel Approach to Identification of Diagnostic Markers In
A NOVEL APPROACH TO IDENTIFICATION OF DIAGNOSTIC MARKERS IN PROSTATE CANCER by INNA SHYSHYNOVA Submitted in partial fulfillment of the requirements For the degree of Doctor of Philosophy Dissertation Adviser: Professor Andrei Gudkov Department of Biochemistry CASE WESTERN RESERVE UNIVERSITY August, 2006 iii TABLE OF CONTENTS CHAPTER .................................................................................................................. PAGE A NOVEL APPROACH TO IDENTIFICATION OF DIAGNOSTIC MARKERS IN PROSTATE CANCER ...........................................................................................1 TABLE OF CONTENTS.................................................................................................. IV LIST OF FIGURES .......................................................................................................... IX LIST OF TABLES............................................................................................................ XI ACKNOWLEDMENTS .................................................................................................XIII LIST OF ABBREVIATIONS........................................................................................ XIV I. INTRODUCTION ...................................................................................................1 1. Tumor markers.............................................................................................1 2. The prostate..................................................................................................5 -

4 353 Skin Oral 1 B
A B Supplementary Figure S1: Differentially expressed piRNAs during skin and oral mucosal wound healing. (A) piRNA 0hr-1 0hr-3 0hr-2 24hr-2 24hr-1 24hr-3 5day-3 5day-1 5day-2 0hr-1 0hr-2 0hr-3 24hr-2 24hr-1 24hr-3 5day-1 5day-2 5day-3 profiles were obtained on mouse skin and oral mucosal (palate) wound healing time course (0hr, 24 hr, and 5 day). A total of 357 differentially expressed piRNA were identified during skin wound healing (Bonferroni adjusted P value <0.05). See Supplementary Table 1A for the full list. C (B) Five differentially expressed piRNA skin were identified during oral mucosal wound healing (P value <0.01, list presented in Supplementary Table 1B). Note: more 353 stringent statistical cut-off ((Bonferroni adjusted P value) yield 0 differentially expressed piRNA gene. (C) Venn diagram illustrates overlaps between differentially 4 expressedpiRNAsinskinandoral oral 1 mucosal wound healing. min max Supplementary Table S1a: Differentially expressed piRNAs in skin wound healing Mean StDev piRNA 0 hr 24 hr 5 day 0 hr 24 hr 5 day pVal adj P piR‐mmu‐15927330 5.418351 11.39746 10.799 0.34576 0.253492 0.154802 6.32E‐14 6.97E‐11 piR‐mmu‐49559417 5.301647 10.10777 9.816878 0.441719 0.222335 0.032479 3.95E‐12 4.36E‐09 piR‐mmu‐30053093 6.32531 11.26384 4.020902 0.280841 1.057847 0.178798 5.21E‐12 5.76E‐09 piR‐mmu‐29303577 5.15005 10.47662 9.52175 0.554877 0.26622 0.163283 1.53E‐11 1.69E‐08 piR‐mmu‐49254706 5.187673 10.19644 9.622374 0.520671 0.330378 0.191116 1.96E‐11 2.16E‐08 piR‐mmu‐49005170 5.415133 9.639725 9.565967 0.411507 0.281143 -

Deriving a Refined Set of Housekeeping Genes in Differentiating Human Embryonic Stem Cells Ida Paramonov
Deriving a refined set of housekeeping genes in differentiating human embryonic stem cells Ida Paramonov Masters Degree in Bioinformatics School of Humanities and Informatics University of Skövde 2008 Academic supervisor: Jane Synnergren Deriving a refined set of housekeeping genes in differentiating human embryonic stem cells Submitted by Ida Paramonov to the University of Skövde as a dissertation towards the degree of M.Sc. by examination and dissertation in the School of Humanities and Informatics. February 2008 I hereby certify that all material in this dissertation which is not my own work has been identified and that no material is included for which a degree has already been conferred upon me. ______________________ (Ida Paramonov ) 2 Abstract In this thesis project housekeeping genes in differentiating human embryonic stem cells were investigated. Housekeeping genes are involved in basic functions in the cells and are assumed to be expressed at relatively constant levels across different cell types and experimental conditions. Based on these features, housekeeping genes are frequently used as controls in calibration of gene expression data. Commonly used housekeeping genes in somatic tissues have shown to vary notably in human embryonic stem cells and are therefore inappropriate as reference genes in this unique cell type. In the present work a novel set of gene expression data obtained by profiling of undifferentiated and early differentiating cardiac cells, was analyzed. Stably expressed genes were identified in this data set and were subsequently intersected with a previously proposed set of 292 stable genes in human embryonic stem cells. A resulting set of 73 genes show stability across all investigated cell lines and experimental conditions.