The Role of APC (Anaphase-Promoting Comlpex) in G2/M After DNA Damage Jinho Lee
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

A Computational Approach for Defining a Signature of Β-Cell Golgi Stress in Diabetes Mellitus
Page 1 of 781 Diabetes A Computational Approach for Defining a Signature of β-Cell Golgi Stress in Diabetes Mellitus Robert N. Bone1,6,7, Olufunmilola Oyebamiji2, Sayali Talware2, Sharmila Selvaraj2, Preethi Krishnan3,6, Farooq Syed1,6,7, Huanmei Wu2, Carmella Evans-Molina 1,3,4,5,6,7,8* Departments of 1Pediatrics, 3Medicine, 4Anatomy, Cell Biology & Physiology, 5Biochemistry & Molecular Biology, the 6Center for Diabetes & Metabolic Diseases, and the 7Herman B. Wells Center for Pediatric Research, Indiana University School of Medicine, Indianapolis, IN 46202; 2Department of BioHealth Informatics, Indiana University-Purdue University Indianapolis, Indianapolis, IN, 46202; 8Roudebush VA Medical Center, Indianapolis, IN 46202. *Corresponding Author(s): Carmella Evans-Molina, MD, PhD ([email protected]) Indiana University School of Medicine, 635 Barnhill Drive, MS 2031A, Indianapolis, IN 46202, Telephone: (317) 274-4145, Fax (317) 274-4107 Running Title: Golgi Stress Response in Diabetes Word Count: 4358 Number of Figures: 6 Keywords: Golgi apparatus stress, Islets, β cell, Type 1 diabetes, Type 2 diabetes 1 Diabetes Publish Ahead of Print, published online August 20, 2020 Diabetes Page 2 of 781 ABSTRACT The Golgi apparatus (GA) is an important site of insulin processing and granule maturation, but whether GA organelle dysfunction and GA stress are present in the diabetic β-cell has not been tested. We utilized an informatics-based approach to develop a transcriptional signature of β-cell GA stress using existing RNA sequencing and microarray datasets generated using human islets from donors with diabetes and islets where type 1(T1D) and type 2 diabetes (T2D) had been modeled ex vivo. To narrow our results to GA-specific genes, we applied a filter set of 1,030 genes accepted as GA associated. -

Mitosis Vs. Meiosis
Mitosis vs. Meiosis In order for organisms to continue growing and/or replace cells that are dead or beyond repair, cells must replicate, or make identical copies of themselves. In order to do this and maintain the proper number of chromosomes, the cells of eukaryotes must undergo mitosis to divide up their DNA. The dividing of the DNA ensures that both the “old” cell (parent cell) and the “new” cells (daughter cells) have the same genetic makeup and both will be diploid, or containing the same number of chromosomes as the parent cell. For reproduction of an organism to occur, the original parent cell will undergo Meiosis to create 4 new daughter cells with a slightly different genetic makeup in order to ensure genetic diversity when fertilization occurs. The four daughter cells will be haploid, or containing half the number of chromosomes as the parent cell. The difference between the two processes is that mitosis occurs in non-reproductive cells, or somatic cells, and meiosis occurs in the cells that participate in sexual reproduction, or germ cells. The Somatic Cell Cycle (Mitosis) The somatic cell cycle consists of 3 phases: interphase, m phase, and cytokinesis. 1. Interphase: Interphase is considered the non-dividing phase of the cell cycle. It is not a part of the actual process of mitosis, but it readies the cell for mitosis. It is made up of 3 sub-phases: • G1 Phase: In G1, the cell is growing. In most organisms, the majority of the cell’s life span is spent in G1. • S Phase: In each human somatic cell, there are 23 pairs of chromosomes; one chromosome comes from the mother and one comes from the father. -

The Cardiomyocyte Cell Cycle," Novartis Found Symposium 274 (2006): 196-276
DePauw University Scholarly and Creative Work from DePauw University Biology Faculty publications Biology 2006 The ac rdiomyocyte cell cycle Pascal J. Lafontant DePauw University, [email protected] Follow this and additional works at: http://scholarship.depauw.edu/bio_facpubs Part of the Biology Commons Recommended Citation Lafontant, Pascal J. E. and Loren J. Field. "The cardiomyocyte cell cycle," Novartis Found Symposium 274 (2006): 196-276. This Article is brought to you for free and open access by the Biology at Scholarly and Creative Work from DePauw University. It has been accepted for inclusion in Biology Faculty publications by an authorized administrator of Scholarly and Creative Work from DePauw University. For more information, please contact [email protected]. NIH Public Access Author Manuscript Novartis Found Symp. Author manuscript; available in PMC 2009 January 20. NIH-PA Author ManuscriptPublished NIH-PA Author Manuscript in final edited NIH-PA Author Manuscript form as: Novartis Found Symp. 2006 ; 274: 196±276. The cardiomyocyte cell cycle Pascal J. E. Lafontant and Loren J. Field From the Wells Center for Pediatric Research and Krannert Institute of Cardiology, Indiana University School of Medicine, Indianapolis, IN 46202-5225. Abstract Many forms of cardiac disease are characterized by cardiomyocyte death due to necrosis, apoptosis and/or oncosis. Recently, the notion of promoting cardiac regeneration as a means to replace damaged heart tissue has engendered considerable interest. One approach to accomplish heart muscle regeneration entails promoting cardiomyocyte cell cycle activity in the surviving myocardium. Genetically modified mice have provided useful model systems to test the efficacy of specific pathways to promote cardiomyocyte proliferation in normal and diseased hearts. -

Requirement for Cyclin D3 in Germinal Center Formation and Function
Cell Research (2010) :1-16. © 2010 IBCB, SIBS, CAS All rights reserved 1001-0602/10 $ 32.00 npg ORIGINAL ARTICLE www.nature.com/cr Requirement for cyclin D3 in germinal center formation and function Jonathan U Peled1, J Jessica Yu1, Jeganathan Venkatesh2, Enguang Bi1, B Belinda Ding1, 5, Melissa Krupski-Downs1, Rita Shaknovich3, Piotr Sicinski4, Betty Diamond2, Matthew D Scharff1, B Hilda Ye1 1Department of Cell Biology, Albert Einstein College of Medicine, 1300 Morris Park Avenue, Bronx, NY 10461, USA; 2The Center for Autoimmune and Musculoskeletal Disease, The Feinstein Institute for Medical Research, Manhasset, NY 11030, USA; 3Depart- ments of Medicine and Pathology, Weill Cornell College of Medicine, New York, NY 10021, USA; 4Department of Cancer Biology, Dana-Farber Cancer Institute, and Department of Pathology, Harvard Medical School, Boston, MA 02115, USA Germinal centers (GC) of secondary lymphoid tissues are critical to mounting a high-affinity humoral immune response. B cells within the GC undergo rapid clonal expansion and selection while diversifying their antibody genes. Although it is generally believed that GC B cells employ a unique proliferative program to accommodate these pro- cesses, little is known about how the GC-associated cell cycle is orchestrated. The D-type cyclins constitute an im- portant component of the cell cycle engine that enables the cells to respond to physiological changes. Cell type- and developmental stage-specific roles of D-type cyclins have been described but the cyclin D requirement during GC reaction has not been addressed. In this study, we report that cyclin D3 is largely dispensable for proliferation and Ig class switching of in vitro activated B cells. -

Ccnf (NM 007634) Mouse Tagged ORF Clone – MR210593 | Origene
OriGene Technologies, Inc. 9620 Medical Center Drive, Ste 200 Rockville, MD 20850, US Phone: +1-888-267-4436 [email protected] EU: [email protected] CN: [email protected] Product datasheet for MR210593 Ccnf (NM_007634) Mouse Tagged ORF Clone Product data: Product Type: Expression Plasmids Product Name: Ccnf (NM_007634) Mouse Tagged ORF Clone Tag: Myc-DDK Symbol: Ccnf Synonyms: CycF; Fbxo1 Vector: pCMV6-Entry (PS100001) E. coli Selection: Kanamycin (25 ug/mL) Cell Selection: Neomycin This product is to be used for laboratory only. Not for diagnostic or therapeutic use. View online » ©2021 OriGene Technologies, Inc., 9620 Medical Center Drive, Ste 200, Rockville, MD 20850, US 1 / 4 Ccnf (NM_007634) Mouse Tagged ORF Clone – MR210593 ORF Nucleotide >MR210593 ORF sequence Sequence: Red=Cloning site Blue=ORF Green=Tags(s) TTTTGTAATACGACTCACTATAGGGCGGCCGGGAATTCGTCGACTGGATCCGGTACCGAGGAGATCTGCC GCCGCGATCGCC ATGGGGAGCGGCGGTGTGATCCATTGTAGGTGTGCCAAGTGTTTCTGTTATCCTACTAAACGAAGAATCA AAAGAAGACCCAGAAACTTAACCATCTTGAGTCTCCCAGAAGATGTACTCTTTCATATCCTGAAATGGCT TTCTGTTGGGGACATCCTTGCTGTCCGAGCTGTCCACTCCCACCTCAAGTACCTGGTGGACAACCATGCC AGTGTGTGGGCATCCGCCAGCTTCCAGGAGCTGTGGCCTTCTCCACAGAACCTGAAGCTCTTTGAAAGGG CTGCTGAAAAGGGAAATTTTGAAGCTGCTGTGAAGTTGGGGATTGCCTACCTCTACAATGAAGGCCTGTC TGTGTCAGATGAGGCCTGCGCAGAAGTGAACGGCTTGAAGGCCTCTCGCTTCTTCAGCATGGCTGAGAGA CTGAATACGGGTTCTGAGCCCTTCATTTGGCTCTTCATCCGCCCACCGTGGTCAGTGTCCGGAAGCTGCT GCAAGGCTGTGGTTCATGACAGCCTCCGAGCGGAGTGTCAGTTACAGAGAAGTCATAAAGCTTCCATACT ACACTGCTTGGGAAGGGTGCTAAATCTTTTTGAGGACGAAGAGAAAAGGAAGCAGGCGCGTAGCCTTTTG -

Mithramycin Represses Basal and Cigarette Smoke–Induced Expression of ABCG2 and Inhibits Stem Cell Signaling in Lung and Esophageal Cancer Cells
Cancer Therapeutics, Targets, and Chemical Biology Research Mithramycin Represses Basal and Cigarette Smoke–Induced Expression of ABCG2 and Inhibits Stem Cell Signaling in Lung and Esophageal Cancer Cells Mary Zhang1, Aarti Mathur1, Yuwei Zhang1, Sichuan Xi1, Scott Atay1, Julie A. Hong1, Nicole Datrice1, Trevor Upham1, Clinton D. Kemp1, R. Taylor Ripley1, Gordon Wiegand2, Itzak Avital2, Patricia Fetsch3, Haresh Mani6, Daniel Zlott4, Robert Robey5, Susan E. Bates5, Xinmin Li7, Mahadev Rao1, and David S. Schrump1 Abstract Cigarette smoking at diagnosis or during therapy correlates with poor outcome in patients with lung and esophageal cancers, yet the underlying mechanisms remain unknown. In this study, we observed that exposure of esophageal cancer cells to cigarette smoke condensate (CSC) led to upregulation of the xenobiotic pump ABCG2, which is expressed in cancer stem cells and confers treatment resistance in lung and esophageal carcinomas. Furthermore, CSC increased the side population of lung cancer cells containing cancer stem cells. Upregulation of ABCG2 coincided with increased occupancy of aryl hydrocarbon receptor, Sp1, and Nrf2 within the ABCG2 promoter, and deletion of xenobiotic response elements and/or Sp1 sites markedly attenuated ABCG2 induction. Under conditions potentially achievable in clinical settings, mithramycin diminished basal as well as CSC- mediated increases in AhR, Sp1, and Nrf2 levels within the ABCG2 promoter, markedly downregulated ABCG2, and inhibited proliferation and tumorigenicity of lung and esophageal cancer cells. Microarray analyses revealed that mithramycin targeted multiple stem cell–related pathways in vitro and in vivo. Collectively, our findings provide a potential mechanistic link between smoking status and outcome of patients with lung and esophageal cancers, and support clinical use of mithramycin for repressing ABCG2 and inhibiting stem cell signaling in thoracic malignancies. -

Expression Profiling of KLF4
Expression Profiling of KLF4 AJCR0000006 Supplemental Data Figure S1. Snapshot of enriched gene sets identified by GSEA in Klf4-null MEFs. Figure S2. Snapshot of enriched gene sets identified by GSEA in wild type MEFs. 98 Am J Cancer Res 2011;1(1):85-97 Table S1: Functional Annotation Clustering of Genes Up-Regulated in Klf4 -Null MEFs ILLUMINA_ID Gene Symbol Gene Name (Description) P -value Fold-Change Cell Cycle 8.00E-03 ILMN_1217331 Mcm6 MINICHROMOSOME MAINTENANCE DEFICIENT 6 40.36 ILMN_2723931 E2f6 E2F TRANSCRIPTION FACTOR 6 26.8 ILMN_2724570 Mapk12 MITOGEN-ACTIVATED PROTEIN KINASE 12 22.19 ILMN_1218470 Cdk2 CYCLIN-DEPENDENT KINASE 2 9.32 ILMN_1234909 Tipin TIMELESS INTERACTING PROTEIN 5.3 ILMN_1212692 Mapk13 SAPK/ERK/KINASE 4 4.96 ILMN_2666690 Cul7 CULLIN 7 2.23 ILMN_2681776 Mapk6 MITOGEN ACTIVATED PROTEIN KINASE 4 2.11 ILMN_2652909 Ddit3 DNA-DAMAGE INDUCIBLE TRANSCRIPT 3 2.07 ILMN_2742152 Gadd45a GROWTH ARREST AND DNA-DAMAGE-INDUCIBLE 45 ALPHA 1.92 ILMN_1212787 Pttg1 PITUITARY TUMOR-TRANSFORMING 1 1.8 ILMN_1216721 Cdk5 CYCLIN-DEPENDENT KINASE 5 1.78 ILMN_1227009 Gas2l1 GROWTH ARREST-SPECIFIC 2 LIKE 1 1.74 ILMN_2663009 Rassf5 RAS ASSOCIATION (RALGDS/AF-6) DOMAIN FAMILY 5 1.64 ILMN_1220454 Anapc13 ANAPHASE PROMOTING COMPLEX SUBUNIT 13 1.61 ILMN_1216213 Incenp INNER CENTROMERE PROTEIN 1.56 ILMN_1256301 Rcc2 REGULATOR OF CHROMOSOME CONDENSATION 2 1.53 Extracellular Matrix 5.80E-06 ILMN_2735184 Col18a1 PROCOLLAGEN, TYPE XVIII, ALPHA 1 51.5 ILMN_1223997 Crtap CARTILAGE ASSOCIATED PROTEIN 32.74 ILMN_2753809 Mmp3 MATRIX METALLOPEPTIDASE -
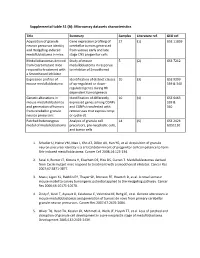
Supplemental Table S1 (A): Microarray Datasets Characteristics
Supplemental table S1 (A): Microarray datasets characteristics Title Summary Samples Literature ref. GEO ref. Acquisition of granule Gene expression profiling of 27 (1) GSE 11859 neuron precursor identity cerebellar tumors generated and Hedgehog‐induced from various early and late medulloblastoma in mice. stage CNS progenitor cells Medulloblastomas derived Study of mouse 5 (2) GSE 7212 from Cxcr6 mutant mice medulloblastoma in response respond to treatment with to inhibitor of Smoothened a Smoothened inhibitor Expression profiles of Identification of distinct classes 10 (3) GSE 9299 mouse medulloblastoma of up‐regulated or down‐ 339 & 340 regulated genes during Hh dependent tumorigenesis Genetic alterations in Identification of differently 10 (4) GSE 6463 mouse medulloblastomas expressed genes among CGNPs 339 & and generation of tumors and CGNPs transfected with 340 from cerebellar granule retroviruses that express nmyc neuron precursors or cyclin‐d1 Patched heterozygous Analysis of granule cell 14 (5) GSE 2426 model of medulloblastoma precursors, pre‐neoplastic cells, GDS1110 and tumor cells 1. Schuller U, Heine VM, Mao J, Kho AT, Dillon AK, Han YG, et al. Acquisition of granule neuron precursor identity is a critical determinant of progenitor cell competence to form Shh‐induced medulloblastoma. Cancer Cell 2008;14:123‐134. 2. Sasai K, Romer JT, Kimura H, Eberhart DE, Rice DS, Curran T. Medulloblastomas derived from Cxcr6 mutant mice respond to treatment with a smoothened inhibitor. Cancer Res 2007;67:3871‐3877. 3. Mao J, Ligon KL, Rakhlin EY, Thayer SP, Bronson RT, Rowitch D, et al. A novel somatic mouse model to survey tumorigenic potential applied to the Hedgehog pathway. Cancer Res 2006;66:10171‐10178. -

Altered Gene Expression Encoding Cytochines, Grow Factors and Cell Cycle Regulators in the Endometrium of Women with Chronic Endometritis
diagnostics Article Altered Gene Expression Encoding Cytochines, Grow Factors and Cell Cycle Regulators in the Endometrium of Women with Chronic Endometritis Ettore Cicinelli 1, Amerigo Vitagliano 2,* , Vera Loizzi 1, Dominique De Ziegler 3, Margherita Fanelli 4 , Stefano Bettocchi 1, Claudia Nardelli 1, Giuseppe Trojano 1, Rossana Cicinelli 1, Crescenzio Francesco Minervini 5 , Daniela Leronni 6 and Luigi Viggiano 7 1 2nd Unit of Obstetrics and Gynecology, Department of Biomedical and Human Oncologic Science, Policlinico University of Bari, 70124 Bari, Italy; [email protected] (E.C.); [email protected] (V.L.); [email protected] (S.B.); [email protected] (C.N.); [email protected] (G.T.); [email protected] (R.C.) 2 Department of Women and Children’s Health, University of Padua, 35128 Padua, Italy 3 Department of Ob Gyn and Reproductive Medicine, Foch Hospital, 92150 Suresnes, France; [email protected] 4 Interdisciplinary Department of Medicine, University of Bari, 70124 Bari, Italy; [email protected] 5 Department of Emergency and Organ Transplantation (D.E.T.O.), Hematology Section, University of Bari, 70124 Bari, Italy; [email protected] 6 Neuroapoptosis Laboratory, Department of Neurological Surgery, University of Pittsburgh, Pittsburgh, PA 15213, USA; [email protected] 7 Department of Biology, University of Bari, 700124 Bari, Italy; [email protected] * Correspondence: [email protected]; Tel.: +39-333-1467105; Fax: +39-049-8211785 Citation: Cicinelli, E.; Vitagliano, A.; Loizzi, V.; De Ziegler, D.; Fanelli, M.; Abstract: To evaluate the expression of genes encoding cytokines, grow factors and cell cycle regula- Bettocchi, S.; Nardelli, C.; Trojano, G.; tors in the proliferative endometrium of women with chronic endometritis (CE) compared to controls. -

The Tumor Suppressor Notch Inhibits Head and Neck Squamous Cell
The Texas Medical Center Library DigitalCommons@TMC The University of Texas MD Anderson Cancer Center UTHealth Graduate School of The University of Texas MD Anderson Cancer Biomedical Sciences Dissertations and Theses Center UTHealth Graduate School of (Open Access) Biomedical Sciences 12-2015 THE TUMOR SUPPRESSOR NOTCH INHIBITS HEAD AND NECK SQUAMOUS CELL CARCINOMA (HNSCC) TUMOR GROWTH AND PROGRESSION BY MODULATING PROTO-ONCOGENES AXL AND CTNNAL1 (α-CATULIN) Shhyam Moorthy Shhyam Moorthy Follow this and additional works at: https://digitalcommons.library.tmc.edu/utgsbs_dissertations Part of the Biochemistry, Biophysics, and Structural Biology Commons, Cancer Biology Commons, Cell Biology Commons, and the Medicine and Health Sciences Commons Recommended Citation Moorthy, Shhyam and Moorthy, Shhyam, "THE TUMOR SUPPRESSOR NOTCH INHIBITS HEAD AND NECK SQUAMOUS CELL CARCINOMA (HNSCC) TUMOR GROWTH AND PROGRESSION BY MODULATING PROTO-ONCOGENES AXL AND CTNNAL1 (α-CATULIN)" (2015). The University of Texas MD Anderson Cancer Center UTHealth Graduate School of Biomedical Sciences Dissertations and Theses (Open Access). 638. https://digitalcommons.library.tmc.edu/utgsbs_dissertations/638 This Dissertation (PhD) is brought to you for free and open access by the The University of Texas MD Anderson Cancer Center UTHealth Graduate School of Biomedical Sciences at DigitalCommons@TMC. It has been accepted for inclusion in The University of Texas MD Anderson Cancer Center UTHealth Graduate School of Biomedical Sciences Dissertations and Theses (Open Access) by an authorized administrator of DigitalCommons@TMC. For more information, please contact [email protected]. THE TUMOR SUPPRESSOR NOTCH INHIBITS HEAD AND NECK SQUAMOUS CELL CARCINOMA (HNSCC) TUMOR GROWTH AND PROGRESSION BY MODULATING PROTO-ONCOGENES AXL AND CTNNAL1 (α-CATULIN) by Shhyam Moorthy, B.S. -

Targeting the WEE1 Kinase As a Molecular Targeted Therapy for Gastric Cancer
www.impactjournals.com/oncotarget/ Oncotarget, Vol. 7, No. 31 Research Paper Targeting the WEE1 kinase as a molecular targeted therapy for gastric cancer Hye-Young Kim1,2, Yunhee Cho1,3, HyeokGu Kang1,3, Ye-Seal Yim1,3, Seok-Jun Kim1,3, Jaewhan Song2, Kyung-Hee Chun1,3 1Department of Biochemistry & Molecular Biology, Yonsei University College of Medicine, Seodaemun-gu, Seoul 03722, Korea 2Department of Biochemistry, College of Life Science and Biotechnology, Seodaemun-gu, Seoul 03722, Korea 3Brain Korea 21 PlusProject for Medical Science, Yonsei University, Seodaemun-gu, Seoul 03722, Korea Correspondence to: Kyung-Hee Chun, email: [email protected] Keywords: WEE1, AZD1775 (MK-1775), 5-FU, Paclitaxel, gastric cancer Received: September 07, 2015 Accepted: May 28, 2016 Published: June 23, 2016 ABSTRACT Wee1 is a member of the Serine/Threonine protein kinase family and is a key regulator of cell cycle progression. It has been known that WEE1 is highly expressed and has oncogenic functions in various cancers, but it is not yet studied in gastric cancers. In this study, we investigated the oncogenic role and therapeutic potency of targeting WEE1 in gastric cancer. At first, higher expression levels of WEE1 with lower survival probability were determined in stage 4 gastric cancer patients or male patients with accompanied lymph node metastasis. To determine the function of WEE1 in gastric cancer cells, we determined that WEE1 ablation decreased the proliferation, migration, and invasion, while overexpression of WEE1 increased these effects in gastric cancer cells. We also validated the clinical application of WEE1 targeting by a small molecule, AZD1775 (MK-1775), which is a WEE1 specific inhibitor undergoing clinical trials. -

The Cell Cycle & Mitosis
The Cell Cycle & Mitosis Cell Growth The Cell Cycle is G1 phase ___________________________________ _______________________________ During the Cell Cycle, a cell ___________________________________ ___________________________________ Anaphase Cell Division ___________________________________ Mitosis M phase M ___________________________________ S phase replication DNA Interphase Interphase is ___________________________ ___________________________________ G2 phase Interphase is divided into three phases: ___, ___, & ___ G1 Phase S Phase G2 Phase The G1 phase is a period of The S phase replicates During the G2 phase, many of activity in which cells _______ ________________and the organelles and molecules ____________________ synthesizes _______ molecules. required for ____________ __________ Cells will When DNA replication is ___________________ _______________ and completed, _____________ When G2 is completed, the cell is synthesize new ___________ ____________________ ready to enter the ____________________ ____________________ ____________________ ____________________ ____________________ Mitosis are divided into four phases: _____________, ______________, _____________, & _____________ Below are cells in two different phases of the cell cycle, fill in the blanks using the word bank: Chromatin Nuclear Envelope Chromosome Sister Chromatids Nucleolus Spinder Fiber Centrosome Centrioles 5.._________ 1.__________ v 6..__________ 2.__________ 7.__________ 3.__________ 8..__________ 4.__________ v The Cell Cycle & Mitosis Microscope Lab: