Asteraceae, Cardueae)
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Phylogeny and Evolution of the Arctium-Cousinia Complex (Compositae, Cardueae-Carduinae)
View metadata, citation and similar papers at core.ac.uk brought to you by CORE provided by Digital.CSIC TAXON 58 (1) • February 2009: 153–171 López-Vinyallonga & al. • Arctium-Cousinia complex Phylogeny and evolution of the Arctium-Cousinia complex (Compositae, Cardueae-Carduinae) Sara López-Vinyallonga1,4*, Iraj Mehregan2,4, Núria Garcia-Jacas1, Olga Tscherneva3, Alfonso Susanna1 & Joachim W. Kadereit2 1 Botanical Institute of Barcelona (CSIC-ICUB), Pg. del Migdia s. n., 08038 Barcelona, Spain. *slopez@ibb. csic.es (author for correspondence) 2 Johannes Gutenberg-Universität Mainz, Institut für Spezielle Botanik und Botanischer Garten, 55099 Mainz, Germany 3 Komarov Botanical Institute, Ul. Prof. Popova 2, 197376 St. Petersburg, Russia 4 These authors contributed equally to this publication The phylogeny and evolution of the Arctium-Cousinia complex, including Arctium, Cousinia as one of the largest genera of Asteraceae, Hypacanthium and Schmalhausenia, is investigated. This group of genera has its highest diversity in the Irano-Turanian region and the mountains of Central Asia. We generated ITS and rpS4-trnT-trnL sequences for altogether 138 species, including 129 (of ca. 600) species of Cousinia. As found in previous analyses, Cousinia is not monophyletic. Instead, Cousinia subgg. Cynaroides and Hypacanthodes with together ca. 30 species are more closely related to Arctium, Hypacanthium and Schmalhausenia (Arc- tioid clade) than to subg. Cousinia (Cousinioid clade). The Arctioid and Cousiniod clades are also supported by pollen morphology and chromosome number as reported earlier. In the Arctioid clade, the distribution of morphological characters important for generic delimitation, mainly leaf shape and armature and morphology of involucral bracts, are highly incongruent with phylogenetic relationships as implied by the molecular data. -

Molecular Identification of Commercialized Medicinal Plants in Southern Morocco
Molecular Identification of Commercialized Medicinal Plants in Southern Morocco Anneleen Kool1*., Hugo J. de Boer1.,A˚ sa Kru¨ ger2, Anders Rydberg1, Abdelaziz Abbad3, Lars Bjo¨ rk1, Gary Martin4 1 Department of Systematic Biology, Evolutionary Biology Centre, Uppsala University, Uppsala, Sweden, 2 Department of Botany, Stockholm University, Stockholm, Sweden, 3 Laboratory of Biotechnology, Protection and Valorisation of Plant Resources, Faculty of Science Semlalia, Cadi Ayyad University, Marrakech, Morocco, 4 Global Diversity Foundation, Dar Ylane, Marrakech, Morocco Abstract Background: Medicinal plant trade is important for local livelihoods. However, many medicinal plants are difficult to identify when they are sold as roots, powders or bark. DNA barcoding involves using a short, agreed-upon region of a genome as a unique identifier for species– ideally, as a global standard. Research Question: What is the functionality, efficacy and accuracy of the use of barcoding for identifying root material, using medicinal plant roots sold by herbalists in Marrakech, Morocco, as a test dataset. Methodology: In total, 111 root samples were sequenced for four proposed barcode regions rpoC1, psbA-trnH, matK and ITS. Sequences were searched against a tailored reference database of Moroccan medicinal plants and their closest relatives using BLAST and Blastclust, and through inference of RAxML phylograms of the aligned market and reference samples. Principal Findings: Sequencing success was high for rpoC1, psbA-trnH, and ITS, but low for matK. Searches using rpoC1 alone resulted in a number of ambiguous identifications, indicating insufficient DNA variation for accurate species-level identification. Combining rpoC1, psbA-trnH and ITS allowed the majority of the market samples to be identified to genus level. -
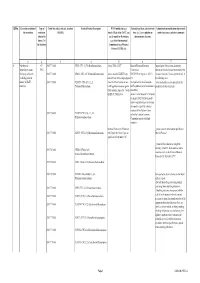
Qrno. 1 2 3 4 5 6 7 1 CP 2903 77 100 0 Cfcl3
QRNo. General description of Type of Tariff line code(s) affected, based on Detailed Product Description WTO Justification (e.g. National legal basis and entry into Administration, modification of previously the restriction restriction HS(2012) Article XX(g) of the GATT, etc.) force (i.e. Law, regulation or notified measures, and other comments (Symbol in and Grounds for Restriction, administrative decision) Annex 2 of e.g., Other International the Decision) Commitments (e.g. Montreal Protocol, CITES, etc) 12 3 4 5 6 7 1 Prohibition to CP 2903 77 100 0 CFCl3 (CFC-11) Trichlorofluoromethane Article XX(h) GATT Board of Eurasian Economic Import/export of these ozone destroying import/export ozone CP-X Commission substances from/to the customs territory of the destroying substances 2903 77 200 0 CF2Cl2 (CFC-12) Dichlorodifluoromethane Article 46 of the EAEU Treaty DECISION on August 16, 2012 N Eurasian Economic Union is permitted only in (excluding goods in dated 29 may 2014 and paragraphs 134 the following cases: transit) (all EAEU 2903 77 300 0 C2F3Cl3 (CFC-113) 1,1,2- 4 and 37 of the Protocol on non- On legal acts in the field of non- _to be used solely as a raw material for the countries) Trichlorotrifluoroethane tariff regulation measures against tariff regulation (as last amended at 2 production of other chemicals; third countries Annex No. 7 to the June 2016) EAEU of 29 May 2014 Annex 1 to the Decision N 134 dated 16 August 2012 Unit list of goods subject to prohibitions or restrictions on import or export by countries- members of the -

Globalna Strategija Ohranjanja Rastlinskih
GLOBALNA STRATEGIJA OHRANJANJA RASTLINSKIH VRST (TOČKA 8) UNIVERSITY BOTANIC GARDENS LJUBLJANA AND GSPC TARGET 8 HORTUS BOTANICUS UNIVERSITATIS LABACENSIS, SLOVENIA INDEX SEMINUM ANNO 2017 COLLECTORUM GLOBALNA STRATEGIJA OHRANJANJA RASTLINSKIH VRST (TOČKA 8) UNIVERSITY BOTANIC GARDENS LJUBLJANA AND GSPC TARGET 8 Recenzenti / Reviewers: Dr. sc. Sanja Kovačić, stručna savjetnica Botanički vrt Biološkog odsjeka Prirodoslovno-matematički fakultet, Sveučilište u Zagrebu muz. svet./ museum councilor/ dr. Nada Praprotnik Naslovnica / Front cover: Semeska banka / Seed bank Foto / Photo: J. Bavcon Foto / Photo: Jože Bavcon, Blanka Ravnjak Urednika / Editors: Jože Bavcon, Blanka Ravnjak Tehnični urednik / Tehnical editor: D. Bavcon Prevod / Translation: GRENS-TIM d.o.o. Elektronska izdaja / E-version Leto izdaje / Year of publication: 2018 Kraj izdaje / Place of publication: Ljubljana Izdal / Published by: Botanični vrt, Oddelek za biologijo, Biotehniška fakulteta UL Ižanska cesta 15, SI-1000 Ljubljana, Slovenija tel.: +386(0) 1 427-12-80, www.botanicni-vrt.si, [email protected] Zanj: znan. svet. dr. Jože Bavcon Botanični vrt je del mreže raziskovalnih infrastrukturnih centrov © Botanični vrt Univerze v Ljubljani / University Botanic Gardens Ljubljana ----------------------------------- Kataložni zapis o publikaciji (CIP) pripravili v Narodni in univerzitetni knjižnici v Ljubljani COBISS.SI-ID=297076224 ISBN 978-961-6822-51-0 (pdf) ----------------------------------- 1 Kazalo / Index Globalna strategija ohranjanja rastlinskih vrst (točka 8) -

<I>Carthamus Tinctorius</I>
Promoting the conservation and use of underutilized and neglected crops. 7. SafflowerSafflower Carthamus tinctorius L. Li Dajue and Hans-Henning Mündel netic t Ge Res lan ou P rc al e n s o I ti n a s t n i r t u e t t e n I IPGRI 2 Safflower. Carthamus tinctorius L. The International Plant Genetic Resources Institute (IPGRI) is an autonomous inter- national scientific organization operating under the aegis of the Consultative Group on International Agricultural Research (CGIAR). The international status of IPGRI is conferred under an Establishment Agreement which, by December 1995, had been signed by the Governments of Australia, Belgium, Benin, Bolivia, Burkina Faso, Cameroon, China, Chile, Congo, Costa Rica, Côte d’Ivoire, Cyprus, Czech Republic, Denmark, Ecuador, Egypt, Greece, Guinea, Hungary, India, Iran, Israel, Italy, Jordan, Kenya, Mauritania, Morocco, Pakistan, Panama, Peru, Poland, Portugal, Romania, Russia, Senegal, Slovak Republic, Sudan, Switzerland, Syria, Tunisia, Turkey, Ukraine and Uganda. IPGRI’s mandate is to advance the conservation and use of plant genetic resources for the benefit of present and future generations. IPGRI works in partner- ship with other organizations, undertaking research, training and the provision of scientific and technical advice and information, and has a particularly strong programme link with the Food and Agriculture Organization of the United Nations. Financial support for the agreed research agenda of IPGRI is provided by the Gov- ernments of Australia, Austria, Belgium, Canada, China, Denmark, France, Ger- many, India, Italy, Japan, the Republic of Korea, Mexico, the Netherlands, Norway, Spain, Sweden, Switzerland, the UK and the USA, and by the Asian Development Bank, IDRC, UNDP and the World Bank. -

Conserving Europe's Threatened Plants
Conserving Europe’s threatened plants Progress towards Target 8 of the Global Strategy for Plant Conservation Conserving Europe’s threatened plants Progress towards Target 8 of the Global Strategy for Plant Conservation By Suzanne Sharrock and Meirion Jones May 2009 Recommended citation: Sharrock, S. and Jones, M., 2009. Conserving Europe’s threatened plants: Progress towards Target 8 of the Global Strategy for Plant Conservation Botanic Gardens Conservation International, Richmond, UK ISBN 978-1-905164-30-1 Published by Botanic Gardens Conservation International Descanso House, 199 Kew Road, Richmond, Surrey, TW9 3BW, UK Design: John Morgan, [email protected] Acknowledgements The work of establishing a consolidated list of threatened Photo credits European plants was first initiated by Hugh Synge who developed the original database on which this report is based. All images are credited to BGCI with the exceptions of: We are most grateful to Hugh for providing this database to page 5, Nikos Krigas; page 8. Christophe Libert; page 10, BGCI and advising on further development of the list. The Pawel Kos; page 12 (upper), Nikos Krigas; page 14: James exacting task of inputting data from national Red Lists was Hitchmough; page 16 (lower), Jože Bavcon; page 17 (upper), carried out by Chris Cockel and without his dedicated work, the Nkos Krigas; page 20 (upper), Anca Sarbu; page 21, Nikos list would not have been completed. Thank you for your efforts Krigas; page 22 (upper) Simon Williams; page 22 (lower), RBG Chris. We are grateful to all the members of the European Kew; page 23 (upper), Jo Packet; page 23 (lower), Sandrine Botanic Gardens Consortium and other colleagues from Europe Godefroid; page 24 (upper) Jože Bavcon; page 24 (lower), Frank who provided essential advice, guidance and supplementary Scumacher; page 25 (upper) Michael Burkart; page 25, (lower) information on the species included in the database. -

Quality Assessment of Rhaponticum Carthamoides (Willd.) Iljin As
Timofeev N.P., Lapin A.A., Zelenkov V.N. Quality Assessment of Rhaponticum carthamoides (Willd.) Iljin as Medicinal Raw Material by the Bromic Antioxidant Capacity Estimation // Journal Chemistry and Computational Simulation: Butlerov Communications, 2006, 8(2): 35-40. QUALITY ASSESSMENT OF RHAPONTICUM CARTHAMOIDES (WILLD.) ILJIN AS MEDICINAL RAW MATERIAL BY THE BROMIC ANTIOXIDANT CAPACITY ESTIMATION N.P. Timofeev1, A.A. Lapin2, V.N. Zelenkov3 1 Collective farm BIO, 165650, Russia, Koryazhma; e-mail: [email protected] 2 Arbuzov’s Institute of organic and physical chemistry, KazSC of the Russian Academy of Sci- ence, Kazan; 3 Russian academy of natural sciences, Moscow ABSCTRACT The possibility of an express assessment of quality medicinal raw materials Rhaponticum carthamoides (Willd.) Iljin is investigated, at various stages of harvesting and storage by method Bromic Antioxidant Capacity Estimation (BACE), after extraction of sample in an aqueous solu- tion. Revealed that phytoecdysteroids R. carthamoides extracted in aqueous solution at level of ethanol, have the temperature resistance. Among the investigated 17 species of industrial medici- nal plants value R. carthamoides has the greatest value BACE, exceeding values of other species from 2-3 up to 5-12 times. Change BACE of leaf organs during the growing season was correlated with the dynamics of the concentration ecdysteroid 20-hydroxyecdysone, as defined by method of the reversed-phase highly effective liquid chromatography (RP-HPLC). Higher values for both indicators were also true for the early phases of vegetation. Established a connection between the loss of active sub- stances and reduction value BACE during storage. On the safety of 20-hydroxyecdysone and the value BACE strongly influenced by the pres- ence of impurities in raw materials, infected microflora. -

COST EFFECTIVE PRODUCTION of SPECIALTY CUT FLOWERS By
COST EFFECTIVE PRODUCTION OF SPECIALTY CUT FLOWERS By TODD JASON CAVINS Bachelor of Science Southwestern Oklahoma State University Weatherford, Oklahoma 1997 Submitted to the Faculty of the Graduate College of the Oklahoma State University in partial fulfillment of the requirements for the Degree of MASTER OF SCIENCE December, 1999 COST EFFECTIVE PRODUCTION OF SPECIALTY CUT FLOWERS Thesis Approved: ' 1 Thesis Advisor .. ;.; ,, ( Dean of the Graduate College 11 ACKNOWLEDGEMENTS The purpose of this study was to improve production methods of various specialty cut flower species. Improving production methods allows growers to reduce cost, improve plant quality and earn higher profits. This study involved three research areas of specialty cut flowers. Partial funding was provided by a S.A.R.E. grant and Bear Creek Farm, Stillwater, OK. I would like to thank my principle advisor Dr. John Dole for his encouragement, support, honesty and perseverance. I would like to thank Dr. Janet Cole and Dr. Jim Ownby for serving on my thesis committee. Dr. Cole offered valuable insight and direction towards the research. Dr. Ownby contributed with his wealth of knowledge in plant physiology. A special thanks goes to Vicki Stamback and the gang at Bear Creek Farm. Vicki's experience as a specialty cut flower grower allowed me to gain personal knowledge of the cut flower industry that would not have taken place without her. Vicki's efforts and cooperation greatly improved this study. I want to thank Randall Smith and Leah Aufill for their assistance and plant care. Tim Hooper also contributed by offering his experiences from the floriculture industry and providing stress relieving lunch breaks. -

2017-02-CV-Oriane Hidalgo
CURRICULUM VITAE – ORIANE HIDALGO Research line: The connecting thread of my research is to uncover patterns and processes of genome evolution responsible for plant diversification, through an integrated approach including evolutionary-developmental biology, phylogenetics and cytogenetics. I am particularly interested in studying the origin and diversification of plant reproductive morphologies across angiosperms from the evo-devo and genomic perspectives. My research concentrates on the changes in floral symmetry and inflorescence complexity in Papaveraceae and the Asteraceae representatives displaying secondary heads (=syncephalia). My other main research line focuses on the evolutionary significance of the extraordinary diversity of plant genomes (i.e. size, organisation, composition and dynamics), covering a wide array of plant groups including angiosperms, gymnosperms and pteridophytes. PERSONAL INFORMATION Date of birth: 08/02/1976 Nationality: French Languages: English (fluent), French (mother tongue), Spanish (fluent), Catalan (good understanding, elementary spoken) Address: Royal Botanic Gardens, Kew, Richmond, Surrey TW9 3AB, UK E-mail: [email protected] ; [email protected] • CURRENT POSITION 09/2015–Present Marie Sklodowska-Curie Postdoc Fellow Royal Botanic Gardens, Kew, UK • PREVIOUS POSITIONS 09/2013–09/2015 Research Geneticist Royal Botanic Gardens, Kew, UK 05/2011–09/2013 Postdoctoral Researcher Botanical Laboratory, Faculty of Pharmacy, University of Barcelona, Spain 07/2008–04/2011 Postdoctoral Researcher Department -

Pdf 910.98 K
10 Egypt. J. Bot. Vol. 59, No.1, pp. 107 - 138 (2019) Computer-generated Keys to the Flora of Egypt. 9. The Spiny Taxa of Asteraceae Adel El-Gazzar(1)#, Nahed El-Husseini(2), Azza A. Khafagi(3), Nashua A.M. Mostafa(1) (1)Department of Botany and Microbiology, Faculty of Science, El-Arish University, N. Sinai, Egypt; (2)The Herbarium, Botany Department, Faculty of Science, Cairo University, Giza, Egypt; (3)Botany Department, Faculty of Science, Al-Azhar University (Girls Branch), Cairo, Egypt. ANUALLY constructed keys for identification of plants leave much to be desired. Keys Mto the Asteraceae of Egypt are no exception and depend largely on floral minutiae while vegetative morphology is a much richer source of characters suitable for key construction. Inspection of some 3000 specimens showed that the most obvious feature of the plants is the presence or absence of spines on leaves, leaf axils, stem internodes, margins of stem wings and phyllaries. This feature was selected to divide species of this family into two main groups: spiny and spineless. Nomenclature of all taxa was updated and those with names reduced to synonyms of others were eliminated. This article deals only with the 65 species belonging to 20 genera of the first group. A total of 51 characters describing variation in spine distribution and other characters of vegetative morphology were recorded for each of the 65 spiny species and the key-generating program DELTA was applied to the data matrix. The result is a much improved automated key, a detailed description of every species in terms of the entire set of 51 characters, and the same description but in terms of the serial numbers assigned to these characters and their states. -

Nuclear and Plastid DNA Phylogeny of the Tribe Cardueae (Compositae
1 Nuclear and plastid DNA phylogeny of the tribe Cardueae 2 (Compositae) with Hyb-Seq data: A new subtribal classification and a 3 temporal framework for the origin of the tribe and the subtribes 4 5 Sonia Herrando-Morairaa,*, Juan Antonio Callejab, Mercè Galbany-Casalsb, Núria Garcia-Jacasa, Jian- 6 Quan Liuc, Javier López-Alvaradob, Jordi López-Pujola, Jennifer R. Mandeld, Noemí Montes-Morenoa, 7 Cristina Roquetb,e, Llorenç Sáezb, Alexander Sennikovf, Alfonso Susannaa, Roser Vilatersanaa 8 9 a Botanic Institute of Barcelona (IBB, CSIC-ICUB), Pg. del Migdia, s.n., 08038 Barcelona, Spain 10 b Systematics and Evolution of Vascular Plants (UAB) – Associated Unit to CSIC, Departament de 11 Biologia Animal, Biologia Vegetal i Ecologia, Facultat de Biociències, Universitat Autònoma de 12 Barcelona, ES-08193 Bellaterra, Spain 13 c Key Laboratory for Bio-Resources and Eco-Environment, College of Life Sciences, Sichuan University, 14 Chengdu, China 15 d Department of Biological Sciences, University of Memphis, Memphis, TN 38152, USA 16 e Univ. Grenoble Alpes, Univ. Savoie Mont Blanc, CNRS, LECA (Laboratoire d’Ecologie Alpine), FR- 17 38000 Grenoble, France 18 f Botanical Museum, Finnish Museum of Natural History, PO Box 7, FI-00014 University of Helsinki, 19 Finland; and Herbarium, Komarov Botanical Institute of Russian Academy of Sciences, Prof. Popov str. 20 2, 197376 St. Petersburg, Russia 21 22 *Corresponding author at: Botanic Institute of Barcelona (IBB, CSIC-ICUB), Pg. del Migdia, s. n., ES- 23 08038 Barcelona, Spain. E-mail address: [email protected] (S. Herrando-Moraira). 24 25 Abstract 26 Classification of the tribe Cardueae in natural subtribes has always been a challenge due to the lack of 27 support of some critical branches in previous phylogenies based on traditional Sanger markers. -

Draft Hanford Injury Assessment Plan Appendices
Public Review Draft Hanford Natural Resource Injury Assessment Plan APPENDIX A | THE FOUR HANFORD NPL SITES On November 3, 1989, Hanford was added to the NPL as four separate sites: the 100 Area, 200 Area, 300 Area, and 1100 Area (see Exhibits B-1 through B-4, below).78 In order to coordinate response actions, each of these sites was further subdivided into operable units (OUs), based on geographic area or common waste sources. A total of 1,200 waste management units have been identified throughout the Hanford Site and are grouped among the four NPL sites (DOE 2006a). Cleanup efforts for the remaining Hanford Site contamination are organized into three major components: the River Corridor (including the 100 and 300 Areas), the Central Plateau (primarily the 200 Area), and tank waste. Cleanup of the Site is a particularly large and complex effort, dependent on many dozens of individual decision steps, stakeholder coordination, sustained funding, and the ability to address complex technical challenges. Full remediation of the NPL sites is expected to extend over the next 40 to 50 years; however, timelines are difficult to determine, due to the factors discussed above (DOE 2012). Additional summary information describing the four Hanford NPL sites and the current status of remediation efforts is provided below. More detailed information can be found at http://www.hanford.gov/. AREA 100 AREA DESCRIPTIONS The 100 Area contains the remnants of Hanford’s nine nuclear reactors, spread over six reactor sites (B/C, K, N, D, H, and F). The footprint covers about 26 sq. mi.