Bulletin2010 03 Pagecouverture
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-
Cuivre Bryophytes
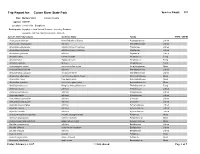
Trip Report for: Cuivre River State Park Species Count: 335 Date: Multiple Visits Lincoln County Agency: MODNR Location: Lincoln Hills - Bryophytes Participants: Bryophytes from Natural Resource Inventory Database Bryophyte List from NRIDS and Bruce Schuette Species Name (Synonym) Common Name Family COFC COFW Acarospora unknown Identified only to Genus Acarosporaceae Lichen Acrocordia megalospora a lichen Monoblastiaceae Lichen Amandinea dakotensis a button lichen (crustose) Physiaceae Lichen Amandinea polyspora a button lichen (crustose) Physiaceae Lichen Amandinea punctata a lichen Physiaceae Lichen Amanita citrina Citron Amanita Amanitaceae Fungi Amanita fulva Tawny Gresette Amanitaceae Fungi Amanita vaginata Grisette Amanitaceae Fungi Amblystegium varium common willow moss Amblystegiaceae Moss Anisomeridium biforme a lichen Monoblastiaceae Lichen Anisomeridium polypori a crustose lichen Monoblastiaceae Lichen Anomodon attenuatus common tree apron moss Anomodontaceae Moss Anomodon minor tree apron moss Anomodontaceae Moss Anomodon rostratus velvet tree apron moss Anomodontaceae Moss Armillaria tabescens Ringless Honey Mushroom Tricholomataceae Fungi Arthonia caesia a lichen Arthoniaceae Lichen Arthonia punctiformis a lichen Arthoniaceae Lichen Arthonia rubella a lichen Arthoniaceae Lichen Arthothelium spectabile a lichen Uncertain Lichen Arthothelium taediosum a lichen Uncertain Lichen Aspicilia caesiocinerea a lichen Hymeneliaceae Lichen Aspicilia cinerea a lichen Hymeneliaceae Lichen Aspicilia contorta a lichen Hymeneliaceae Lichen -

Influence of Tree Species on Richness and Diversity of Epigeous Fungal
View metadata, citation and similar papers at core.ac.uk brought to you by CORE provided by Archive Ouverte en Sciences de l'Information et de la Communication fungal ecology 4 (2011) 22e31 available at www.sciencedirect.com journal homepage: www.elsevier.com/locate/funeco Influence of tree species on richness and diversity of epigeous fungal communities in a French temperate forest stand Marc BUE´Ea,*, Jean-Paul MAURICEb, Bernd ZELLERc, Sitraka ANDRIANARISOAc, Jacques RANGERc,Re´gis COURTECUISSEd, Benoıˆt MARC¸AISa, Franc¸ois LE TACONa aINRA Nancy, UMR INRA/UHP 1136 Interactions Arbres/Microorganismes, 54280 Champenoux, France bGroupe Mycologique Vosgien, 18 bis, place des Cordeliers, 88300 Neufchaˆteau, France cINRA Nancy, UR 1138 Bioge´ochimie des Ecosyste`mes Forestiers, 54280 Champenoux, France dUniversite´ de Lille, Faculte´ de Pharmacie, F59006 Lille, France article info abstract Article history: Epigeous saprotrophic and ectomycorrhizal (ECM) fungal sporocarps were assessed during Received 30 September 2009 7 yr in a French temperate experimental forest site with six 30-year-old mono-specific Revision received 10 May 2010 plantations (four coniferous and two hardwood plantations) and one 150-year-old native Accepted 21 July 2010 mixed deciduous forest. A total of 331 fungal species were identified. Half of the fungal Available online 6 October 2010 species were ECM, but this proportion varied slightly by forest composition. The replace- Corresponding editor: Anne Pringle ment of the native forest by mono-specific plantations, including native species such as beech and oak, considerably altered the diversity of epigeous ECM and saprotrophic fungi. Keywords: Among the six mono-specific stands, fungal diversity was the highest in Nordmann fir and Conifer plantation Norway spruce plantations and the lowest in Corsican pine and Douglas fir plantations. -

Russulas of Southern Vancouver Island Coastal Forests
Russulas of Southern Vancouver Island Coastal Forests Volume 1 by Christine Roberts B.Sc. University of Lancaster, 1991 M.S. Oregon State University, 1994 A Dissertation Submitted in Partial Fulfillment of the Requirements for the Degree of DOCTOR OF PHILOSOPHY in the Department of Biology © Christine Roberts 2007 University of Victoria All rights reserved. This dissertation may not be reproduced in whole or in part, by photocopying or other means, without the permission of the author. Library and Bibliotheque et 1*1 Archives Canada Archives Canada Published Heritage Direction du Branch Patrimoine de I'edition 395 Wellington Street 395, rue Wellington Ottawa ON K1A0N4 Ottawa ON K1A0N4 Canada Canada Your file Votre reference ISBN: 978-0-494-47323-8 Our file Notre reference ISBN: 978-0-494-47323-8 NOTICE: AVIS: The author has granted a non L'auteur a accorde une licence non exclusive exclusive license allowing Library permettant a la Bibliotheque et Archives and Archives Canada to reproduce, Canada de reproduire, publier, archiver, publish, archive, preserve, conserve, sauvegarder, conserver, transmettre au public communicate to the public by par telecommunication ou par Plntemet, prefer, telecommunication or on the Internet, distribuer et vendre des theses partout dans loan, distribute and sell theses le monde, a des fins commerciales ou autres, worldwide, for commercial or non sur support microforme, papier, electronique commercial purposes, in microform, et/ou autres formats. paper, electronic and/or any other formats. The author retains copyright L'auteur conserve la propriete du droit d'auteur ownership and moral rights in et des droits moraux qui protege cette these. -

Pipestem Foray Overview
Volume 49:1 January ⁄ February 2008 www.namyco.org Pipestem Foray Overview An East-Coaster’s Perspective A West-Coaster’s Perspective by Dave Wasilewski by Debbie Viess For about 25 years now I have As Steve Trudell rightly pointed out hunted and studied wild mush- to me, don’t gloat about your mush- rooms, but I’ve never been active in rooms until they are safely in your a club. The NAMA Orson K. Miller basket! The continuing “Curse of Memorial Foray held in Pipestem, NAMA” (some call it global warm- WV, this past August was the first ing) slipped in the back door, behind such event that I have ever at- the earlier and heartening West tended. Virginia thunderstorms. Extreme I must admit that, as I drove heat and lack of rain for the previ- south on Interstate 81 through two ous couple of weeks made condi- solid hours of Pennsylvania rainfall tions on the ground challenging for on an eight-hour trip to a place hopeful finders of fungi. Chlorosplenium aeruginascens, one of where little or no rain had fallen for Luckily, my Southern Belle the many delights found at Pipestem. over a week, for the purpose of hostess with the mostest, Coleman hunting wild mushrooms, I felt a bit McCleneghan, took me on a few names like Gyroporus and Pulvero- conflicted. My mind wandered pre-NAMA forays in Virginia, where boletus, tucked among the through conifer groves in the conditions were much improved. My many shades of forest green and Poconos where imaginary boletes very first walk ever along the brown. -

Patterns of Interaction Specificity of Fungus-Growing
BMC Evolutionary Biology BioMed Central Research article Open Access Patterns of interaction specificity of fungus-growing termites and Termitomyces symbionts in South Africa Duur K Aanen*1,2, Vera ID Ros1,2,6, Henrik H de Fine Licht2, Jannette Mitchell3, Z Wilhelm de Beer4, Bernard Slippers4, Corinne Rouland- LeFèvre5 and Jacobus J Boomsma2 Address: 1Laboratory of Genetics, Plant Sciences Group, Wageningen University and Research Center, Arboretumlaan 4, 6703 BD Wageningen, The Netherlands, 2Department of Population Biology, Institute of Biology, University of Copenhagen, Universitetsparken 15, 2100 Copenhagen, Denmark, 3Agricultural Research Council-Plant Protection Research Institute, Rietondale Research Station, Private Bag X134, Queenswood, Pretoria 0121, South Africa, 4Forestry and Agricultural Biotechnology Institute (FABI), Faculty of Agricultural and Biological Sciences, Department of Microbiology and Plant Pathology, University of Pretoria, Pretoria, South Africa, 5UMR-IRD 137 Biosol Laboratory of Tropical Soils Ecology (LEST) – Centre IRD d'Ile de France, 32 avenue Henri Varagnat 93 143 – Bondy Cedex, France and 6Evolutionary Biology, Institutefor Biodiversity and Ecosystem Dynamics, University of Amsterdam, P.O. Box 94062, 1090 GB Amsterdam, The Netherlands Email: Duur K Aanen* - [email protected]; Vera ID Ros - [email protected]; Henrik H de Fine Licht - [email protected]; Jannette Mitchell - [email protected]; Z Wilhelm de Beer - [email protected]; Bernard Slippers - [email protected]; Corinne Rouland-LeFèvre - [email protected]; Jacobus J Boomsma - [email protected] * Corresponding author Published: 13 July 2007 Received: 30 March 2007 Accepted: 13 July 2007 BMC Evolutionary Biology 2007, 7:115 doi:10.1186/1471-2148-7-115 This article is available from: http://www.biomedcentral.com/1471-2148/7/115 © 2007 Aanen et al; licensee BioMed Central Ltd. -

! a Revised Generic Classification for The
A REVISED GENERIC CLASSIFICATION FOR THE RHODOCYBE-CLITOPILUS CLADE (ENTOLOMATACEAE, AGARICALES) INCLUDING THE DESCRIPTION OF A NEW GENUS, CLITOCELLA GEN. NOV. by Kerri L. Kluting A Thesis Submitted in Partial Fulfillment of the Requirements for the Degree of Master of Science in Biology Middle Tennessee State University 2013 Thesis Committee: Dr. Sarah E. Bergemann, Chair Dr. Timothy J. Baroni Dr. Andrew V.Z. Brower Dr. Christopher R. Herlihy ! ACKNOWLEDGEMENTS I would like to first express my appreciation and gratitude to my major advisor, Dr. Sarah Bergemann, for inspiring me to push my limits and to think critically. This thesis would not have been possible without her guidance and generosity. Additionally, this thesis would have been impossible without the contributions of Dr. Tim Baroni. I would like to thank Dr. Baroni for providing critical feedback as an external thesis committee member and access to most of the collections used in this study, many of which are his personal collections. I want to thank all of my thesis committee members for thoughtfully reviewing my written proposal and thesis: Dr. Sarah Bergemann, thesis Chair, Dr. Tim Baroni, Dr. Andy Brower, and Dr. Chris Herlihy. I am also grateful to Dr. Katriina Bendiksen, Head Engineer, and Dr. Karl-Henrik Larsson, Curator, from the Botanical Garden and Museum at the University of Oslo (OSLO) and to Dr. Bryn Dentinger, Head of Mycology, and Dr. Elizabeth Woodgyer, Head of Collections Management Unit, at the Royal Botanical Gardens (KEW) for preparing herbarium loans of collections used in this study. I want to thank Dr. David Largent, Mr. -

Avaliação Do Potencial Nutricional, Antioxidante E Antibacteriano De Cogumelos Comestíveis
UNIVERSIDADE FEDERAL DO PARANÁ FABIANE BACH AVALIAÇÃO DO POTENCIAL NUTRICIONAL, ANTIOXIDANTE E ANTIBACTERIANO DE COGUMELOS COMESTÍVEIS CURITIBA 2017 FABIANE BACH AVALIAÇÃO DO POTENCIAL NUTRICIONAL, ANTIOXIDANTE E ANTIBACTERIANO DE COGUMELOS COMESTÍVEIS Tese de Doutorado apresentada como requisito parcial à obtenção do grau de Doutora em Engenharia de Alimentos ao Programa de Pós- Graduação em Engenharia de Alimentos, Departamento de Engenharia Química, Setor de Tecnologia, Universidade Federal do Paraná. Orientador: Prof. Dr. Charles Windson Isidoro Haminiuk Co-orientadora: Drª. Cristiane Vieira Helm CURITIBA 2017 B118a Bach, Fabiane Avaliação do potencial nutricional, antioxidante e antibacteriano de cogumelos comestíveis / Fabiane Bach. – Curitiba, 2017. 135 f. : il. color. ; 30 cm. Tese - Universidade Federal do Paraná, Setor de Tecnologia, Programa de Pós- Graduação em Engenharia de Alimentos, 2017. Orientador: Charles Windson Isidoro Haminiuk. Coorientadora: Cristiane Vieira Helm. 1. Cromatografia líquida de ultra-eficiência. 2. Compostos fenólicos totais. 3. Perfil de aminoácidos. I. Universidade Federal do Paraná. II. Haminiuk, Charles Windson Isidoro. III. Helm, Cristiane Vieira. IV. Título. CDD: 613.2 Dedico este trabalho àqueles que tudo fizeram Para que eu me tornasse quem sou, E para que chegasse onde estou: Flavio, Tere, Felipe e Rudi! Agradecimentos Agradeço a Deus, por estar sempre presente e me permitir vida e saúde para a realização desse trabalho. Ao meu pai Flavio, meu herói, que todos os dias dá o exemplo de como ser o melhor ser humano que existe nesse mundo! À minha mãe, Teresinha, uma guerreira, meu exemplo de força e superação! Ao meu irmão, Felipe, por me orgulhar de suas conquistas e ser tão dedicado em tudo o que faz! Ao meu noivo, Rudimar, por todo o apoio, amor, amizade, conselhos, compreensão... -

Morphological and Molecular Evidence for a New Species of Rhodotus from Tropical and Subtropical Yunnan, China
Mycol Progress DOI 10.1007/s11557-013-0890-x ORIGINAL ARTICLE Morphological and molecular evidence for a new species of Rhodotus from tropical and subtropical Yunnan, China Li-Ping Tang & Yan-Jia Hao & Qing Cai & Bau Tolgor & Zhu L. Yang Received: 4 December 2012 /Revised: 16 January 2013 /Accepted: 18 January 2013 # German Mycological Society and Springer-Verlag Berlin Heidelberg 2013 Abstract Rhodotus has been regarded as a monotypic ge- Keywords Geographic distribution . New taxon . nus, consisting of only one species, R. palmatus, for a long Physalacriaceae . Species diversity . Taxonomy time. Morphological and phylogenetic studies were carried out on collections of Rhodotus from temperate, subtropical and tropical China. Our phylogenetic analysis of DNA sequences of three loci (the internal transcribed spacer, the Introduction large subunit nuclear ribosomal RNA, and the translation elongation factor-1 alpha) revealed that there are two phy- The genus Rhodotus wasproposedbyMaire(1926)to logenetic species in the northern hemisphere, which is in accommodate Agaricus palmatus Bull. The systematic po- concordance with morphological traits, supporting the divi- sition of Rhodotus remained unclear until molecular phylo- sion of Rhodotus into two distinct species. Rhodotus aspe- genetic studies support it being a representative of the rior is described as a new species that differs phenotypically family Physalacriaceae (Moncalvo et al. 2002; Binder et from R. palmatus in its broadly ellipsoid to subglobose, al. 2006). This genus has since been regarded as monotypic more roughened basidiospores, longer cheilocystidia with with only the type species, R. palmatus (Bull.) Maire, orig- slightly thickened wall, and its occurrence in tropical and inally described from Europe (Bulliard 1785; Maire 1926), subtropical environments. -

Angiocarpous Representatives of the Russulaceae in Tropical South East Asia
Persoonia 32, 2014: 13–24 www.ingentaconnect.com/content/nhn/pimj RESEARCH ARTICLE http://dx.doi.org/10.3767/003158514X679119 Tales of the unexpected: angiocarpous representatives of the Russulaceae in tropical South East Asia A. Verbeken1, D. Stubbe1,2, K. van de Putte1, U. Eberhardt³, J. Nuytinck1,4 Key words Abstract Six new sequestrate Lactarius species are described from tropical forests in South East Asia. Extensive macro- and microscopical descriptions and illustrations of the main anatomical features are provided. Similarities Arcangeliella with other sequestrate Russulales and their phylogenetic relationships are discussed. The placement of the species gasteroid fungi within Lactarius and its subgenera is confirmed by a molecular phylogeny based on ITS, LSU and rpb2 markers. hypogeous fungi A species key of the new taxa, including five other known angiocarpous species from South East Asia reported to Lactarius exude milk, is given. The diversity of angiocarpous fungi in tropical areas is considered underestimated and driving Martellia evolutionary forces towards gasteromycetization are probably more diverse than generally assumed. The discovery morphology of a large diversity of angiocarpous milkcaps on a rather local tropical scale was unexpected, and especially the phylogeny fact that in Sri Lanka more angiocarpous than agaricoid Lactarius species are known now. Zelleromyces Article info Received: 2 February 2013; Accepted: 18 June 2013; Published: 20 January 2014. INTRODUCTION sulales species (Gymnomyces lactifer B.C. Zhang & Y.N. Yu and Martellia ramispina B.C. Zhang & Y.N. Yu) and Tao et al. Sequestrate and angiocarpous basidiomata have developed in (1993) described Martellia nanjingensis B. Liu & K. Tao and several groups of Agaricomycetes. -

News Sheet N 29: Spring 2015
Herefordshire Fungus Survey Group o News Sheet N 29: Spring 2015 Tricholomopsis rutilans - Moreton Wood (17/9/14) Contents Recorder’s Report, September - December 2013 Page 3 The Geastrum Saga Page 9 Hidden Fungi on Mosses and Liverworts (Bryophilous Fungi) Page 10 Rimbachia neckerae: a Rare Moss Fungus Page 10 Onygena equina on the Black Hill Page 11 Focus stacking as an Aid to Fungus Photography Page 12 Rich Pickings from the Hedgerow Page 14 Notes from a Novice Page 17 Some Conifer Species to Die for Page 18 Fungal Fragments Page 20 The contents of this newsletter are the copyright property of the Herefordshire Fungus Survey Group. Please do not reproduce material from this publication without prior permission from the Editor. Thank you. A new member of our Group, Michael Valentine, who President: Ted Blackwell lives in Lancashire and is a member of the North West Recorder: Jo Weightman Fungus Group, tells us how to use "Focus Stacking" to produce exceptional images of fungi - a subject very near Chairman: Roger Evans to my own heart! I am green with envy at the results he achieves and know that many other photographers will Secretary: Mike Stroud read this article with great interest. Treasurer: Charles Hunter Our intrepid 'Ruster', Debbie Evans, has been poking Technical Officer: Steve Rolph about in hedgerows (p14) and come up with a plethora of rusts that we should all be looking out for, described with her usual passion and enthusiasm. Debbie has also Welcome to the Spring 2015 News Sheet been very much involved with the Welsh Rust Group's "Rust Fungus Red Data List and Census Catalogue for In the last couple of News Sheets I have been bewailing Wales" and has asked me to include the letter printed the fact that there has not been enough material coming below. -

On the Ecology and Evolution of Microorganisms Associated with Fungus-Growing Termites
On the ecology and evolution of microorganisms associated with fungus-growing termites Anna A. Visser Propositions 1 Showing the occurrence of a certain organism in a mutualistic symbiosis does not prove a specific role of this organism for that mutualism, as is illustrated by Actinobacteria species occurring in fungus-growing termite nests. (this thesis) 2 Instead of playing a role as mutualistic symbiont, Pseudoxylaria behaves like a weed, competing for the fungus-comb substrate and forcing termites to do regular gardening lest it overgrows their Termitomyces monoculture. (this thesis) 3 Citing colleagues who are no longer active must be considered as an act of true altruism. 4 The overload of literature on recent ‘discoveries’ blinds us from old literature, causing researchers to neglect what was already known and possibly duplicate investigations. 5 Keys to evolution of knowledge lie in recognizing the truth of one’s intuition, and extending the limits of one’s imagination. 6 The presumed creative superiority of left-handed people (Newland 1981), said to be the result of more communication between both sides of the brain, might rather be the result of lifelong selection on finding creative solutions to survive in a right-hand biased environment. 7 An understanding of ‘why good ideas usually come by the time time is running out and how to manage this’, would greatly improve people’s intellectual output and the condition in which they perform. Propositions accompanying the thesis “On the ecology and evolution of microorganisms associated with fungus-growing termites” Anna A. Visser Wageningen, 15th June 2011 Reference Newland GA, 1981. -

Studies on North-West Himalayan Russulaceae
Biological Forum – An International Journal 13(2): 138-164(2021) ISSN No. (Print): 0975-1130 ISSN No. (Online): 2249-3239 Studies on North-West Himalayan Russulaceae Shilpa Sood1*, Reeti Singh2 and Ramesh Chandra Upadhyay3 1Department of Botany, MCM DAV College Kangra, (Himachal Pradesh)-176001, India. 2Department of Plant Pathology, College of Agriculture, RVSK Vishwa Vidyalaya, Gwalior, (Madhya Pradesh)-474002, India. 3ICAR-Directorate of Mushroom Research, Solan, (Himachal Pradesh)-173213, India. (Corresponding author: Shilpa Sood*) (Received 22 March 2021, Accepted 05 June, 2021) (Published by Research Trend, Website: www.researchtrend.net) ABSTRACT: North Western Himalayan forests are rich in macrofungal diversity, especially in ectomycorrhizal (ECM) fungi. In 2014 and 2015, a number of explorations were undertaken during rainy season to explore the ECM diversity. The morpho-taxonomy of thirteen samples of Russulaceae were briefly discussed. Four samples of Lactarius and nine samples of Russula were described morphologically and illustrated taxonomically. Detailed study on the spore morphology of the specimens was carried out using staining techniques and Scanning Electron Microscopy (SEM). Out of these Lactarius paradoxus, L. subpurpureus, Russula fellea, R. flavida and R. subfoetens have been reported for the first time from Himachal Pradesh. Keywords: Basidiomycetes, macrofungi, Russula, Lactarius, taxonomy. INTRODUCTION and injury, latex colour and latex colour change were described in the field from the fresh specimen. The members of family Russulaceae belongs to All colour notations were according to Kornerup and cosmopolitan group of ectomycorrhizal mushroom that Wanscher, (1978). After recording all the forms a relationship with trees. It comprises around morphological characters, specimens were dried in hot 1900 accepted species (Lebel et al., 2013).