Untersuchungen Zu Schwefelverbindungen Und
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

ISTA List of Stabilized Plant Names 7Th Edition
ISTA List of Stabilized Plant Names th 7 Edition ISTA Nomenclature Committee Chair: Dr. M. Schori Published by All rights reserved. No part of this publication may be The Internation Seed Testing Association (ISTA) reproduced, stored in any retrieval system or transmitted Zürichstr. 50, CH-8303 Bassersdorf, Switzerland in any form or by any means, electronic, mechanical, photocopying, recording or otherwise, without prior ©2020 International Seed Testing Association (ISTA) permission in writing from ISTA. ISBN 978-3-906549-77-4 ISTA List of Stabilized Plant Names 1st Edition 1966 ISTA Nomenclature Committee Chair: Prof P. A. Linehan 2nd Edition 1983 ISTA Nomenclature Committee Chair: Dr. H. Pirson 3rd Edition 1988 ISTA Nomenclature Committee Chair: Dr. W. A. Brandenburg 4th Edition 2001 ISTA Nomenclature Committee Chair: Dr. J. H. Wiersema 5th Edition 2007 ISTA Nomenclature Committee Chair: Dr. J. H. Wiersema 6th Edition 2013 ISTA Nomenclature Committee Chair: Dr. J. H. Wiersema 7th Edition 2019 ISTA Nomenclature Committee Chair: Dr. M. Schori 2 7th Edition ISTA List of Stabilized Plant Names Content Preface .......................................................................................................................................................... 4 Acknowledgements ....................................................................................................................................... 6 Symbols and Abbreviations .......................................................................................................................... -
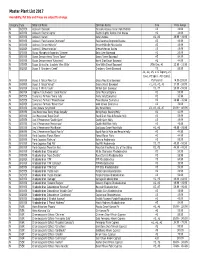
Master Plant List 2017.Xlsx
Master Plant List 2017 Availability, Pot Size and Prices are subject to change. Category Type Botanical Name Common Name Size Price Range N BREVER Azalea X 'Cascade' Cascade Azalea (Glenn Dale Hybrid) #3 49.99 N BREVER Azalea X 'Electric Lights' Electric Lights Double Pink Azalea #2 44.99 N BREVER Azalea X 'Karen' Karen Azalea #2, #3 39.99 - 49.99 N BREVER Azalea X 'Poukhanense Improved' Poukhanense Improved Azalea #3 49.99 N BREVER Azalea X 'Renee Michelle' Renee Michelle Pink Azalea #3 49.99 N BREVER Azalea X 'Stewartstonian' Stewartstonian Azalea #3 49.99 N BREVER Buxus Microphylla Japonica "Gregem' Baby Gem Boxwood #2 29.99 N BREVER Buxus Sempervirens 'Green Tower' Green Tower Boxwood #5 64.99 N BREVER Buxus Sempervirens 'Katerberg' North Star Dwarf Boxwood #2 44.99 N BREVER Buxus Sinica Var. Insularis 'Wee Willie' Wee Willie Dwarf Boxwood Little One, #1 13.99 - 21.99 N BREVER Buxus X 'Cranberry Creek' Cranberry Creek Boxwood #3 89.99 #1, #2, #5, #15 Topiary, #5 Cone, #5 Spiral, #10 Spiral, N BREVER Buxus X 'Green Mountain' Green Mountain Boxwood #5 Pyramid 14.99-299.99 N BREVER Buxus X 'Green Velvet' Green Velvet Boxwood #1, #2, #3, #5 17.99 - 59.99 N BREVER Buxus X 'Winter Gem' Winter Gem Boxwood #5, #7 59.99 - 99.99 N BREVER Daphne X Burkwoodii 'Carol Mackie' Carol Mackie Daphne #2 59.99 N BREVER Euonymus Fortunei 'Ivory Jade' Ivory Jade Euonymus #2 35.99 N BREVER Euonymus Fortunei 'Moonshadow' Moonshadow Euonymus #2 29.99 - 35.99 N BREVER Euonymus Fortunei 'Rosemrtwo' Gold Splash Euonymus #2 39.99 N BREVER Ilex Crenata 'Sky Pencil' -

Survey of Wild Food Plants for Human Consumption in Geçitli (Hakkari, Turkey)
Indian Journal of Traditional Knowledge Vol. 14(2), April 2015, pp. 183-190 Survey of wild food plants for human consumption in Geçitli (Hakkari, Turkey) İdris Kaval1, Lütfi Behçet2 & Uğur Çakilcioğlu3* 1Yuzuncu Yıl University, Department of Biology, Van 65000, Turkey; 2Bingöl University, Department of Biology, Bingöl 12000, Turkey; 3Tunceli University, Pertek Sakine Genç Vocational School, Pertek, Tunceli 62500, Turkey E-mails: [email protected]; [email protected]; [email protected] Received 15 July 2014, revised 22 January 2015 This study aims to record accumulation of knowledge on plants which are used as food by native people of Geçitli (Hakkari, Turkey) that has a rich culture and a very natural environment. In addition, the medical uses of these plants were compiled from the literature. Study area was located on the East of Anatolian diagonal, in the Eastern Anatolia region. Field study was carried out over a period of approximately two years (2008-2010). During this period, 84 vascular plant taxa were collected. The plants were pressed in the field and prepared for identification. A total of 84 food plants belonging to 30 families were identified in the region. In the study being conducted, use of wild plants as food points out interest of people in Geçitli in wild plants. The fact that a large proportion of edible plants are also being used for medicinal purposes indicates that the use of wild plants has a high potential in the region. The present study shows that further ethnobotanical investigations are worthy to be carried out in Turkey, where most of knowledge on popular food plants are still to discover. -

Alliums of All Shapes & Sizes’
Tips From Trecanna Trecanna Nursery is a family-run plant nursery owned by Mark & Karen Wash and set on the Cornish slopes of the Tamar Valley, specialising in unusual bulbs & perennials, Crocosmias and other South African plants. Each month Mark will write a feature on some of his very favourite plants. Trecanna Nursery is now open from Wednesday to Saturday throughout the year, from 10am to 5pm, (or phone to arrange a visit at other times). There is a wide range of unusual bulbs, herbaceous plants and hardy South African plants including the largest selection of Crocosmia in the South. We are located approx. 2 miles north of Gunnislake. Follow the brown tourist signs from the A390, Callington to Gunnislake road. Tel: 01822 834680. Email: [email protected] Talks to garden clubs and societies. ‘Alliums Of All Shapes & Sizes’ Last year I covered a number of fabulous Alliums that you plant and enjoy in your garden, however as there are so many excellent varieties to choose from, I have decided to look at some more - particularly as May & June is when the vast majority of them burst into flower. The main displays of spring flowering bulbs, including narcissi and most tulips, are just coming to an end in May. The Alliums fulfil a valuable task, bridging the gap between Spring & Summer before many of our herbaceous plants come into their prime. There are a vast array of wild Alliums in existence coming from areas such as Asia, North America and Europe – in fact the wild species number over 700 and with all the hybrids that have been bred over the years the choice is now literally thousands. -

English Gardens Giant Onion
Giant Onion Allium giganteum Plant Height: 12 inches Flower Height: 4 feet Spread: 12 inches Sunlight: Hardiness Zone: 4a Other Names: Flowering Onion Giant Onion flowers Description: Photo courtesy of NetPS Plant Finder One of the tallest ornamental onions, this selection looks beautiful as an accent in garden beds and in fresh or dried arrangements; large globes of small, purple, star shaped flowers stand above low mounded, fragrant green foliage; low maintenance Ornamental Features Giant Onion features bold balls of lightly-scented purple flowers at the ends of the stems from early to mid summer. The flowers are excellent for cutting. Its sword-like leaves remain green in color throughout the season. The fruit is not ornamentally significant. Landscape Attributes Giant Onion is an open herbaceous perennial with tall flower stalks held atop a low mound of foliage. Its relatively coarse texture can be used to stand it apart from other garden plants with finer foliage. Giant Onion in bloom This is a relatively low maintenance plant, and should Photo courtesy of NetPS Plant Finder only be pruned after flowering to avoid removing any of the current season's flowers. It is a good choice for attracting butterflies to your yard, but is not particularly attractive to deer who tend to leave it alone in favor of tastier treats. It has no significant negative characteristics. Giant Onion is recommended for the following landscape applications; - Vertical Accent - General Garden Use Planting & Growing Giant Onion will grow to be about 12 inches tall at maturity extending to 4 feet tall with the flowers, with a spread of 12 inches. -

Synthesis of Cysteine Sulfoxides and Related Compounds Occurring in Wild Onions
Synthesis of cysteine sulfoxides and related compounds occurring in wild onions Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften (Dr. rer. nat.) dem Fachbereich Pharmazie der Philipps-Universität Marburg vorgelegt von Mohammad Sadegh Feizabad aus Teheran / Iran Marburg/Lahn, 2019 i Erstgutachter: Prof. Dr. Michael Keusgen Zweitgutachter: Prof. Dr. Frank Runkel Tag der Einreichung Promotion: 24.04.2019 Tag der mündlichen Promotion: 24.06.2019 ii Dedicated to my beloved parents and wife for their precious supports and gentle, who have inspired me and been the driving force throughout my life. iii Foreword The majority of the genus Allium species are known for their medicinal applications: for example, A. stipitatum shows antibiotic effects against Mycobacterium tuberculosis and some other Allium species exhibit antistaphylococcal effects. Furthermore, recent studies have provided evidence of various antifungal, antidiabetic, and anticancer effects of some Allium species. Allium is also well known in traditional medicine for its ability to cure various ailments such as wounds or acute and chronic bronchitis; additionally, alliums can be used as expectorants due to the presence of cysteine sulfoxide and its derivatives. Cysteine sulfoxides, which are some of the basic secondary compounds in Allium, have been addressed in various studies. Alliin, propiin, methin, marasmin, and thiosulfinate, all of which are alliinase substrates, are of particular interest because of their pharmaceutical effects. The enzymatic reaction that occurs during the formation of disulfides or thiosufinates results in various compounds that differ chemically, physically, and pharmaceutically.The cysteine sulfoxide recently investigated in A. giganteum, A. rarolininanum, A. rosenorum, and A. macleani species is the S-(pyrrolyl)cysteine S-oxide. -

1980-04R.Pdf
COMING IN THE NEXT ISSUE Victoria Padilla is recognized as an expert on bromeliads. She will share her knowledge with readers in the OctoberlNovember issue when she writes about their history and development as popular house plants. In addition, look for George Taloumis' article on a charming Savannah townhouse garden and an article on new poinsettia varieties by another expert, Paul Ecke. Roger D. Way will write about new apple varieties and Mrs. Ralph Cannon will offer her G: hoices for hardy plants for damp soils. And last but not least, look for a staff article on money-saving ideas for the garden. We've canvassed over 100 gardeners for their best tips. All this and more in the next issue of American Horticulturist. Illustration by Vi rgini a Daley .- VOLUME 59 NUMBER 4 Judy Powell EDITO R Rebecca McClimans ART DIRECTOR Pam Geick PRODUCTION ASS ISTANT Steven H . Davis Jane Steffey ED ITO RI AL ASS ISTANTS H . Marc Cath ey Gi lbert S. Da ni els Donald Wyman H ORTICULTURAL CONSULTANTS Gil bert S. Daniels BOOK EDITOR Page 28 Page 24 May Lin Roscoe BUSINESS MA AGER Dorothy Sowerby EDUCATIONAL PROGRAMS FEATURES COORDINATOR Broad-leaved Evergreens 16 Judy Canady MEMBERSH IP/SUBSCRIPTI O N Text and Photograph y by Donald Wyman SERVICE Padua 18 Ci nd y Weakland Text and Photography by David W. Lee ASS IST ANT TO THE EDITOR John Si mm ons Bulbs That Last and Last 23 PRODUCTION C OORDINATIO N Isabel Zucker Chro magraphics In c. Plant Propagation-The Future is Here 24 COLOR SEPARATI ONS Chiko Haramaki and Charles Heuser C. -

Master Plant List
MASTER PLANT LIST 5 7 8 6 Glasshouse 4 1 2 3 7 MASTER PLANT LIST PAGE 1 TREES 4 PAPERBARK MAPLE Acer griseum 2 3 RED WEEPING CUT-LEAF JAPANESE MAPLE Acer palmatum ‘Atropurpureum Dissectum’ 3 4 5 7 8 CORAL BARK JAPANESE MAPLE Acer palmatum ‘Sango Kaku’ 4 WEEPING CUT-LEAF JAPANESE MAPLE Acer palmatum ‘Viridis Dissectum’ 2 FULL MOON MAPLE Acer shirasawanum ‘Aureum’ 6 CELESTIAL DOGWOOD Cornus rutgersensis ‘Celestial’ 2 6 SANOMA DOVE TREE Davidia involucrata ‘Sonoma’ 4 SHAKEMASTER HONEY LOCUST Gleditsia triacanthos inermis ‘Shademaster’ 7 TEDDY BEAR MAGNOLIA Magnolia grandiflora ‘Teddy Bear’ 7 BRAKENS BROWN BEAUTY MAGNOLIA Magnolia grandiflora ‘Brackens Brown Beauty’ 2 JAPANESE STEWARTIA Stewartia pseudocamellia 7 WESTERN RED CEDAR Thuja plicata ‘Atrovirens’ SHRUBS 2 ROSANNIE JAPONICA ‘ROZANNIE’ Aucuba japonica ‘Rozannie’ 7 BARBERRY Berberis ‘William Penn’ 2 BEAUTY BERRY Callicarpa ‘Profusion’ 5 7 YULETIDE CAMELLIA Camellia sasanqua ‘Yuletide’ 5 QUINCE Chaenomeles ‘Dragon’s Blood’ 5 QUINCE Chaenomeles ‘Scarlet Storm’ 5 TWIG DOGWOOD WINTER FLAME DOGWOOD Cornus sanguinea ‘Arctic Fire’ 5 MIDWINTER FLAME DOGWOOD Cornus sericea ‘Midwinter Flame’ 1 HARRY LAUDER’S WALKING STICK Corylus avellana ‘Contorta’ 8 BEARBERRY Cotoneaster dammeri 7 SUMMER ICE CAUCASIAN DAPHNE Daphne caucasica ‘Summer Ice’ 2 LILAC DAPHNE Daphne genkwa 6 WINTER DAPHNE Daphne odora f. alba 3 4 CHINESE QUININE Dichroa febrifuga 2 RICE PAPER SHRUB Edgeworthia chrysantha 2 RICE PAPER SHRUB Edgeworhia chrysantha ‘Snow Cream’ 7 TREE IVY Fatshedera lizei 5 DWARF WITCH ALDER Fothergilla gardenii 5 JAPANESE WITCH HAZEL Hamamelis japonica ‘Shibamichi Red’ 2 4 6 BLUE BIRD HYDRANGEA Hydrangea macrophylla ssp. Serrata ‘Bluebird’ 3 4 BLUE DECKLE HYDRANGEA Hydrangea macrophylla ssp. -

Allium Cyrilli Complex (Sect
Turkish Journal of Botany Turk J Bot (2013) 37: 39-45 http://journals.tubitak.gov.tr/botany/ © TÜBİTAK Research Article doi:10.3906/bot-1110-7 Allium cyrilli complex (sect. Melanocrommyum) in Turkey Fatma Neriman ÖZHATAY, İlker GENÇ* Department of Pharmaceutical Botany, Faculty of Pharmacy, İstanbul University, 34116 Beyazıt, İstanbul , Turkey Received: 11.10.2011 Accepted: 23.07.2012 Published Online: 26.12.2012 Printed: 22.01.2013 Abstract: As a part of a revisional study of the genus Allium L. sect Melanocrommyum Webb et Berthel. in Turkey, detailed studies were conducted on 3 very closely related and taxonomically difficult species cited in theFlora of Turkey: Allium cyrilli Ten., A. atropurpureum Waldst. & Kit., and A. decipiens Fisch. ex Schult. & Schult. f., to clarify their occurrence in Turkey and their taxonomy. The results of this study show that A. atropurpureum and A. decipiens do not occur in Turkey. On the other hand, A. cyrilli is represented by 3 subspecies of which 2 are new for science: subsp. fritschii N.Özhatay & İ.Genç and subsp. asumaniae N.Özhatay & İ.Genç. The diagnostic morphological characters, distribution, conservation status, and colour photographs of the 3 subspecies as well as their chromosome numbers are presented: 2n = 16 (diploid) for subsp. fritschii, and 2n = 32 (tetraploid) for subsp. asumaniae and subsp. cyrilli. Key words: Allium, Melanocrommyum, chromosome number, new subspecies, Turkey 1. Introduction (Kollmann, 1984; Davis et al., 1988; Özhatay & Tzanoudakis, The genus Allium L. is a very variable and taxonomically 2000; Deniz & Sümbül, 2004; Özhatay et al., 2009, 2011; Eker difficult genus naturally distributed over the northern & Koyuncu, 2011; Behçet et al., 2012; Behçet & Rüstemoğlu hemisphere. -

Plant Nomenclature - Flowers Common Name: Botanical Latin Name: Family Name Amaryllis Hippeastrum (Amaryllidaceae) Apple; Flowering Apple, Crab Apple Malus Spp
Plant Nomenclature - Flowers Common Name: Botanical Latin Name: Family Name Amaryllis Hippeastrum (Amaryllidaceae) Apple; Flowering Apple, Crab Apple Malus spp. (Rosaceae) Autumn Joy Sedum Sedum ‘Autumn Joy’ (Crassulaceae) Baby’s Breath Gypsophila paniculata (Caryophyllaceae) Bachelor's buttons, Cornflower Centaurea cyannus (Asteraceae – Compositae) Balloon Flower Platycodon grandiflorus (Campanulaceae – Lobeliaceae) Banana Shrub Michelia fuscata; M. figo (Magnoliaceae) Banksia Banksia spp. (Proteaceae) Begonia Begonia (Begoniaceae) Bellflower Campanula spp. (Campanulaceae – Lobeliaceae) Bells of Ireland Moluccella laevis (Lamiaceae- Labiatae) Billy Balls or Billy Buttons Craspedia globosa (Asteraceae - Compositae) Bird of Paradise Strelitzia reginae (Streliziaceae) Black-Eyed Susan Rudbekia spp. (Asteraceae- Compositae) Blanket Flower Gaillardia spp. (Asteraceae – Compositae) Blue Mist Flower, Hardy ageratum Eupatorium coelestinum syn. (Asteraceae – Compositae) Conoclinium coelestinum Blue Throatwort Trachelium caeruleum (Campanulaceae – Lobeliaceae) Bouvardia Bouvardia spp. (Rubiaceae) Breath of Heaven Coleonema pulchrum(Diosma) (Rutaceae) Brodiaea; also Triteleia Brodiaea spp . (Liliaceae) Broom Genista spp. (Fabaceae – Leguminosae) Buttercup; Ranunculus Ranunuclus spp. (Ranunculaceae) Butterfly Bush Buddleia davidii (Buddlejaceae) Butterfly Weed Asclepias tuberose (Asclepiadaceae) Calla Lily Zantedeschia spp. (Araceae) Camellia Camellia spp. (Theaceae) Candytuft Iberis spp. (Brassicaceae – Cruciferae) Chinese Lantern Lily Sandersonia -

Master Plant List
MASTER PLANT LIST 5 N 9 7 8 6 Glasshouse 4 Green Roof 1 2 3 7 MASTER PLANT LIST PAGE 1 TREES 4 Acer griseum PAPERBARK MAPLE 2 3 Acer palmatum ‘Atropurpureum Dissectum’ RED WEEPING CUT-LEAF JAPANESE MAPLE 3 4 5 6 7 Acer palmatum ‘Sango Kaku’ CORAL BARK JAPANESE MAPLE 7 Chamaecyparis nootkatensis ‘Pendula’ WEEPING NOOTKA CYPRESS 7 Chamaecyparis obtusa ‘Gracilis’ SLENDER HINOKI CYPRESS 1 6 Cornus rutgersensis ‘Celestial’ CELESTIAL DOGWOOD 3 6 Davidia involucrata ‘Sonoma’ SONOMA DOVE TREE 4 Gleditsia triacanthos inermis ‘Shademaster’ SHADEMASTER HONEY LOCUST 7 Magnolia grandiflora ‘Teddy Bear’ TEDDY BEAR MAGNOLIA 7 Magnolia grandiflora ‘Bracken’s Brown Beauty’ BRAKEN’S BROWN BEAUTY MAGNOLIA 3 Picea pungens ‘Iseli Fastigiate’ ISELI FASTIGIATE SPRUCE 3 7 Sciadopitys verticillata ‘Wintergreen’ WINTERGREEN UMBRELLA PINE 2 3 Stewartia pseudocamellia JAPANESE STEWARTIA 7 Thuja plicata ‘Atrovirens’ WESTERN RED CEDAR SHRUBS 8 Arbutus compacta DWARF STRAWBERRY TREE 7 Aucuba japonica ‘Rozannie’ ROSANNIE AUCUBA 7 Berberis x gladwynensis ‘William Penn’ BARBERRY 5 Buxus microphylla ‘Wintergreen’ BOXWOOD 8 Callicarpa ‘Profusion’ BEAUTY BERRY 5 7 Camellia sasanqua ‘Yuletide’ YULETIDE CAMELLIA 3 Camellia sasanqua ‘Setsugekka’ SETSUGEKKA CAMELLIA 5 Chaenomeles ‘Dragon’s Blood’ QUINCE 5 Chaenomeles ‘Scarlet Storm’ QUINCE 5 Cornus sericea ‘Bud’s Yellow’ YELLOWTWIG DOGWOOD 1 Corylus avellana ‘Contorta’ HARRY LAUDER’S WALKING STICK 6 Cryptomeria japonica ‘Black Dragon’ BLACK DRAGON JAPANESE CEDAR 8 Cotoneaster dammeri BEARBERRY 2 Daphne genkwa LILAC DAPHNE 4 Dichroa febrifuga CHINESE QUININE 2 Edgeworthia chrysantha ‘Snow Cream’ RICE PAPER SHRUB 7 Fatshedera lizei TREE IVY 7 x Fatshedera lizei ‘Variegata’ VARIGATED TREE IVY 5 Fothergilla gardenii DWARF WITCH ALDER 5 Hamamelis japonica ‘Shibamichi Red’ JAPANESE WITCH HAZEL 2 4 Hydrangea macrophylla ssp. -

A New Monocotyledonous Bulbous Weed Species Was Detected in Hungary: (Allium Giganteum Regel)
A new monocotyledonous bulbous weed species was detected in Hungary: (Allium giganteum Regel) by Bence Balogh1 in collaboration with: in collaboration with: Bálint Benczés2, Gábor Bese2, Richárd Bisztray3, Emese Bodor4, András Fejes4, Máté Károlyi5, Roland Kisjuhász6, László Menyhárt7, Roland Nagy2, Gergő Somody2, Zselyke Széman8, Attila Török9, Gábor Wágner2 and Roland Szabó6. 1 Bayer CS Hungary Kft./Budapest 2 CPR Európa Kft./Szombathely 3 Farmer-Agro Kft./Békéscsaba 4 Biotek Agriculture Kft./Csömör 5 Eurofins Agroscience Services Kft./Székesfehérvár 6 Sumi Agro Hungary Kft./Budapest 7 Syngenta Magyarország Kft./Budapest 8 SGS Hungária Kft./Budapest 9 Kömlői Róna Kft./Kömlő Summary The indicated and identified plant 'Allium giganteum Regel' known by synonym as 'Allium procerum Trautv. ex Regel' and by common name 'Giant Onion', or 'Ornamental Onion' - is native in Central and Southwestern Asia (Pamir-Alay; Tajikistan, Kyrgyzstan and Uzbekistan and Hindu Kush; Afghanistan, Pakistan and the west part of China), but as an ornamental garden plant, it is cultivated in many countries all over the world. The biggest Allium giganteum bulb producer is the Netherlands, but there are smaller producers in Israel, France, Japan and Latvia. (Rabinowitch and Currah, 2002; Kamenetsky and Rabinowitch 2006). The situation was different before the middle of the 19th century when Eduard Regel and other botanists went to Central Asia and discovered many new species among which was Allium giganteum Regel. (Dadd, 1987). This new weed species belongs to the Amaryllidaceae family and Allium genus. (Li, Zhou, Yu, Zhang and Wei, 2010). This plant was used by native people as spice in cheese production and as an herb.