56T00616 UDCTFC.Pdf
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

The Canary Islands
The Canary Islands Naturetrek Tour Report 23 February – 2 March 2019 Canary Bellflower by Jessica Turner Mount Teide by Andrew Bray Euphorbia atropururea by Jessica Turner Barbary Partridge by Andrew Bray Report and images by Jessica Turner and Andrew Bray Naturetrek Mingledown Barn Wolf's Lane Chawton Alton Hampshire GU34 3HJ UK T: +44 (0)1962 733051 E: [email protected] W: www.naturetrek.co.uk Tour Report The Canary Islands Tour participants: Andrew Bray and Jessica Turner (leaders) together with 16 Naturetrek clients Summary The Canary Islands may be well-known as a general tourist destination, but they contain a wealth of natural treasures, and we were fortunate to experience many of them. Their isolation has given rise to many endemic species and subspecies, of which the great views of Tenerife Blue Chaffinch in perfect light were a highlight for many. We marvelled over the flora, so different to that of mainland Europe, and enjoyed the various species of lizards, plus the butterflies and other invertebrates we encountered. The day on La Gomera was a delight, not least for the numbers of Cory’s Shearwaters, whales and dolphins, plus the White-faced Storm Petrels we encountered. Lovely weather with plenty of sunshine, comfortable accommodation, good food and great company all made for an excellent week. Day 1 Saturday 23rd February Fly to Tenerife South – La Chafiras – Road to Vilaflor Fifteen tour group members met with Andrew and Jessica at Gatwick’s North Terminal for the 6.50am Easyjet flight to Tenerife South Airport. After a bit of a delay due to fog at Gatwick, we landed on the island at around 12.15pm, meeting up with our last group member, who had arrived on the island the previous day. -

Corticioid Fungi from Arid and Semiarid Zones of the Canary Islands (Spain)
Corticioid fungi from arid and semiarid zones of the Canary Islands (Spain). Additional data. 2. ESPERANZA BELTRÁN-TEJERA1, J. LAURA RODRÍGUEZ-ARMAS1, M. TERESA TELLERIA2, MARGARITA DUEÑAS2, IRENEIA MELO3, M. JONATHAN DÍAZ-ARMAS1, ISABEL SALCEDO4 & JOSÉ CARDOSO3 1Dpto. de Biología Vegetal (Botánica), Universidad de La Laguna, 38071 La Laguna, Tenerife, Spain 2Real Jardín Botánico, CSIC, Plaza de Murillo 2, 28014 Madrid, Spain 3Jardim Botânico (MNHNC), Universidade de Lisboa/CBA-FCUL, Rua da Escola Politécnica 58, 1250-102 Lisboa, Portugal 4Dpto. de Biología Vegetal y Ecología (Botánica), Universidad del País Vasco (UPV/EHU) Aptdo. 644, 48080 Bilbao, Spain * CORRESPONDENCE TO: [email protected] ABSTRACT — A study of the corticioid fungi collected in the arid, semiarid, and dry zones of the Canary Islands is presented. A total of eighty species, most of them growing on woody plants, was found. Nineteen species are reported for the first time from the archipelago (Asterostroma gaillardii, Athelia arachnoidea, Botryobasidium laeve, Byssomerulius hirtellus, Candelabrochaete septocystidia, Corticium meridioroseum, Crustoderma longicystidiatum, Hjortstamia amethystea, Hyphoderma malençonii, Leptosporomyces mutabilis, Lyomyces erastii, Peniophora tamaricicola, Phanerochaete omnivora, Phlebia albida, Radulomyces rickii, Steccherinum robustius, Trechispora praefocata, Tubulicrinis incrassatus, and T. medius). The importance of endemic plants, such as Rumex lunaria, Euphorbia lamarckii, E. canariensis, Kleinia neriifolia, Echium aculeatum, and Juniperus -

RAÚL ORIHUELA RIVERO Tutorizado Por María Catalina León Arencibia Y Marcelino José Del Arco Aguilar Grado En Biología
Flora y vegetación del territorio de Las Lagarteras (Tenerife, islas Canarias) Flora and vegetation of the territory of Las Lagarteras (Tenerife, Canary Island) Trabajo de Fin de Grado RAÚL ORIHUELA RIVERO Tutorizado por María Catalina León Arencibia y Marcelino José del Arco Aguilar Grado en Biología. Junio 2020 AGRADECIMIENTOS Después de un intenso periodo de trabajo ha llegado el día en el que me dirija a todos los que me han apoyado a lo largo de este camino hacia mi meta final. Por ello, en primer lugar, quería dar las gracias a los tutores de mi trabajo de Fin de Grado, la Dra. María Catalina León Arencibia y el Dr. Marcelino José Del Arco Aguilar, cuyo apoyo, guía y predisposición han sido un pilar fundamental, no solo para el desarrollo de este estudio, sino para mi formación durante la carrera, brindándome todo lo que estuviera a su alcance para que este trabajo diera sus frutos, más aún con la extraordinaria situación que tuvimos que afrontar durante estos meses (SARS-Cov-2). Asimismo, me gustaría agradecer al Dr. Jesús Santiago Notario Del Pino, cuyo conocimiento sobre los suelos de Tenerife fue de gran ayuda durante nuestro análisis. Para finalizar, deseo mostrar mi agradecimiento a mi familia, ya que sin ella, este sueño no podría haberse llevado a cabo. ÍNDICE RESUMEN: ............................................................................................................................................ 1 ABSTRACT: ......................................................................................................................................... -

Characterization of RUSI, a Telomere-Associated Satellite DNA, in the Genus Rumex (Polygonaceae)
Original Article Cytogenet Genome Res 2009;124:81–89 Accepted after revision: September 23, 2008 DOI: 10.1159/000200091 by B. Friebe Characterization of RUSI, a telomere-associated satellite DNA, in the genus Rumex (Polygonaceae) a b c c R. Navajas-Pérez T. Schwarzacher M. Ruiz Rejón M.A. Garrido-Ramos a b Plant Genome Mapping Laboratory, University of Georgia, Athens, GA (USA); Department of Biology, c University of Leicester, Leicester (UK); Departamento de Genética, Facultad de Ciencias, Universidad de Granada, Granada (Spain) A b s t r a c t Rumex (Polygonaceae) is a plant genus containing di- A satellite-DNA family (RUSI) has been isolated and charac- oecious, gynodioecious, polygamous and hermaphro- terized in Rumex induratus Boiss and Reuter (Polygonaceae), ditic species (Rechinger, 1964). Many scientific programs an Iberian endemic polygamous sorrel. The RUSI repeats are have focused on this genus because of its biological and 170 bp in length and ϳ 68% AT-rich containing different vari- evolutionary significance in sexual dimorphism. Within ants of degenerate telomere motifs – (TT) n AN(GG)n –, a typ- the genus Rumex three phylogenetic clades can be de- ical feature of subtelomeric DNA repeats adjacent to telo- fined (Navajas-Pérez et al., 2005a; Fig. 1 ). The basal clade meres, which have been referred to as telomere-associated is composed of hermaphroditic docks, while the second sequences or TASs. In fact, fluorescent in situ hybridization comprises polygamous/gynodioecious sorrels and the showed that this satellite DNA is located in subtelomeric po- third dioecious sorrels except for one hermaphrodite, sitions of most of the chromosomes of R. -

New Xenophytes from La Palma (Canary Islands, Spain), with Emphasis on Naturalized and (Potentially) Invasive Species – Part 3 R
Collectanea Botanica 39: e002 enero-diciembre 2020 ISSN-L: 0010-0730 https://doi.org/10.3989/collectbot.2020.v39.002 New xenophytes from La Palma (Canary Islands, Spain), with emphasis on naturalized and (potentially) invasive species – Part 3 R. OTTO1 & F. VERLOOVE2 1 Lindenstraße, 2, D-96163 Gundelsheim, Germany 2 Botanic Garden Meise, Nieuwelaan, 38, B-1860 Meise, Belgium ORCID iD. R. OTTO: https://orcid.org/0000-0002-2498-7677, F. VERLOOVE: https://orcid.org/0000-0003-4144-2422 Author for correspondence: R. Otto ([email protected]) Editor: N. Ibáñez Received 22 February 2019; accepted 12 September 2019; published on line 14 April 2020 Abstract NEW XENOPHYTES FROM LA PALMA (CANARY ISLANDS, SPAIN), WITH EMPHASIS ON NATURALIZED AND (POTENTIALLY) INVASIVE SPE- CIES. PART 3.— Several months of field work in La Palma (western Canary Islands) yielded a number of interesting new records of non-native vascular plants. Alstroemeria aurea, A. ligtu, Anacyclus radiatus subsp. radiatus, Chenopodium album subsp. borbasii, Cotyledon orbiculata, Cucurbita ficifolia, Cynodon nlemfuensis, Datura stramonium subsp. tatula, Digitaria ciliaris var. rhachiseta, D. ischaemum, Diplotaxis tenuifolia, Egeria densa, Eugenia uniflora, Galinsoga quadri- radiata, Glebionis segetum, Kalanchoe laetivirens, Lemna minuta, Ligustrum lucidum, Lotus broussonetii, Oenothera fal- lax, Paspalum notatum, Passiflora caerulea, P. manicata × tarminiana, P. tarminiana, Pelargonium capitatum, Phaseolus lunatus, Portulaca trituberculata, Pyracantha angustifolia, Sedum mexicanum, Trifolium lappaceum, Urochloa mutica, U. subquadripara and Volutaria tubuliflora are naturalized or (potentially) invasive xenophytes or of special floristic in- terest, reported for the first time from either theCanary Islands or La Palma. Three additional, presumably ephemeral taxa are reported for the first time from the Canary Islands, whereas seven ephemeral taxa are new for La Palma. -

Comparative Analysis of the Alien Vascular Flora of Sardinia and Corsica
Available online: www.notulaebotanicae.ro Print ISSN 0255 -965X; Electronic 1842 -4309 Not Bot Horti Agrobo, 2016, 44(2):337 -346 . DOI:10.15835/nbha442 10491 Original Article Comparative Analysis of the Alien Vascular Flora of Sardinia and Corsica Selena PUDDU 1, Lina PODDA 1*, Olga MAYORAL 2, Alain DELAGE 3, Laetitia HUGOT 3, Yohan PETIT 3, Gianluigi BACCHETTA 1,4 1Università degli Studi di Cagliari, Centro Conservazione Biodiversità (CCB), Dipartimento di Scienze della Vita e dell’Ambien te, v.le S. Ignazio da Laconi 13, 09123 Cagliari, Italy; [email protected] ; [email protected] (*corresponding author) 2Universitat de València, Dpto. Didáctica de las Ciencias Experimentales y Sociales. Facultat de Magisteri, Avinguda dels Tarongers, 4, 46022; Jardí Botànic de la Universitat de València, Valencia, Spain; [email protected] 3Conservatoire Botanique National de Corse, 14 Avenue Jean Nicoli, 20250 Corte, France; [email protected] ; [email protected] ; [email protected] 4Hortus Botanicus Karalitanus (HBK), Università degli Studi di Cagliari, Viale Sant’Ignazio da Laconi 9-11 09123 Cagliari, Italy; [email protected] Abstract This article provides a comparison of the vascular alien flora of Sardinia (Italy) and that of Corsica (France), both territories belonging to the Western Mediterranean biogeographic subregion. The study has recorded 598 (90 doubtful) alien taxa in Sardinia (18% of the total flora) while 553 (87 doubtful) in Corsica (17%); six are new report to Sardinia and 27 to Corsica. A total of 234 taxa are common to both islands. Neophytes are 344 taxa (68% of the total) in Sardinia and 399 taxa (73%) in Corsica. -

PHYTOCHEMICAL SCREENING on the CONSTITUENTS of RUMEX OBTUSIFOLIUS” Ph.D Thesis
“PHYTOCHEMICAL SCREENING ON THE CONSTITUENTS OF RUMEX OBTUSIFOLIUS” Ph.D Thesis By ABDUL KHABIR KHAN Institute of Chemical Sciences, Gomal University, Dera Ismail Khan, Pakistan. 2017 “PHYTOCHEMICAL SCREENING ON THE CONSTITUENTS OF RUMEX OBTUSIFOLIUS” Thesis submitted for the fulfillment of the degree of DOCTOR OF PHILOSOPHY IN CHEMISTRY BY ABDUL KHABIR KHAN Institute of Chemical Sciences, Gomal University, Dera Ismail Khan, Pakistan. 2017 CONTENTS DEDICATION i ACKNOWLEDGMENTS ii SUMMRY iii S.No DESCRIPTIONS Page 1 Chapter No 1: Introduction 1 1.1 Importance of medicinal plants 2 1.2 Family Polygonaceae 5 1.2.1 Botany of the family Polygonaceae 6 1.2.2 Chemistry of family Polygonaceae 6 1.2.3 Pharmacology of the family Polygonaceae 7 1.3 Genus Rumex 8 1.3.1 Distribution of genus Rumex 8 1.3.2 Morphology of genus Rumex 14 1.4 Rumex Obtusifolius 16 1.4.1 Habitat 17 1.4.2 Morphology 17 1.4.2.1 Roots 17 1.4.2.2 Stems 17 1.4.2.3 Leaves 17 1.4.2.4 Flower and Inflorescence 17 1.4.2.5 Taxonomic position 18 2 Chapter 2: Literature Review 19 2.1 Traditional uses of Rumex species 20 2.2 Traditional medicinal uses of Rumex species 21 2.3 Pharmacological and Biological screening of rumex species 23 2.4 Compound isolated from Rumex species. 29 4.2.1 Structures of the isolated compounds 33 2.5 R. Obtusifolius 46 2.6 Biosynthesis of anthraquinones 47 3 Chapter No 3: Result and Discussion 50 Preliminary phytochemical screeninig (qualitative) of crude extracts of 3.1 R.Obtusifolius 51 Biological Screening of Dichloromethane Sub-fractions of Rumex 3.2 Obtusifolius 53 3.2.1 Antibacterial screening 53 3.2.2. -

Wood Anatomy of Polygonaceae: Analysis of a Family with Exceptional Wood Diversity
Botanical Journal of the Lirtneon Society. 2003. 141. 25—51. With 59 figures Wood anatomy of Polygonaceae: analysis of a family with exceptional wood diversity SHERWIN CARLQUIST FLS Santa Barbara Botanic Garden, 1212 Mission Canyon Road, Santa Barbara, CA 93105, USA Received May 2002; accepted for publication August 2002 Quantitative and qualitative data are presented for woods of 30 species of woody Polygonaceae. Wood features that ally Polx’gonaceae with Plumbaginaceae include nonbordered perforation plates, storeing in narrow vessels and axial parenchyma, septate or nucleate fibres, vasicentric parenchyma, pith bundles that undergo secondary growth, silica bodies, and ability to form successive cambia. These features are consistent with pairing of Plumbaginaceae and Polgonaceae as sister families. Wood features that ally Polygonaceae with Rhabdodendraceae include nonbor dered perforation plates, presence of vestured pits in vessels, presence of silica bodies and dark-staining compounds in ray cells, and ability to form successive cambia. Of the features listed above, nonbordered perforation plates and ability to form successive cambia may be symplesiomorphies basic to Caryophyllales sensu lato. The other features are more likely to be synapomorphies. Wood data thus support molecular cladograms that show the three families near the base of Caryophyllales si. Chambered crystals are common to three genera of the family and may indicate relationship. Ray histology suggests secondary woodiness in Antigonon, Atraphaxis, Bilderdyhia, Dedeckera, En ogonun-i, Hanfordia, Muehlenbechia, Polygonum, and Rumex. Other genera of the family show little or no evidence of secondary woodiness. Molecular data are needed to confirm this interpretation and to clarify the controversial sys tematic groupings within the family proposed by various authors. -

Bulletin of the Natural History Museum
ISSN 0968-0446 Bulletin of The Natural History THE NATURAL Museum MUSEUM HISTORY PRESENTED GENERAL LIBRARY Botany Series THE NATURAL HISTORY MUSEUM VOLUME 24 NUMBER 1 23 JUNE 1994 The Bulletin of The Natural History Museum (formerly: Bulletin of the British Museum (Natural History)), instituted in 1949, is issued in four scientific series, Botany, Entomology, Geology (incorporating Mineralogy) and Zoology. The Botany Series is edited in the Museum's Department of Botany Keeper of Botany: Dr S. Blackmore Editor of Bulletin: Dr R. Huxley Assistant Editor: Mrs M.J. West Papers in the Bulletin are primarily the results of research carried out on the unique and ever- growing collections of the Museum, both by the scientific staff and by specialists from elsewhere who make use of the Museum's resources. Many of the papers are works of reference that will remain indispensable for years to come. All papers submitted for publication are subjected to external peer review for acceptance. A volume contains about 160 pages, made up by two numbers, published in the Spring and Autumn. Subscriptions may be placed for one or more of the series on an annual basis. Individual numbers and back numbers can be purchased and a Bulletin catalogue, by series, is available. Orders and enquiries should be sent to: Intercept Ltd. P.O. Box 716 Andover Hampshire SP10 1YG Telephone: (0264) 334748 Fax: (0264) 334058 World List abbreviation: Bull. nat. Hist. Mus. Lond. (Bot.) The Natural History Museum, 1994 Botany Series ISSN 0968-0446 Vol. 24, No. 1, pp. 1-100 The Natural History Museum Cromwell Road London SW7 5BD Issued 23 June 1994 Typeset by Ann Buchan (Typesetters), Middlesex Printed in Great Britain at The Alden Press, Oxford Bull. -
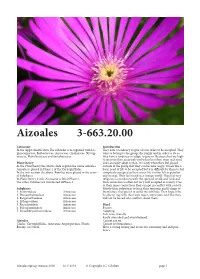
Aizoales 3-663.20.00
Aizoales 3-663.20.00 Taxonomy Introduction In the Apg2 classifcation Te suborder is recognised with Lo- Tey have a tendency to give a lot in order to be accepted. Tey phiocarpaceae, Barbeuiaceae, Aizoaceae, Gisekiaceae, Nyctag- want to belong to the group, the family and in order to do so inaceae, Phytolaccaceae and Sarcobataceae. they have a tendency to adapt, to give in. Because they are high- ly sensitive they accurately feel what the others want and need Plant theory and can easily adapt to that. It is only when they feel placed In the Plant theory the above clade is given the name Aizoales. outside of the group that they can become angry. It feels like a Aizoales is placed in Phase 2 of the Caryophyllidae. basic need of life to be accepted but it is difcult for them to feel In the frst version the above Families were placed in the sever- completely accepted as their inner life is ofen felt as peculiar al Subphases. and strange. Tey feel weird in a strange world. Tey feel very In Plant theory 2 only Aizoaceae is lef inPhase 2. religious, a connection with the spiritual world and God and Te other Families are transferred toPhase 3. that connection is ofen not very well accepted in society. Due to their inner convictions they can get in confict with society. Subphases Mostly their solution is to keep their opinions and feelings to 1. Sesuvioideae Aizoaceae themselves; they prefer to avoid the conficts. Tey hope to be 2. Drosanthemoideae Aizoaceae be able to stay with their own inner convictions and that they 3. -

Isabel Sanmartín Bastida, María Luisa Alarcón
ISABEL SANMARTÍN BASTIDA, MARÍA LUISA ALARCÓN CAVERO Y JUAN JOSÉ ALDASORO CERTIFICAN Que el trabajo titulado “Macroevolución y microevolución en sistemas insulares: el patrón Rand Flora en el género Canarina”, que presenta Mario Mairal Pisa, ha sido realizado bajo su dirección y autorizan su presentación al tribunal calificador para optar al grado de Doctor en el Programa de Doctorado de Conservación de Recursos Naturales por la Universidad Rey Juan Carlos. Y para que así conste, firman la presente en Madrid, a ___ de ______ de 2015. Directora de tesis Isabel Sanmartín Bastida Codirectora Codirector María Luisa Alarcón Cavero Juan José Aldasoro Martín Macroevolution and microevolution in island systems: the Rand Flora pattern in the genus Canarina Macroevolución y microevolución en sistemas insulares: el patrón Rand Flora en el género Canarina Tesis Doctoral Mario Mairal Pisa Julio 2015 Directora Isabel Sanmartín Bastida Codirectores María Luisa Alarcón Cavero Juan José Aldasoro Martín Departamento de Biología y Geología, Física y Química Inorgánica y Analítica Este trabajo ha sido realizado en el Real Jardín Botánico de Madrid, CSIC, bajo la dirección de la doctora Isabel Sanmartín Bastida, científica titular del Departamento de Conservación y Biodiversidad, y la codirección de los doctores María Luisa Alarcón Cavero y Juan José Aldasoro Martín, ambos del Departamento de Biodiversidad del Instituto Botánico de Barcelona, CSIC-ICUB. Además, parte de los resultados fueron obtenidos en las estancias realizadas en el Jardín Botánico ‘Viera y Clavijo’- Unidad Asociada CSIC (Cabildo de Gran Canaria; Gran Canaria, España) bajo la dirección del doctor Juli Caujapé Castells, en la Université de Lausanne (Lausanne, Suiza) bajo la dirección del doctor Nadir Álvarez y en la Université de Fribourg bajo la dirección del doctor Loïc Pellissier y la doctora Myriam Heuertz. -

Flora Y Vegetación De La Montaña De Los Guirres (Güímar, Tenerife)
VIERAEA Vol. 46 pp. 29-72 Santa Cruz de Tenerife, octubre 2019 ISSN 0210-945X Flora y Vegetación de la Montaña de Los Guirres (Güímar, Tenerife) MARÍA RODRÍGUEZ GONZÁLEZ 1, OCTAVIO RODRÍGUEZ DELGADO 1 & MARCELINO J. DEL ARCO AGUILAR 1 1Área de Botánica. Universidad de La Laguna. [email protected] RODRÍGueZ GONZáleZ, M., O. RODRÍGueZ DelGADO & M. J. Del ARCO AGUILAR (2019). Flora and vegetation of the Montaña de Los Guirres (Güímar, Tenerife): Vieraea, 46: 29-72. https://doi.org/10.31939/vieraea.2019.46.tomo01.03 RESUMEN: En este trabajo se afronta el por lo tanto, la vegetación potencial cli- estudio del bioclima, la flora y la vegeta- matófila corresponde al tabaibal dulce. ción de la Montaña de los Guirres, situa- Desde el punto de vista florístico, se han da en la franja costera del municipio de identificado 120 taxones, siendo 32 de Güímar (SE de Tenerife). Además, se re- ellos endémicos. Con respecto a la ve- lacionan los usos que ha tenido este te- getación, utilizando el método fitosocio- rritorio a lo largo de la historia y, a partir lógico se han reconocido 16 asociacio- de la bibliografía consultada, se hace un nes, tanto climácicas como seriales, y pequeño análisis de otros aspectos del se ha elaborado un mapa de vegetación medio físico. El estudio bioclimático nos actual. En el presente, con el abandono permite concluir que el área de estudio de algunos usos tradicionales, se apre- está incluida en el piso bioclimático “In- cia una cierta recuperación del paisaje framediterráneo inferior Árido inferior”, vegetal. PALABRAS CLAVE: médio físico / bioclima / flora / vegetación / Montaña de los Guirres / Canarias.