Les Poissons Aveugles (I)
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Updated Checklist of Marine Fishes (Chordata: Craniata) from Portugal and the Proposed Extension of the Portuguese Continental Shelf
European Journal of Taxonomy 73: 1-73 ISSN 2118-9773 http://dx.doi.org/10.5852/ejt.2014.73 www.europeanjournaloftaxonomy.eu 2014 · Carneiro M. et al. This work is licensed under a Creative Commons Attribution 3.0 License. Monograph urn:lsid:zoobank.org:pub:9A5F217D-8E7B-448A-9CAB-2CCC9CC6F857 Updated checklist of marine fishes (Chordata: Craniata) from Portugal and the proposed extension of the Portuguese continental shelf Miguel CARNEIRO1,5, Rogélia MARTINS2,6, Monica LANDI*,3,7 & Filipe O. COSTA4,8 1,2 DIV-RP (Modelling and Management Fishery Resources Division), Instituto Português do Mar e da Atmosfera, Av. Brasilia 1449-006 Lisboa, Portugal. E-mail: [email protected], [email protected] 3,4 CBMA (Centre of Molecular and Environmental Biology), Department of Biology, University of Minho, Campus de Gualtar, 4710-057 Braga, Portugal. E-mail: [email protected], [email protected] * corresponding author: [email protected] 5 urn:lsid:zoobank.org:author:90A98A50-327E-4648-9DCE-75709C7A2472 6 urn:lsid:zoobank.org:author:1EB6DE00-9E91-407C-B7C4-34F31F29FD88 7 urn:lsid:zoobank.org:author:6D3AC760-77F2-4CFA-B5C7-665CB07F4CEB 8 urn:lsid:zoobank.org:author:48E53CF3-71C8-403C-BECD-10B20B3C15B4 Abstract. The study of the Portuguese marine ichthyofauna has a long historical tradition, rooted back in the 18th Century. Here we present an annotated checklist of the marine fishes from Portuguese waters, including the area encompassed by the proposed extension of the Portuguese continental shelf and the Economic Exclusive Zone (EEZ). The list is based on historical literature records and taxon occurrence data obtained from natural history collections, together with new revisions and occurrences. -

The Distribution of Fishes Found Below a Depth of 2000 Meters
r a I B R.AR.Y OF THE UNIVERSITY Of ILLINOIS cr> 52)0.5 CO FI 3 v.3G BIOLOGY The person charging this material is re- sponsible for its return on or before the Latest Date stamped below. Theft, and mutilation, underlining of books are reasons for disciplinary action and may result ,n dismissal from the University University of Illinois Library M^a^m UM*^V L161 O-1096 36 .2 THE DISTRIBUTION OF FISHES FOUND BELOW A DEPTH OF 2000 METERS MARION GREY FIELDIANA: ZOOLOGY VOLUME 36, NUMBER 2 Published by CHICAGO NATURAL HISTORY MUSEUM JULY 30, 1956 NAT. HIST. r THE DISTRIBUTION OF FISHES FOUND BELOW A DEPTH OF 2000 METERS MARION GREY Associate, Division of Fishes THE LIBRARY OF THE AUG H 1966 FIELDIANA: ZOOLOGY UHWB8I1Y OF ILLINOIS VOLUME 36, NUMBER 2 Published by CHICAGO NATURAL HISTORY MUSEUM JULY 30, 1956 PRINTED IN THE UNITED STATES OF AMERICA BY CHICAGO NATURAL HISTORY MUSEUM PRESS WD X^ CONTENTS PAGE Introduction 77 Terminology 78 Fishes found below 3660 meters 78 Distinctive character of deep-abyssal fauna 82 Endemism in deep-abyssal waters 83 Endemism of species 84 The bathypelagic fishes 88 Conclusion 92 Note 93 Editorial note 93 Acknowledgments 93 Synonymies and Distribution 94 Scylliorhinidae 94 Squalidae 95 Rajidae 98 Chimaeridae 100 Rhinochimaeridae 101 Alepocephalidae 102 Searsiidae 116 Gonostomatidae 119 Bathylaconidae 127 Harpadontidae 128 Chlorophthalmidae 129 Bathypteroidae 130 Ipnopidae 135 Eurypharyngidae 137 Simenchelyidae 139 Nettastomidae 140 Congridae 142 Ilyophidae 142 Synaphobranchidae 143 Serrivomeridae 148 Nemichthyidae 149 Cyemidae 151 75 76 CONTENTS PAGE Halosauridae 152 Notacanthidae 156 Moridae 158 Gadidae 161 Macrouridae 162 Stephanoberycidae 190 Melamphaidae 191 Acropomatidae(?) 192 Parapercidae 193 Chiasmodontidae 193 Bathydraconidae 194 Zoarcidae C . -

APORTACION5.Pdf
Ⓒ del autor: Domingo Lloris Ⓒ mayo 2007, Generalitat de Catalunya Departament d'Agricultura, Alimentació i Acció Rural, per aquesta primera edició Diseño y producción: Dsignum, estudi gràfic, s.l. Coordinación: Lourdes Porta ISBN: Depósito legal: B-16457-2007 Foto página anterior: Reconstrucción de las mandíbulas de un Megalodonte (Carcharocles megalodon) GLOSARIO ILUSTRADO DE ICTIOLOGÍA PARA EL MUNDO HISPANOHABLANTE Acuariología, Acuarismo, Acuicultura, Anatomía, Autoecología, Biocenología, Biodiver- sidad, Biogeografía, Biología, Biología evolutiva, Biología conservativa, Biología mole- cular, Biología pesquera, Biometría, Biotecnología, Botánica marina, Caza submarina, Clasificación, Climatología, Comercialización, Coro logía, Cromatismo, Ecología, Ecolo- gía trófica, Embriología, Endocri nología, Epizootiología, Estadística, Fenología, Filoge- nia, Física, Fisiología, Genética, Genómica, Geografía, Geología, Gestión ambiental, Hematología, Histolo gía, Ictiología, Ictionimia, Merística, Meteorología, Morfología, Navegación, Nomen clatura, Oceanografía, Organología, Paleontología, Patología, Pesca comercial, Pesca recreativa, Piscicultura, Química, Reproducción, Siste mática, Taxono- mía, Técnicas pesqueras, Teoría del muestreo, Trofismo, Zooar queología, Zoología. D. Lloris Doctor en Ciencias Biológicas Ictiólogo del Instituto de Ciencias del Mar (CSIC) Barcelona PRÓLOGO En mi ya lejana época universitaria se estudiaba mediante apuntes recogidos en las aulas y, más tarde, según el interés transmitido por el profesor y la avidez de conocimiento del alumno, se ampliaban con extractos procedentes de diversos libros de consulta. Así descubrí que, mientras en algunas disciplinas resultaba fácil encontrar obras en una lengua autóctona o traducida, en otras brillaban por su ausen- cia. He de admitir que el hecho me impresionó, pues ponía al descubierto toda una serie de oscuras caren- cias que marcaron un propósito a seguir en la disciplina que me ha ocupado durante treinta años: la ictiología. -

The Fish Fauna of Ampe`Re Seamount (NE Atlantic) and the Adjacent
Helgol Mar Res (2015) 69:13–23 DOI 10.1007/s10152-014-0413-4 ORIGINAL ARTICLE The fish fauna of Ampe`re Seamount (NE Atlantic) and the adjacent abyssal plain Bernd Christiansen • Rui P. Vieira • Sabine Christiansen • Anneke Denda • Frederico Oliveira • Jorge M. S. Gonc¸alves Received: 26 March 2014 / Revised: 15 September 2014 / Accepted: 24 September 2014 / Published online: 2 October 2014 Ó Springer-Verlag Berlin Heidelberg and AWI 2014 Abstract An inventory of benthic and benthopelagic stone’’ hypothesis of species dispersal, some differences fishes is presented as a result of two exploratory surveys can be attributed to the local features of the seamounts. around Ampe`re Seamount, between Madeira and the Por- tuguese mainland, covering water depths from 60 to Keywords Deep sea Á Fish distribution Á Ichthyofauna Á 4,400 m. A total of 239 fishes were collected using dif- Seamounts Á Zoogeography ferent types of sampling gear. Three chondrichthyan spe- cies and 31 teleosts in 21 families were identified. The collections showed a vertical zonation with little overlap, Introduction but indications for an affinity of species to certain water masses were only vague. Although most of the species Due to their vertical range and habitat diversity, seamounts present new records for Ampe`re Seamount, all of them often support high fish diversity, as compared to the sur- have been known for the NE Atlantic; endemic species rounding ocean, and some are known as hotspots of were not found. The comparison with fish communities at endemic species (e.g. Shank 2010; Stocks et al. 2012). other NE Atlantic seamounts indicates that despite a high Seamounts are considered to act as ‘‘stepping stones’’ for ichthyofaunal similarity, which supports the ‘‘stepping species dispersal (Almada et al. -

The First Record of a Trans-Oceanic Sister-Group Relationship Between Obligate Vertebrate Troglobites
The First Record of a Trans-Oceanic Sister-Group Relationship between Obligate Vertebrate Troglobites Prosanta Chakrabarty1*, Matthew P. Davis2, John S. Sparks3 1 Louisiana State University, Museum of Natural Science, Department of Biological Sciences, Baton Rouge, Louisiana, United States of America, 2 The Field Museum, Department of Zoology, Chicago, Illinois, United States of America, 3 American Museum of Natural History, Department of Ichthyology, Division of Vertebrate Zoology, New York, New York, United States of America Abstract We show using the most complete phylogeny of one of the most species-rich orders of vertebrates (Gobiiformes), and calibrations from the rich fossil record of teleost fishes, that the genus Typhleotris, endemic to subterranean karst habitats in southwestern Madagascar, is the sister group to Milyeringa, endemic to similar subterranean systems in northwestern Australia. Both groups are eyeless, and our phylogenetic and biogeographic results show that these obligate cave fishes now found on opposite ends of the Indian Ocean (separated by nearly 7,000 km) are each others closest relatives and owe their origins to the break up of the southern supercontinent, Gondwana, at the end of the Cretaceous period. Trans-oceanic sister-group relationships are otherwise unknown between blind, cave-adapted vertebrates and our results provide an extraordinary case of Gondwanan vicariance. Citation: Chakrabarty P, Davis MP, Sparks JS (2012) The First Record of a Trans-Oceanic Sister-Group Relationship between Obligate Vertebrate Troglobites. PLoS ONE 7(8): e44083. doi:10.1371/journal.pone.0044083 Editor: Michael Schubert, Ecole Normale Supe´rieure de Lyon, France Received January 10, 2012; Accepted July 31, 2012; Published August 28, 2012 Copyright: ß 2012 Chakrabarty et al. -
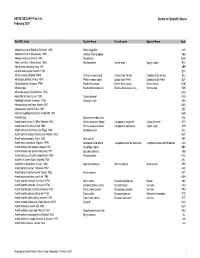
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste -

A New Genus and Species of Blind Sleeper (Teleostei: Eleotridae) from Oaxaca, Mexico: First Obligate Cave Gobiiform in the Western Hemisphere Author(S): Stephen J
A New Genus and Species of Blind Sleeper (Teleostei: Eleotridae) from Oaxaca, Mexico: First Obligate Cave Gobiiform in the Western Hemisphere Author(s): Stephen J. Walsh and Prosanta Chakrabarty Source: Copeia, 104(2):506-517. Published By: The American Society of Ichthyologists and Herpetologists DOI: http://dx.doi.org/10.1643/CI-15-275 URL: http://www.bioone.org/doi/full/10.1643/CI-15-275 BioOne (www.bioone.org) is a nonprofit, online aggregation of core research in the biological, ecological, and environmental sciences. BioOne provides a sustainable online platform for over 170 journals and books published by nonprofit societies, associations, museums, institutions, and presses. Your use of this PDF, the BioOne Web site, and all posted and associated content indicates your acceptance of BioOne’s Terms of Use, available at www.bioone.org/page/terms_of_use. Usage of BioOne content is strictly limited to personal, educational, and non-commercial use. Commercial inquiries or rights and permissions requests should be directed to the individual publisher as copyright holder. BioOne sees sustainable scholarly publishing as an inherently collaborative enterprise connecting authors, nonprofit publishers, academic institutions, research libraries, and research funders in the common goal of maximizing access to critical research. Copeia 104, No. 2, 2016, 506–517 A New Genus and Species of Blind Sleeper (Teleostei: Eleotridae) from Oaxaca, Mexico: First Obligate Cave Gobiiform in the Western Hemisphere Stephen J. Walsh1 and Prosanta Chakrabarty2 Caecieleotris morrisi, new genus and species of sleeper (family Eleotridae), is described from a submerged freshwater cave in a karst region of the northern portion of the State of Oaxaca, Mexico, R´ıo Papaloapan drainage, Gulf of Mexico basin. -

Interrelationships of Aulopiformes
CHAPTER 14 Interrelationships of Aulopiformes CAROLE C. BALDWIN and G. DAVID JOHNSON Department of Vertebrate Zoology National Museum of Natural History Smithsonian Institution Washington, D.C. 20560 I. Introduction relationships in which Rosen's (1973) aulopiforms and myctophiforms are united in the order Myctoph- In 1973, Rosen erected the order Aulopiformes for iformes. all non-ctenosquamate eurypterygians, that is, the Ini- In 1985, Rosen altered his concept of a monophy- omi of Gosline et al. (1966) minus the Myctophiformes letic Aulopiformes, noting that Aulopus shares several (Myctophidae and Neoscopelidae). Rosen's aulopi- derived features with ctenosquamates, most notably forms included 15 families (Alepisauridae, Anotopter- a median rostral cartilage. Hartel and Stiassny (1986) idae, Aulopidae, Bathysauridae, Bathypteroidae, considered a true median rostral cartilage a character of acanthomorphs and concluded that the morphol- Chlorophthalmidae, Evermannellidae, Giganturidae, ogy of the rostral cartilage is highly variable below Harpadontidae, Ipnopidae, Omosudidae, Paralepidi- that level. Nevertheless, Stiassny (1986) supported dae, Scopelarchidae, Scopelosauridae, and Synodon- Rosen's (1985) view of a paraphyletic Aulopiformes, tidae) and 17 fossil genera, a morphologically diverse proposing that Chlorophthalmus, Parasudis and Aulopus gro^u^p of benthic and pelagic fishes that range in habi- form the sister group of ctenosquamates based on an tat from estuaries to the abyss. elevated, reoriented cranial condyle on the maxilla Rosen (1973) diagnosed the Aulopiformes by the and concurrent exposure of a "maxillary saddle" for presence of. an elongate uncinate process on the reception of the palatine prong. G.D. Johnson (1992) second epibranchial (EB2) bridging the gap between discussed the shortcomings of Rosen's (1985) analysis a posterolaterally displaced second pharyngobran- and observed that neither Rosen nor Stiassny (1986) chial (PB2) and the third pharyngobranchial (PB3). -

Euryhalinity in an Evolutionary Context Eric T
University of Connecticut OpenCommons@UConn EEB Articles Department of Ecology and Evolutionary Biology 2013 Euryhalinity in an Evolutionary Context Eric T. Schultz University of Connecticut - Storrs, [email protected] Stephen D. McCormick USGS Conte Anadromous Fish Research Center, [email protected] Follow this and additional works at: https://opencommons.uconn.edu/eeb_articles Part of the Comparative and Evolutionary Physiology Commons, Evolution Commons, and the Terrestrial and Aquatic Ecology Commons Recommended Citation Schultz, Eric T. and McCormick, Stephen D., "Euryhalinity in an Evolutionary Context" (2013). EEB Articles. 29. https://opencommons.uconn.edu/eeb_articles/29 RUNNING TITLE: Evolution and Euryhalinity Euryhalinity in an Evolutionary Context Eric T. Schultz Department of Ecology and Evolutionary Biology, University of Connecticut Stephen D. McCormick USGS, Conte Anadromous Fish Research Center, Turners Falls, MA Department of Biology, University of Massachusetts, Amherst Corresponding author (ETS) contact information: Department of Ecology and Evolutionary Biology University of Connecticut Storrs CT 06269-3043 USA [email protected] phone: 860 486-4692 Keywords: Cladogenesis, diversification, key innovation, landlocking, phylogeny, salinity tolerance Schultz and McCormick Evolution and Euryhalinity 1. Introduction 2. Diversity of halotolerance 2.1. Empirical issues in halotolerance analysis 2.2. Interspecific variability in halotolerance 3. Evolutionary transitions in euryhalinity 3.1. Euryhalinity and halohabitat transitions in early fishes 3.2. Euryhalinity among extant fishes 3.3. Evolutionary diversification upon transitions in halohabitat 3.4. Adaptation upon transitions in halohabitat 4. Convergence and euryhalinity 5. Conclusion and perspectives 2 Schultz and McCormick Evolution and Euryhalinity This chapter focuses on the evolutionary importance and taxonomic distribution of euryhalinity. Euryhalinity refers to broad halotolerance and broad halohabitat distribution. -

View/Download P
GOBIIFORMES (part 2) · 1 The ETYFish Project © Christopher Scharpf and Kenneth J. Lazara COMMENTS: v. 6.0 - 5 May 2020 Order GOBIIFORMES (part 2 of 7) Family OXUDERCIDAE Mudskipper Gobies (Acanthogobius through Oxyurichthys) Taxonomic note: includes taxa previously placed in the gobiid subfamilies Amblyopinae, Gobionellinae and Sicydiinae. Acanthogobius Gill 1859 acanthus, spine, allusion not explained, probably referring to 8-9 spines on first dorsal fin of A. flavimanus; gobius, goby Acanthogobius elongatus Fang 1942 referring to its more elongate body compared to congeners (then placed in Aboma) in China and Japan [A. elongata (Ni & Wu 1985) from Nanhui, Shanghai, China, is a junior primary homonym treated as valid by some authors but needs to be renamed] Acanthogobius flavimanus (Temminck & Schlegel 1845) flavus, yellow; manus, hand, referring to its yellow ventral fins Acanthogobius hasta (Temminck & Schlegel 1845) spear or dart, allusion not explained, perhaps referring to its very elongate, tapered body and lanceolate caudal fin Acanthogobius insularis Shibukawa & Taki 1996 of islands, referring to its only being known from island habitats Acanthogobius lactipes (Hilgendorf 1879) lacteus, milky; pes, foot, referring to milky white stripe in middle of fused ventral fins Acanthogobius luridus Ni & Wu 1985 pale yellow, allusion not explained, perhaps referring to body coloration and/or orange-brown tail Akihito Watson, Keith & Marquet 2007 in honor of Emperor Akihito of Japan (b. 1933), for his many contributions to goby systematics and phylogenetic research Akihito futuna Keith, Marquet & Watson 2008 named for the Pacific island of Futuna, where it appears to be endemic Akihito vanuatu Watson, Keith & Marquet 2007 named for the island nation of Vanuatu, only known area of occurrence Amblychaeturichthys Bleeker 1874 amblys, blunt, presumably referring to blunt head and snout of type species, A. -

SOMALIA National Biodiversity Strategy and Action Plan (NBSAP)
FEDERAL REPUBLIC OF SOMALIA National Biodiversity Strategy and Action Plan (NBSAP) December, 2015 The designations employed and the presentation of material in this document do not imply the expression of any opinion whatsoever on the part of the Food and Agriculture Organization of the United Nations and the SWALIM Project concerning the legal status of any country, territory, city or area of its authorities, or concerning the delimitation of its frontiers or boundaries. This document should be cited as follows: Ullah, Saleem and Gadain, Hussein 2016. National Biodiversity Strategy and Action Plan (NBSAP) of Somalia, FAO-Somalia. Contents Executive Summary .................................................................................................................... 6 CHAPTER 1: INTRODUCTION ............................................................................................. 12 1.1. Background to the National Biodiversity Strategy and Action Plan: ............................. 12 1.2. Overview of the NBSAP development process in Somalia ........................................... 12 1.3. Structure of the National Biodiversity Strategy and Action Plan .................................. 16 1.4. Understanding biodiversity ............................................................................................ 17 1.5. Importance of biodiversity ............................................................................................. 17 1.6. Generic Profile of Somalia ............................................................................................ -

Catalog of Type Specimens of Recent Fishes in the National Museum Of
Catalog of Type Specimens of Recent Fishes in the National Museum of Natural History, Smithsonian Institution, 4: Gonorynchiformes, Gymnotiformes, and Siluriformes (Teleostei: Ostariophysi) CARL J. FERRARIS, JR. and RICHARD P. VARI W9\ I SMITHSONIAN CONTRIBUTIONS TO ZOOLOGY • NUMBER 535 SERIES PUBLICATIONS OF THE SMITHSONIAN INSTITUTION Emphasis upon publication as a means of "diffusing knowledge" was expressed by the first Secretary of the Smithsonian. In his formal plan for the Institution, Joseph Henry outlined a program that included the following statement: "It is proposed to publish a series of reports, giving an account of the new discoveries in science, and of the changes made from year to year in all branches of knowledge." This theme of basic research has been adhered to through the years by thousands of titles issued in series publications under the Smithsonian imprint, commencing with Smithsonian Contributions to Knowledge in 1848 and continuing with the following active series: Smithsonian Contributions to Anthropology Smithsonian Contributions to Astrophysics Smithsonian Contributions to Botany Smithsonian Contributions to the Earth Sciences Smithsonian Contributions to the Marine Sciences Smithsonian Contributions to Paleobiology Smithsonian Contributions to Zoology Smithsonian Folklife Studies Smithsonian Studies in Air and Space Smithsonian Studies in History and Technology In these series, the Institution publishes small papers and full-scale monographs that report the research and collections of its various museums and bureaux or of professional colleagues in the world of science and scholarship. The publications are distributed by mailing lists to libraries, universities, and similar institutions throughout the world. Papers or monographs'submitted for series publication are received by the Smithsonian Institution Press, subject to its own review for format and style, only through departments of the various Smithsonian museums or bureaux, where the manuscripts are given substantive review.