Universidade Estadual Do Centro-Oeste
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

The Taxonomic Status of Gladiolus Illyricus (Iridaceae) in Britain
The Taxonomic Status of Gladiolus illyricus (Iridaceae) in Britain Aeron Buchanan Supervisor: Fred Rumsey, Natural History Museum, London A thesis submitted in partial fulfilment of the requirements for the degree of Master of Science of Imperial College, London Abstract First noticed officially in Britain in 1855, Gladiolus illyricus (Koch) presents an interesting taxonomic and biogeographical challenge: whether or not this isolated northern population should be recognized as a separate sub-species. Fundamental conservation issues rest on the outcome. Here, the investigation into the relationship of the G. illyricus plants of the New Forest, Hampshire, to Gladiolus species across Europe, northern Africa and the middle east is initiated. Two chloroplast regions, one in trnL–trnF and the other across psbA–trnH have been sequenced for 42 speci- mens of G. illyricus, G. communis, G. italicus, G. atroviolaceus, G. triphyllos and G. anatolicus. Phylogenetic and biogeographical treatments support the notion of an east–west genetic gradation along the Mediterranean. Iberia particularly appears as a zone of high hybridization potential and the source of the New Forest population. Alignment with sequences obtained from GenBank give strong support to the classic taxonomy of Gladiolus being monophyletic in its sub-family, Ixioideae. Comments on these chloroplast regions for barcoding are also given. In conclusion, the genetic localization of Britain’s G. illyricus population as an extremity haplotype suggests that it could well deserve sub-species status. Contents 1 Introduction 2 2 Background 4 3 Materials and Methods 8 4 Results and Discussion 15 5 Conclusions 26 Appendices 28 References 56 1. Introduction G. illyricus in Britain Figure 1: G. -

Taxonomy, Geographic Distribution, Conservation and Species Boundaries in Calydorea Azurea Group (Iridaceae: Tigridieae)1 Introd
BALDUINIA, n. 64, p. 19-33, 04-XI-2018 http://dx.doi.org/10.5902/2358198035734 TAXONOMY, GEOGRAPHIC DISTRIBUTION, CONSERVATION AND SPECIES BOUNDARIES IN CALYDOREA AZUREA GROUP (IRIDACEAE: TIGRIDIEAE)1 LEONARDO PAZ DEBLE2 ANABELA SILVEIRA DE OLIVEIRA DEBLE3 FABIANO DA SILVA ALVES4 LUIZ FELIPE GARCIA5 SABRINA ARIANE OVIEDO REFIEL LOPES6 ABSTRACT For this study were performed observations in populations of Calydorea azurea Klatt and allied taxa, along of the ecosystems of the Río de La Plata Grasslands, geographic extent where occur this group. For the complementation of the data were examined collections deposited in the principal herbaria of southern Brazil, Uruguay and Argentina, and were analyzed image of types and others collections available. All studied species were photographed and its populations geo-referenced. It are recognized six species: C. alba Roitman & Castillo, C. azurea, C. charruana Deble, C. luteola (Klatt) Baker, C. minima Roitman & Castillo and C. riograndensis Deble. C. azurea is cited for Brazil, C. charruana is added to Argentinian flora, C. luteola has its taxonomic delimitation established, and its occurrence is extended up to the northern Uruguay. The geographic distribution of C. riograndensis is reestablished, in view of three collections mentioned in the protologue are identified as belonging at others species. All species studied are described, illustrated through of photos, being presented data about geographic distribution, ecology and conservation. Keywords: Basin of Rio de La Plata; Bulbous; Ecology; Grasslands Ecosystems; Pampa Biome. RESUMO [Taxonomia, distribuição geográfica, conservação e limites entre as espécies no grupo de Calydorea azurea (Iridaceae: Tigridieae)]. Para este estudo foram feitas observações na natureza de populações de Calydorea azurea Klatt e táxons afins, ao longo dos ecossistemas campestres do entorno da Bacia do Prata, espaço geográfico onde se distri- bui o grupo em estudo. -

Vegetation Survey of the Yegua Knobbs Preserve
VEGETATION SURVEY OF THE YEGUA KNOBBS PRESERVE, BASTROP AND LEE COUNTIES, TEXAS by Diana K. Digges, B.A. A thesis submitted to the Graduate Council of Texas State University in partial fulfillment of the requirements for the degree of Master of Science with a Major in Biology August 2019 Committee Members: David E. Lemke, Chair Paula S. Williamson Sunethra Dharmasiri COPYRIGHT by Diana K. Digges 2019 FAIR USE AND AUTHOR’S PERMISSION STATEMENT Fair Use This work is protected by the Copyright Laws of the United States (Public Law 94-553, section 107). Consistent with fair use as defined in the Copyright Laws, brief quotations from this material are allowed with proper acknowledgement. Use of this material for financial gain without the author’s express written permission is not allowed. Duplication Permission As the copyright holder of this work I, Diana K. Digges, authorize duplication of this work, in whole or in part, for educational or scholarly purposes only. ACKNOWLEDGEMENTS I would like to thank my family and friends who have been understanding and patient as I pursued my degree. Your support has meant so much to me. A big thank you to my boyfriend, Swayam Shree, for his unwavering belief in me and for keeping me laughing. I am grateful to the Biology faculty at Texas State University, especially Drs. David Lemke, Paula Williamson, Sunethra Dharmasiri, and Garland Upchurch who helped me further my study of botany. A special thank you to Dr. Lemke for allowing me to pursue this project and his continued support during my time as a graduate student. -

AGS Seed List No 69 2020
Seed list No 69 2020-21 Garden Collected Seed 1001 Abelia floribunda 1057 Agrostemma githago 1002 Abies koreana 1058 Albuca canadensis (L. -

Fruit Trials
Crocosmia AGM by Roundtable FINAL Report 2016 © RHS Author Kirsty Angwin AGM round table coordinator, The Royal Horticultural Society Garden, Wisley, Woking, Surrey, GU23 6QB CROCOSMIA AGM Awards List 2016 AGM by roundtable discussion is a method of awarding AGM when the genus/ plant group in question displays any or all of the following criteria: impractical/ impossible to trial not in the trials plan for the next 5 years proposing plant committee does not contain the expertise to recommend ‘in house’ small number of plants to assess and has the following attributes: current lack of AGMs relevant to today’s gardener outside expertise is identified Present at Meetings: There were no meetings as this round table was conducted and completed by email. The Crocosmia forum was created by the RHS bulb plant committee to assess Crocosmia in 2016. Those on the forum were: Lady Christine Skelmersdale (Chairperson), Mr Bob Brown, Mr Jamie Blake, Mrs Elizabeth MacGregor, Mr Mark Fox, Mr Mark Walsh and Mr John Foley to assess a total of 73 Crocosmia cultivars. It was judged that the forum made up from the RHS Bulb committee, members of the RHS Herbaceous Committee, the National collection holder and nursery specialists had sufficient and comprehensive knowledge to arrive at a sound conclusion on the cultivars awarded. Criteria for voting included: Be available to the public Must be of outstanding excellence for garden decoration or use Good constitution Not require highly specialist growing conditions or care Not be particularly susceptible to any pest or disease Stable in form and colour The Panel recommended the Society's AWARD OF GARDEN MERIT to: Crocosmia x crocosmiiflora ‘Babylon’ Hardiness rating: H4 Description: Large deep orange flowers with a paler centre. -

Karyological Studies on Iris Japonica Thunb. and Its Allies1) 2) by K
180 Cytologia 10 Karyological Studies on Iris japonica Thunb. and Its Allies1) 2) By K. Yasui Tokyo Imperial University (With 8 text figures) Receic ed MTV 28, 1939 Introduction There are several karyological investigations on Iris japonica. KAZAO (1928) considered the sporophyte of this species as an auto triploid having 54 chromosomes. But SIMONET (1932, 1934) re ported I. japonica as a diploid plant with 34 chromosomes in its root-tip cells, and considered I. japonica var aphrodite as a hyper triploid and interpreted the chromosome constitution as 2n=51+3, the latter 3 chromosomes being considered as derived from 3 of 51 chromosomes in I. japonica by fragmentation which occurred att their median constrictions. The karyological investigation in I. japonica and the other 2 allied species, which were kindly put at my deposal by Dr. S. IMA MURA of Kyoto Imp. University, gave me some results different from those of the previous authors as is described below. Material and Method In the fixing of the root-tip cells both NAVASHIN's and LEWITSKY's solutions were used. When fixed in the latter, the chromosomes were found longer and slender than when fixed in the former solution, but there was no essential difference in the distribu tion of chromosomes in the equatorial plate. NEWTON'S gentian violet staining was generally adopted. Materials for the study of meiosis were fixed mostly with NAVASHIN'S fluid and stained with HEIDENHAIN'S iron-alum haematoxylin. Acetocarmine smears were also tried in the study of the pollen mother cells. Drawings were made with a camera lucida. -

Gelasine Uruguaiensis Ravenna Ssp. Uruguaiensis (Iridaceae- Tigridieae)
New Record in the Brazilian Flora: Gelasine uruguaiensis Ravenna ssp. uruguaiensis (Iridacea-Tigridieae) 215 New Record to the Brazilian Flora: Gelasine uruguaiensis Ravenna ssp. uruguaiensis (Iridaceae- Tigridieae ) Janaína Bonfada Rodriguez1, Tatiana Gonçalves de Lima 1 & Leonardo Paz Deble2 1 Universidade da Região da Campanha, Av. Tupy Silveira, 2099. CEP 96400-110, Bagé, RS, Brazil. janainab. [email protected], tfi [email protected] 2 Universidade Federal do Pampa, Rua 21 de Abril 80, CEP 96-450-000, Dom Pedrito, RS, Brazil. [email protected] Recebido em 01.II.2013. Aceito em 13.V.2014 ABSTRACT - Gelasine uruguaiensis Ravenna has two recognized subspecies: G. uruguaiensis ssp. uruguaiensis and G. uruguaiensis ssp. orientalis Ravenna. During sampling in the Aceguá municipality, Rio Grande do Sul, Brazil, the fi rst subspecies was found. G. uruguaiensis ssp. uruguaiensis is easily separeted from G. elongata (Graham) Ravenna by its style, which substantially surpasses the anthers, by the larger perigone diameter, and by spreading tepals, where the inner tepals are smaller than the outer tepals. Gelasine uruguaiensis ssp. uruguaiensis differs from G. uruguaiensis ssp. orientalis by its larger perigone, shape and larger outer tepals. The subspecies is described, illustrated, and the taxonomic affi nities and ecological data are discussed, with a map of the Brazilian geographical distribution. Key words: Pampa biome, Rio Grande do Sul , taxonomy RESUMO - Novo registro para a Flora Brasileira: Gelasine uruguaiensis Ravenna ssp. uruguaiensis (Iridaceae- Tigridieae ). Gelasine uruguaiensis Ravenna tem reconhecida duas subespécies G. uruguaiensis ssp. uruguaiensis e G. uruguaiensis ssp. orientalis Ravenna. Durante expedições de coleta no município de Aceguá, Rio Grande do Sul, Brasil, foi constatada a ocorrência da primeira subespécie. -

The New Kirstenbosch Bulb Terrace
- Growing indigenous Working with the seasons The new Kirstenbosch Bulb Terrace by Graham Duncan, Kirstenbosch Heavy winter rains, inadequately drained soils and insufficient winter light lev els experienced in many parts of Kirstenbosch preclude the display of a wide vari ety of our spectacular wealth of winter-growing bulbous plants in the garden itself. In addition, the depredations of molerats, and more importantly, marauding por cupines place further constraints on bulbs that can be displayed to the public. For these reasons the more fastidious species are cultivated under cover in the Kirstenbosch bulb nursery and displayed in containers, in season, inside the Kay Bergh Bulb House of the Botanical Society Conservatory. Although bulbous plants that are able to stand up to the rigours of general gar den cultivation are displayed in many parts of the garden, no section is specifical ly dedicated to bulbs. However, with the recent completion of the Centre for Home Gardening, an area known as the Bulb Terrace has been specifically provided for the display of both winter- and summer-growing bulbs. We hope these displays will draw attention to the many bulbous species suitable for home gardens. Passing through the Centre for Home Gardening towards the garden, the Bulb Terrace comprises eight broadly rectangular beds on either side of the sloping main bricked walkway adjacent to the new Kirstenbosch Tearoom. Four beds on each side of the walkway alternate with wooden benches. Quantities of heavy, poorly ABOVE: The dwarf Watsonia coccinea provides a brilliant splash of reddish-orange in mid-September. Photo Graham Duncan drained soil was removed from each bed. -
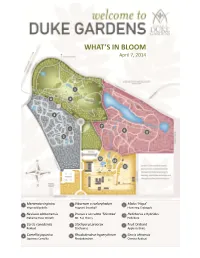
What's in Bloom
WHAT’S IN BLOOM April 7, 2014 5 4 6 2 7 1 9 8 3 12 10 11 1 Mertensia virginica 5 Viburnum x carlcephalum 9 Malus ‘Hopa’ Virginia Bluebells Fragrant Snowball Flowering Crabapple 2 Neviusia alabamensis 6 Prunus x serrulata ‘Shirotae’ 10 Helleborus x hybridus Alabama Snow Wreath Mt. Fuji Cherry Hellebore 3 Cercis canadensis 7 Stachyurus praecox 11 Fruit Orchard Redbud Stachyurus Apple cultivars 4 Camellia japonica 8 Rhododendron hyperythrum 12 Cercis chinensis Japanese Camellia Rhododendron Chinese Redbud WHAT’S IN BLOOM April 7, 2014 BLOMQUIST GARDEN OF NATIVE PLANTS Amelanchier arborea Common Serviceberry Sanguinaria canadensis Bloodroot Cornus florida Flowering Dogwood Stylophorum diphyllum Celandine Poppy Thalictrum thalictroides Rue Anemone Fothergilla major Fothergilla Trillium decipiens Chattahoochee River Trillium Hepatica nobilis Hepatica Trillium grandiflorum White Trillium Hexastylis virginica Wild Ginger Hexastylis minor Wild Ginger Trillium pusillum Dwarf Wakerobin Illicium floridanum Florida Anise Tree Trillium stamineum Blue Ridge Wakerobin Malus coronaria Sweet Crabapple Uvularia sessilifolia Sessileleaf Bellwort Mertensia virginica Virginia Bluebells Pachysandra procumbens Allegheny spurge Prunus americana American Plum DORIS DUKE CENTER GARDENS Camellia japonica Japanese Camellia Pulmonaria ‘Diana Clare’ Lungwort Cercis canadensis Redbud Prunus persica Flowering Peach Puschkinia scilloides Striped Squill Cercis chinensis Redbud Sanguinaria canadensis Bloodroot Clematis armandii Evergreen Clematis Spiraea prunifolia Bridalwreath -

Narcissus Viridiflorus
32] PLANT LIFE 1953 NARCISSUS VIRIDIFLORUS HAMILTON P. TRAUB, California Several years ago Jan de Graaff kindly sent the writer three small seedling bulbs of Narcissus viridiflorus Schousb. These were potted in a mixture of one part each of clayey loam soil, coarse sand and black earex peat. These plants were watered regularly and fertilized with Vigoro (at fortnightly intervals) from September through April, and -Ner ' . A Fig. 3. ,\arctssits vindillortis. Left, seedlings; note single leaves of two seedlings not in flower, and inflorescence of center seedling without a leaf. The top of this same inflorescence is shown in natural size to the right. were kept entirely dry in the pot from May through August. The plants did not flower during the first two years but one bulb flowered in the fall of the third year as shown in Fig. 3. The following year all three bulbs flowered. The flowers are entirely green and give off a delightful frag- rance that can be detected over a wide area. It is a very charming sub- ject which should be more widely cultivated. In the Southwest, par- II:ERBERTIA EDITION [33 tieularly in California, the species thrives out of doors and blooms mularly in the fall. Unfortunately, sufficient stock is not as yet avail- able_ but it is hoped that before long this deficiency will be corrected by the commercial growers. It may be that this species can be used in breeding experiments. Such attempts will be started by the writer during the season 1953-1954. This may not be an easy project but is surely worth trying. -

Riqueza Y Distribución Geográfica De La Tribu Tigridieae
Disponible en www.sciencedirect.com Revista Mexicana de Biodiversidad Revista Mexicana de Biodiversidad 86 (2015) 80-98 www.ib.unam.mx/revista/ Biogeografía Riqueza y distribución geográfica de la tribu Tigridieae (Iridaceae) en Norteamérica Richness and geographic distribution of the tribe Tigridieae (Iridaceae) in North America Guadalupe Munguía-Linoa,c, Georgina Vargas-Amadoa, Luis Miguel Vázquez-Garcíab y Aarón Rodrígueza,* a Instituto de Botánica, Departamento de Botánica y Zoología, Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara, Apartado postal 139, 45105 Zapopan, Jalisco, México b Centro Universitario Tenancingo, Universidad Autónoma del Estado de México, Ex Hacienda de Santa Ana, Km 1.5 carretera Tenancingo-Villa Guerrero, 52400 Tenancingo, Estado de México, México c Doctorado en Ciencias en Biosistemática, Ecología y Manejo de Recursos Naturales y Agrícolas, Universidad de Guadalajara, Apartado postal 139, 45105 Zapopan, Jalisco, México Recibido el 28 de enero de 2014; aceptado el 24 de octubre de 2014 Resumen La tribu Tigridieae (Iridoideae: Iridaceae) es un grupo americano y monofilético. Sus centros de diversificación se localizan en México y la parte andina de Sudamérica. El objetivo del presente trabajo fue analizar la riqueza y distribución de Tigridieae en Norteamérica. Para ello, se utilizó una base de datos con 2,769 registros georreferenciados. Mediante sistemas de información geográfica (SIG) se analizó la riqueza deTigridieae por división política, ecorregión y una cuadrícula de 45×45 km. Tigridieae está representada por 66 especies y 7 subespecies. De estas, 54 especies y 7 subespecies son endémicas. Tigridia es el género más diverso con 43 especies y 6 subespecies. La riqueza de taxa se concentra en México en los estados de Oaxaca, México y Jalisco. -

Illustrated Flora of East Texas Illustrated Flora of East Texas
ILLUSTRATED FLORA OF EAST TEXAS ILLUSTRATED FLORA OF EAST TEXAS IS PUBLISHED WITH THE SUPPORT OF: MAJOR BENEFACTORS: DAVID GIBSON AND WILL CRENSHAW DISCOVERY FUND U.S. FISH AND WILDLIFE FOUNDATION (NATIONAL PARK SERVICE, USDA FOREST SERVICE) TEXAS PARKS AND WILDLIFE DEPARTMENT SCOTT AND STUART GENTLING BENEFACTORS: NEW DOROTHEA L. LEONHARDT FOUNDATION (ANDREA C. HARKINS) TEMPLE-INLAND FOUNDATION SUMMERLEE FOUNDATION AMON G. CARTER FOUNDATION ROBERT J. O’KENNON PEG & BEN KEITH DORA & GORDON SYLVESTER DAVID & SUE NIVENS NATIVE PLANT SOCIETY OF TEXAS DAVID & MARGARET BAMBERGER GORDON MAY & KAREN WILLIAMSON JACOB & TERESE HERSHEY FOUNDATION INSTITUTIONAL SUPPORT: AUSTIN COLLEGE BOTANICAL RESEARCH INSTITUTE OF TEXAS SID RICHARDSON CAREER DEVELOPMENT FUND OF AUSTIN COLLEGE II OTHER CONTRIBUTORS: ALLDREDGE, LINDA & JACK HOLLEMAN, W.B. PETRUS, ELAINE J. BATTERBAE, SUSAN ROBERTS HOLT, JEAN & DUNCAN PRITCHETT, MARY H. BECK, NELL HUBER, MARY MAUD PRICE, DIANE BECKELMAN, SARA HUDSON, JIM & YONIE PRUESS, WARREN W. BENDER, LYNNE HULTMARK, GORDON & SARAH ROACH, ELIZABETH M. & ALLEN BIBB, NATHAN & BETTIE HUSTON, MELIA ROEBUCK, RICK & VICKI BOSWORTH, TONY JACOBS, BONNIE & LOUIS ROGNLIE, GLORIA & ERIC BOTTONE, LAURA BURKS JAMES, ROI & DEANNA ROUSH, LUCY BROWN, LARRY E. JEFFORDS, RUSSELL M. ROWE, BRIAN BRUSER, III, MR. & MRS. HENRY JOHN, SUE & PHIL ROZELL, JIMMY BURT, HELEN W. JONES, MARY LOU SANDLIN, MIKE CAMPBELL, KATHERINE & CHARLES KAHLE, GAIL SANDLIN, MR. & MRS. WILLIAM CARR, WILLIAM R. KARGES, JOANN SATTERWHITE, BEN CLARY, KAREN KEITH, ELIZABETH & ERIC SCHOENFELD, CARL COCHRAN, JOYCE LANEY, ELEANOR W. SCHULTZE, BETTY DAHLBERG, WALTER G. LAUGHLIN, DR. JAMES E. SCHULZE, PETER & HELEN DALLAS CHAPTER-NPSOT LECHE, BEVERLY SENNHAUSER, KELLY S. DAMEWOOD, LOGAN & ELEANOR LEWIS, PATRICIA SERLING, STEVEN DAMUTH, STEVEN LIGGIO, JOE SHANNON, LEILA HOUSEMAN DAVIS, ELLEN D.