Pdf/Rbbio/V58n4/V58n4a1.Pdf>
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

To Next File: Sfc260a.Pdf
Appendix 1 FISH SPECIES IDENTIFIED FROM THE COASTAL EAST CAPE REGION Surveys of the East Cape Region (Bay of Plenty and East Coast) were conducted during 1992, 1993, and 1999 (see Tables 1, 2, and 4 for locality data), with additional records from the National Fish Collection. FAMILY, SPECIES, AND AUTHORITY COMMON NAME STATIONS Lamnidae Isurus oxyrinchus Rafinesque mako shark (P) E20o Squalidae Squalus mitsukurii Jordon & Snyder piked spurdog (D) W Dasyatidae Dasyatis brevicaudata (Hutton) shorttailed stingray E19o Myliobatidae eMyliobatis tenuicaudatus (Hector) eagle ray E03° Anguillidae Anguilla australis Richardson shortfin eel (F) W eAnguilla dieffenbachii Gray longfin eel (F) W Muraenidae Gymnothorax prasinus (Richardson) yellow moray E05o, E08° Ophichthyidae Scolecenchelys australis (MacLeay) shortfinned worm eel E01, E10, E11, E28, E29, E33, E48 Congridae Conger verreauxi Kaup southern conger eel E03, E07, E09, E12°, E13, E16, E18, E22o, E23o, E25o, E31, E33 Conger wilsoni (Bloch & Schneider) northern conger eel W; E05, E09, E12, E27 Conger sp. conger E01°, E31o Engraulidae Engraulis australis (White) anchovy (P) E Clupeidae Sardinops neopilchardus (Steindachner) pilchard (P) E Gonorynchidae Gonorynchus forsteri Ogilby sandfish (D) E Retropinnidae eRetropinna retropinna (Richardson) smelt (F) W; E Galaxiidae Galaxias maculatus (Jenyns) inanga (F) W; E Bythitidae eBidenichthys beeblebroxi Paulin grey brotula E01, E03, E08, E09, E10, E12, E18, E19, E21, E23, E27, E28, E29, E31, E33, E34 eBrosmodorsalis persicinus Paulin & Roberts pink brotula E02, E07, E10°, E18, E22, E29, E31, E33o eDermatopsis macrodon Ogilby fleshfish E08, E31 Moridae Austrophycis marginata (Günther) dwarf cod (D) E Continued next page > e = NZ endemic species. D = deepwater species (> 50 m depth); E = estuarine species; F = freshwater species; P = pelagic species; U = species of uncertain identity. -

New Zealand Fishes a Field Guide to Common Species Caught by Bottom, Midwater, and Surface Fishing Cover Photos: Top – Kingfish (Seriola Lalandi), Malcolm Francis
New Zealand fishes A field guide to common species caught by bottom, midwater, and surface fishing Cover photos: Top – Kingfish (Seriola lalandi), Malcolm Francis. Top left – Snapper (Chrysophrys auratus), Malcolm Francis. Centre – Catch of hoki (Macruronus novaezelandiae), Neil Bagley (NIWA). Bottom left – Jack mackerel (Trachurus sp.), Malcolm Francis. Bottom – Orange roughy (Hoplostethus atlanticus), NIWA. New Zealand fishes A field guide to common species caught by bottom, midwater, and surface fishing New Zealand Aquatic Environment and Biodiversity Report No: 208 Prepared for Fisheries New Zealand by P. J. McMillan M. P. Francis G. D. James L. J. Paul P. Marriott E. J. Mackay B. A. Wood D. W. Stevens L. H. Griggs S. J. Baird C. D. Roberts‡ A. L. Stewart‡ C. D. Struthers‡ J. E. Robbins NIWA, Private Bag 14901, Wellington 6241 ‡ Museum of New Zealand Te Papa Tongarewa, PO Box 467, Wellington, 6011Wellington ISSN 1176-9440 (print) ISSN 1179-6480 (online) ISBN 978-1-98-859425-5 (print) ISBN 978-1-98-859426-2 (online) 2019 Disclaimer While every effort was made to ensure the information in this publication is accurate, Fisheries New Zealand does not accept any responsibility or liability for error of fact, omission, interpretation or opinion that may be present, nor for the consequences of any decisions based on this information. Requests for further copies should be directed to: Publications Logistics Officer Ministry for Primary Industries PO Box 2526 WELLINGTON 6140 Email: [email protected] Telephone: 0800 00 83 33 Facsimile: 04-894 0300 This publication is also available on the Ministry for Primary Industries website at http://www.mpi.govt.nz/news-and-resources/publications/ A higher resolution (larger) PDF of this guide is also available by application to: [email protected] Citation: McMillan, P.J.; Francis, M.P.; James, G.D.; Paul, L.J.; Marriott, P.; Mackay, E.; Wood, B.A.; Stevens, D.W.; Griggs, L.H.; Baird, S.J.; Roberts, C.D.; Stewart, A.L.; Struthers, C.D.; Robbins, J.E. -

Geographic Variation in the Central Pacific Halfbeak, Hyporhamphus Acutus (Gunther)I
Pacific Science (1974), Vol. 28, No.2, p. 111-122 Printed in Great Britain Geographic Variation in the Central Pacific Halfbeak, Hyporhamphus acutus (Gunther)I BRUCE B. COLLETTE2 ABSTRACT: Ifyporhamphus acutus (GUnther) is distinguished from other Central Pacific species ofHyporhamphus by its long upper jaw, long anal fin base (longer than dorsal base), and shape of its preorbital lateral line canal. Two subspecies are recognized: Ifyporhamphus acutus acutus (Gunther) with fewer vertebrae and fin rays inhabits the chain of idands from Wake Island and the Marshall Islands in the northwest to the Tuamotu Archipelago and Easter Island in the southeast; Ifyporhamphus acutus paciftcus (Steindachner) with more vertebrae and fin rays is found in the Hawaiian Islands and at Johnston Island. Hemiramphus furcatus Philippi from Easter Island and Odontorhamphus chancellori Weed from the Cook Islands are placed in the synonymy of Ifyporhamphus acutus acutus. THE SYSTEMATICS of the Central Pacific species lateral line canal; and the following eight mea ofhalfbeaks are badly confused; the purpose of surements: lower jaw length, head length, this paper is to eliminate this confusion for one distance from pectoral fin origin to pelvic fin species, Ifyporhamphus acutus. Further studies origin, distance from pelvic fin origin to caudal are in progress to solve the systematic problems fin base, length of dorsal and anal fin bases, and of the nominal species Ifyporhamphus aifinis maximum body depth and width. Frequency (Gunther), Ifyporhamphus laticeps (Gunther), and distributions of meristic characters were com Hyporhamphus dussumieri (Valenciennes). Austra pared geographically, byisland groups. Sketches lian populations of Ifyporhamphus aifinis and ofpreorbital canals were made ofsamples from Hyporhamphus dussumieri are dealt with in a each island group and compared. -

Intrinsic Vulnerability in the Global Fish Catch
The following appendix accompanies the article Intrinsic vulnerability in the global fish catch William W. L. Cheung1,*, Reg Watson1, Telmo Morato1,2, Tony J. Pitcher1, Daniel Pauly1 1Fisheries Centre, The University of British Columbia, Aquatic Ecosystems Research Laboratory (AERL), 2202 Main Mall, Vancouver, British Columbia V6T 1Z4, Canada 2Departamento de Oceanografia e Pescas, Universidade dos Açores, 9901-862 Horta, Portugal *Email: [email protected] Marine Ecology Progress Series 333:1–12 (2007) Appendix 1. Intrinsic vulnerability index of fish taxa represented in the global catch, based on the Sea Around Us database (www.seaaroundus.org) Taxonomic Intrinsic level Taxon Common name vulnerability Family Pristidae Sawfishes 88 Squatinidae Angel sharks 80 Anarhichadidae Wolffishes 78 Carcharhinidae Requiem sharks 77 Sphyrnidae Hammerhead, bonnethead, scoophead shark 77 Macrouridae Grenadiers or rattails 75 Rajidae Skates 72 Alepocephalidae Slickheads 71 Lophiidae Goosefishes 70 Torpedinidae Electric rays 68 Belonidae Needlefishes 67 Emmelichthyidae Rovers 66 Nototheniidae Cod icefishes 65 Ophidiidae Cusk-eels 65 Trachichthyidae Slimeheads 64 Channichthyidae Crocodile icefishes 63 Myliobatidae Eagle and manta rays 63 Squalidae Dogfish sharks 62 Congridae Conger and garden eels 60 Serranidae Sea basses: groupers and fairy basslets 60 Exocoetidae Flyingfishes 59 Malacanthidae Tilefishes 58 Scorpaenidae Scorpionfishes or rockfishes 58 Polynemidae Threadfins 56 Triakidae Houndsharks 56 Istiophoridae Billfishes 55 Petromyzontidae -
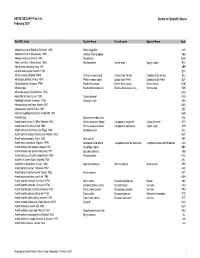
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste -

Hemiramphidae Gill 1859 Halfbeaks
ISSN 1545-150X California Academy of Sciences A N N O T A T E D C H E C K L I S T S O F F I S H E S Number 22 February 2004 Family Hemiramphidae Gill 1859 halfbeaks By Bruce B. Collette National Marine Fisheries Service Systematics Laboratory National Museum of Natural History, Washington, DC 20560–0153, U.S.A. email: [email protected] The Hemiramphidae, the halfbeaks, is one of five families of the order Beloniformes (Rosen and Parenti 1981 [ref. 5538]). The family name is based on Hemiramphus Cuvier 1816 [ref. 993], but many authors have misspelled the genus as Hemirhamphus and the family name as Hemirhamphidae (although the other genera in the family do have the extra h; e.g., Arrhamphus, Euleptorhamphus, Hyporhamphus, Oxypo- rhamphus, and Rhynchorhamphus). The family contains two subfamilies, 14 genera and subgenera, and 117 species and subspecies. It is the sister-group of the Exocoetidae, the flyingfishes, forming the super- family Exocoetoidea (Collette et al. 1984 [ref. 11422]). Most halfbeaks have an elongate lower jaw that distinguishes them from the flyingfishes (Exocoetidae), which have lost the elongate lower jaw, and from the needlefishes (Belonidae) and sauries (Scomberesocidae), which have both jaws elongate. The Hemi- ramphidae is defined by one derived character: the third pair of upper pharyngeal bones are anklylosed into a plate. Other diagnostic characters include: pectoral fins short or moderately long; premaxillae pointed anteriorly, forming a triangular upper jaw (except in Oxyporhamphus); lower jaw elongate in juveniles of all genera, adults of most genera; parapophyses forked; and swim bladder not extending into the haemal canal. -

(Hemiramphidae) of Australia and New Zealand
AUSTRALIAN MUSEUM SCIENTIFIC PUBLICATIONS Collette, Bruce B., 1974. The garfishes (Hemiramphidae) of Australia and New Zealand. Records of the Australian Museum 29(2): 11–105. [12 March 1974]. doi:10.3853/j.0067-1975.29.1974.231 ISSN 0067-1975 Published by the Australian Museum, Sydney naturenature cultureculture discover discover AustralianAustralian Museum Museum science science is is freely freely accessible accessible online online at at www.australianmuseum.net.au/publications/www.australianmuseum.net.au/publications/ 66 CollegeCollege Street,Street, SydneySydney NSWNSW 2010,2010, AustraliaAustralia THE GARFISHES (HEMIRAMPHIDAE) OF AUSTRALIA AND NEW ZEALAND By BRUCE B. COLLETTE National Marine Fisheries Service Systematics Laboratory, U.S. National Museum> Washington, D.C., 20560, U.S.A. Figures 1-23 Manuscript received, 21St June, 1972 SUMMARY Twenty species and subspecies of garfishes are recognized from Australian and New Zealand waters: Arrhamphus s. sclerolepis, A. s. krefftii, Euleptorhamphus viridis, Hemiramphus far, He. robv.stus, Hyporhamphus r. regularis, By. r. ardelio, Hy. neglectus, /f.y. australis, Hy. melanochir, Hy. ihi, lfy. quoyi, Hy. affinis, Hy. dussumieri, Rhynchorhamphus georgii, Zenarchopterus buffonis, Z. caudovittatus, Z. dispar, Z. gilli, and Z. rasori. Reporhamphus is considered a synonym of If.yporhamphus; Farhians and Ardeapiscis are considered synonyms of Hemiramphus; and Lofigorhamphus a synonym of R~ynchorhamphus. Hemiramphus welsbyi is a synonym of He. robustus. The eastern river garfish (Byporhamphv.s ardelio) is reduced to a subspecies of the western river garfish (Hy. regularis). The New South Wales-southern Queensland population of the snub-nosed garfish (Arrhamphus sclerolepis) is considered a subspecies (A. s. krejJtii) of the northern A. s. sclerolepis. -

A Literature Review on the Poor Knights Islands Marine Reserve
A literature review on the Poor Knights Islands Marine Reserve Carina Sim-Smith Michelle Kelly 2009 Report prepared by the National Institute of Water & Atmospheric Research Ltd for: Department of Conservation Northland Conservancy PO Box 842 149-151 Bank Street Whangarei 0140 New Zealand Cover photo: Schooling pink maomao at Northern Arch Photo: Kent Ericksen Sim-Smith, Carina A literature review on the Poor Knights Islands Marine Reserve / Carina Sim-Smith, Michelle Kelly. Whangarei, N.Z: Dept. of Conservation, Northland Conservancy, 2009. 112 p. : col. ill., col. maps ; 30 cm. Print ISBN: 978-0-478-14686-8 Web ISBN: 978-0-478-14687-5 Report prepared by the National Institue of Water & Atmospheric Research Ltd for: Department of Conservation, Northland Conservancy. Includes bibliographical references (p. 67 -74). 1. Marine parks and reserves -- New Zealand -- Poor Knights Islands. 2. Poor Knights Islands Marine Reserve (N.Z.) -- Bibliography. I. Kelly, Michelle. II. National Institute of Water and Atmospheric Research (N.Z.) III. New Zealand. Dept. of Conservation. Northland Conservancy. IV. Title. C o n t e n t s Executive summary 1 Introduction 3 2. The physical environment 5 2.1 Seabed geology and bathymetry 5 2.2 Hydrology of the area 7 3. The biological marine environment 10 3.1 Intertidal zonation 10 3.2 Subtidal zonation 10 3.2.1 Subtidal habitats 10 3.2.2 Subtidal habitat mapping (by Jarrod Walker) 15 3.2.3 New habitat types 17 4. Marine flora 19 4.1 Intertidal macroalgae 19 4.2 Subtidal macroalgae 20 5. The Invertebrates 23 5.1 Protozoa 23 5.2 Zooplankton 23 5.3 Porifera 23 5.4 Cnidaria 24 5.5 Ectoprocta (Bryozoa) 25 5.6 Brachiopoda 26 5.7 Annelida 27 5.8. -

Fisheries Resources in Otago Harbour and on the Adjacent Coast
Fisheries resources in Otago Harbour and on the adjacent coast Prepared for Port Otago Limited December 2008 R O Boyd Boyd Fisheries Consultants Ltd 1 Baker Grove Wanaka 9305 NEW ZEALAND Table of Contents Table of Contents i List of Tables and Figures ii Executive Summary iii Fisheries resources in Otago Harbour and on the adjacent coast 1 (Ver 1 – Preliminary) 1 1. Introduction 1 2. Methods 2 2.1. The Fisheries Literature 2 2.2. Fisheries catch and effort data 2 2.3. Consultation with the Fisheries Sector (this section to be revised following further consultation) 2 3. The Fisheries Environments of Otago Harbour and Coastal Otago 3 3.1. Otago Harbour 3 3.2. Coastal Otago 3 4. Fish and Shellfish Fauna of Otago Harbour and Coastal Otago 5 4.1. Otago Harbour 5 4.2. Coastal Otago 6 4.3. Regional and National Significance 7 5. Areas of Importance for Spawning, Egg Laying or Juveniles 8 6. Fisheries Uses of Otago Harbour and Coastal Otago 9 6.1. Recreational Fisheries 9 6.1.1. Otago Harbour 9 6.1.2. Coastal Otago 10 6.2. Commercial Fisheries 10 6.2.1. History and Background to the Commercial Fishery 10 6.2.2. Commercial Fisheries Catch and Effort Data 11 6.2.3. Overview of the Present Otago Commercial Fishery 12 6.2.4. Otago’s Inshore Fisheries 13 Trawl fishery 13 Set net fishery 14 Cod potting 14 Line fishing 14 Paua and kina diving 14 Queen scallops 15 Rock lobster 15 Cockles 15 6.3. Customary Fisheries (this section to be revised following further consultation) 16 7. -

Great Barrier Island Marine Reserve Application to Be Notified
Aotea (Great Barrier) Marine Reserve Application An application by the Director-General of Conservation AUCKLAND CONSERVANCY JULY 2004 Published by Auckland Conservancy Department of Conservation Private Bag 68-908 Newton Auckland New Zealand Cover photo: Aerial view of Great Barrier Island’s north-east coast Photo: Graeme Brierly ISBN 0-478-22587-3 CROWN COPYRIGHT 2 Contents 1. Introduction........................................................................................5 1.1 APPLICATION FOR A MARINE RESERVE AT GREAT BARRIER ISLAND .....5 1.2 PURPOSE OF MARINE RESERVES ................................................................5 1.3 ROLE OF THE DIRECTOR-GENERAL OF CONSERVATION.........................5 1.4 PROCESS FOR ESTABLISHING A MARINE RESERVE ...................................5 1.5 RESPONSES INVITED ...................................................................................5 2. The Application ..................................................................................7 2.1 THE APPLICANT ..........................................................................................7 2.2 LOCATION ...................................................................................................7 2.3 NAME............................................................................................................7 2.4 OBJECTIVE ...................................................................................................7 2.5 BOUNDARIES ...............................................................................................7 -

Lunge Feeding in Early Marine Reptiles and Fast Evolution
OPEN Lunge feeding in early marine reptiles SUBJECT AREAS: and fast evolution of marine tetrapod PALAEONTOLOGY feeding guilds PALAEOECOLOGY Ryosuke Motani1, Xiao-hong Chen2, Da-yong Jiang3, Long Cheng2, Andrea Tintori4 & Olivier Rieppel5 Received 28 October 2014 1Department of Earth and Planetary Sciences, University of California, Davis, One Shields Avenue, Davis, California 95616, U.S.A., 2 3 Accepted Wuhan Centre of China Geological Survey, Wuhan, Hubei 430023, P. R. China, Laboratory of Orogenic Belt and Crustal Evolution, Ministry of Education; Department of Geology and Geological Museum, Peking University, Yiheyuan Street. 5, Beijing 2 February 2015 4 100871, P.R. China, Dipartimento di Scienze della Terra, Universita` degli Studi di Milano, Via Mangiagalli 34-20133 Milano, 5 Published Italy, Center of Integrative Research, The Field Museum, Chicago, IL 60605-2496, U.S.A. 10 March 2015 Traditional wisdom holds that biotic recovery from the end-Permian extinction was slow and gradual, and was not complete until the Middle Triassic. Here, we report that the evolution of marine predator feeding Correspondence and guilds, and their trophic structure, proceeded faster. Marine reptile lineages with unique feeding requests for materials adaptations emerged during the Early Triassic (about 248 million years ago), including the enigmatic Hupehsuchus that possessed an unusually slender mandible. A new specimen of this genus reveals a should be addressed to well-preserved palate and mandible, which suggest that it was a rare lunge feeder as also occurs in rorqual R.M. (rmotani@ whales and pelicans. The diversity of feeding strategies among Triassic marine tetrapods reached their peak ucdavis.edu) or X.-H.C. -

Land-Based Effects on Coastal Fisheries and Supporting Biodiversity in New Zealand
A review of land-based effects on coastal fisheries and supporting biodiversity in New Zealand M. A. Morrison M. L. Lowe D. M. Parsons N. R. Usmar I. M. McLeod New Zealand Aquatic Environment and Biodiversity Report No. 37 2009 A review of land-based effects on coastal fisheries and supporting biodiversity in New Zealand M. A. Morrison1 M. L. Lowe1,2 D. M. Parsons1 N. R. Usmar2 I. M. McLeod2 1NIWA Private Bag 99940 Newmarket Auckland 1149 2Leigh Marine Laboratory P O Box 349 Warkworth 0910 New Zealand Aquatic Environment and Biodiversity Report No. 37 2009 Published by Ministry of Fisheries Wellington 2009 ISSN 1176-9440 © Ministry of Fisheries 2009 Citation: Morrison, M.A.; Lowe, M.L.; Parsons, D.M.; Usmar, N.R.; McLeod, I.M. (2009). A review of land-based effects on coastal fisheries and supporting biodiversity in New Zealand. New Zealand Aquatic Environment and Biodiversity Report No. 37. 100 p. This series continues the Marine Biodiversity Biosecurity Report series which ceased with No. 7 in February 2005. EXECUTIVE SUMMARY Morrison, M.A.; Lowe, M.L.; Parsons, D.M.; Usmar, N.R.; McLeod, I.M. (2009). A review of land-based effects on coastal fisheries and supporting biodiversity in New Zealand. New Zealand Aquatic Environment and Biodiversity Report No. 37. 100 p. Land-based effects on coastal fisheries may occur through a diversity of mechanisms. Changing inputs from the land have included large volumes of suspended sediments and nutrients into the coastal zone, following large-scale clearances of New Zealand’s forests, and the expansion of land-based industries such as pastoral livestock farming, dairying, and exotic plantation forestry.