Mayla Steiner Toi.Pdf
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

The Recent Molluscan Marine Fauna of the Islas Galápagos
THE FESTIVUS ISSN 0738-9388 A publication of the San Diego Shell Club Volume XXIX December 4, 1997 Supplement The Recent Molluscan Marine Fauna of the Islas Galapagos Kirstie L. Kaiser Vol. XXIX: Supplement THE FESTIVUS Page i THE RECENT MOLLUSCAN MARINE FAUNA OF THE ISLAS GALApAGOS KIRSTIE L. KAISER Museum Associate, Los Angeles County Museum of Natural History, Los Angeles, California 90007, USA 4 December 1997 SiL jo Cover: Adapted from a painting by John Chancellor - H.M.S. Beagle in the Galapagos. “This reproduction is gifi from a Fine Art Limited Edition published by Alexander Gallery Publications Limited, Bristol, England.” Anon, QU Lf a - ‘S” / ^ ^ 1 Vol. XXIX Supplement THE FESTIVUS Page iii TABLE OF CONTENTS INTRODUCTION 1 MATERIALS AND METHODS 1 DISCUSSION 2 RESULTS 2 Table 1: Deep-Water Species 3 Table 2: Additions to the verified species list of Finet (1994b) 4 Table 3: Species listed as endemic by Finet (1994b) which are no longer restricted to the Galapagos .... 6 Table 4: Summary of annotated checklist of Galapagan mollusks 6 ACKNOWLEDGMENTS 6 LITERATURE CITED 7 APPENDIX 1: ANNOTATED CHECKLIST OF GALAPAGAN MOLLUSKS 17 APPENDIX 2: REJECTED SPECIES 47 INDEX TO TAXA 57 Vol. XXIX: Supplement THE FESTIVUS Page 1 THE RECENT MOLLUSCAN MARINE EAUNA OE THE ISLAS GALAPAGOS KIRSTIE L. KAISER' Museum Associate, Los Angeles County Museum of Natural History, Los Angeles, California 90007, USA Introduction marine mollusks (Appendix 2). The first list includes The marine mollusks of the Galapagos are of additional earlier citations, recent reported citings, interest to those who study eastern Pacific mollusks, taxonomic changes and confirmations of 31 species particularly because the Archipelago is far enough from previously listed as doubtful. -

Register 2010-2019
Impressum Verantwortlich i.S.d.P.: Dr. MANFRED HERRMANN, Rosdorf und die Redaktion Herausgegeben vom Club Conchylia e.V., Öhringen, Deutschland Vorstand des Club Conchylia: 1. Vorsitzender 2. Vorsitzender Schatzmeister Dr. MANFRED HERRMANN, Ulmenstrasse 14 ROLAND GÜNTHER, Blücherstrasse 15 STEFFEN FRANKE, Geistenstraße 24 D-37124 Rosdorf D-40477 Düsseldorf D-40476 Düsseldorf Tel.: 0049-(0)551-72055; Fax. -72099 Tel.: 0049-(0)211-6007827 Tel 0049-(0)211 - 514 20 81 E-Mail: [email protected] E-Mail: [email protected] E-Mail: [email protected] Regionale Vorstände: Norddeutschland: Westdeutschland: Süddeutschland: Dr. VOLLRATH WIESE, Hinter dem Kloster 42 kommissarisch durch den 2. Vorsitzenden INGO KURTZ, Prof.-Kneib-Str. 10 D-23743 Cismar ROLAND GÜNTHER (siehe oben) D-55270 Zornheim Tel. / Fax: 0049-(0 )4366-1288 Tel.: 0049-(0)6136-758750 E-Mail: [email protected] E-Mail: [email protected] Ostdeutschland: Schweiz: PEER SCHEPANSKI, Am Grünen Hang 23 FRANZ GIOVANOLI, Gstaadmattstr. 13 D-09577 Niederwiesa CH-4452 Itingen Tel.: 0049 (0)1577-517 44 03 Tel.: 0041- 61- 971 15 48 E-Mail: [email protected] E-Mail: [email protected] Redaktion Conchylia + Acta Conchyliorum: Redaktion Club Conchylia Mitteilungen: KLAUS GROH ROLAND HOFFMANN Hinterbergstr. 15 Eichkoppelweg 14a D-67098 Bad Dürkheim D-24119 Kronshagen Tel.: 0049-(0)6322-988 70 68 Tel.: 0049-(0)431-583 68 81 E-Mail: [email protected] E-Mail: [email protected] Bank-Konto des Club Conchylia e.V.: Volksbank Mitte eG, Konto Nr. : 502 277 00, Bankleitzahl: 260 612 91; Intern. Bank-Acc.-Nr (IBAN): DE77 2606 1291 0050 2277 00 Bank Identifier Code (BIC): GENODEF1DUD; Club-home-page: www.club-conchylia.de (Dr. -

South Carolina Department of Natural Resources
FOREWORD Abundant fish and wildlife, unbroken coastal vistas, miles of scenic rivers, swamps and mountains open to exploration, and well-tended forests and fields…these resources enhance the quality of life that makes South Carolina a place people want to call home. We know our state’s natural resources are a primary reason that individuals and businesses choose to locate here. They are drawn to the high quality natural resources that South Carolinians love and appreciate. The quality of our state’s natural resources is no accident. It is the result of hard work and sound stewardship on the part of many citizens and agencies. The 20th century brought many changes to South Carolina; some of these changes had devastating results to the land. However, people rose to the challenge of restoring our resources. Over the past several decades, deer, wood duck and wild turkey populations have been restored, striped bass populations have recovered, the bald eagle has returned and more than half a million acres of wildlife habitat has been conserved. We in South Carolina are particularly proud of our accomplishments as we prepare to celebrate, in 2006, the 100th anniversary of game and fish law enforcement and management by the state of South Carolina. Since its inception, the South Carolina Department of Natural Resources (SCDNR) has undergone several reorganizations and name changes; however, more has changed in this state than the department’s name. According to the US Census Bureau, the South Carolina’s population has almost doubled since 1950 and the majority of our citizens now live in urban areas. -

ABSTRACT Title of Dissertation: PATTERNS IN
ABSTRACT Title of Dissertation: PATTERNS IN DIVERSITY AND DISTRIBUTION OF BENTHIC MOLLUSCS ALONG A DEPTH GRADIENT IN THE BAHAMAS Michael Joseph Dowgiallo, Doctor of Philosophy, 2004 Dissertation directed by: Professor Marjorie L. Reaka-Kudla Department of Biology, UMCP Species richness and abundance of benthic bivalve and gastropod molluscs was determined over a depth gradient of 5 - 244 m at Lee Stocking Island, Bahamas by deploying replicate benthic collectors at five sites at 5 m, 14 m, 46 m, 153 m, and 244 m for six months beginning in December 1993. A total of 773 individual molluscs comprising at least 72 taxa were retrieved from the collectors. Analysis of the molluscan fauna that colonized the collectors showed overwhelmingly higher abundance and diversity at the 5 m, 14 m, and 46 m sites as compared to the deeper sites at 153 m and 244 m. Irradiance, temperature, and habitat heterogeneity all declined with depth, coincident with declines in the abundance and diversity of the molluscs. Herbivorous modes of feeding predominated (52%) and carnivorous modes of feeding were common (44%) over the range of depths studied at Lee Stocking Island, but mode of feeding did not change significantly over depth. One bivalve and one gastropod species showed a significant decline in body size with increasing depth. Analysis of data for 960 species of gastropod molluscs from the Western Atlantic Gastropod Database of the Academy of Natural Sciences (ANS) that have ranges including the Bahamas showed a positive correlation between body size of species of gastropods and their geographic ranges. There was also a positive correlation between depth range and the size of the geographic range. -

Western Australian Maritime Museum
Western Australian Museum Annual Report 2004-2005 Jandamarra Crossing Artists: Alwin Reamillo and Roselin Eaton Photograph by Norman Bailey © Western Australian Museum, 2005 Coordinated by Ann Ousey and Nick Mayman Edited by Roger Bourke Designed by Charmaine Cave Layout by Gregory Jackson Published by the Western Australian Museum Locked Bag 49, Welshpool DC, Western Australia 6986 49 Kew Street, Welshpool, Western Australia 6106 www.museum.wa.gov.au ISSN 0083-87212204-6127 Cover: Jandamarra Crossing Artists: Alwin Reamillo, Filipino Australian, and Roselin Eaton, Walmajarri, 2003 Mixed media installation, including bamboo, beer cans, rubber tyre tubing, flicker-flame resin cast heart with electric component, motorised propeller with electrical component, motion sensor and organic material including emu feet, kangaroo leg, bush turkey feathers. Miniature landscape comprises plastic/rubber animals, miniature helicopters and termite mounds. This five-metre hybrid helicopter reflects the story of Jandamarra or Pigeon, a young Bunuba hero who led the resistance against the invasion and pastoral occupation of Aboriginal lands in the Kimberley in the 1890s. Jandamarra was an exceptional marksman and his improvised manufacture of ammunition using found materials, as well as his ability to evade capture by the authorities earned him a reputation that has become legend. He was said to be able to fly like a bird and disappear like a ghost. The helicopter is also a visual reference to the importance of aerial mustering as part of the pastoral industry in which so many Bunaba people continue to be involved. Initially proposed as an experiment in collaborative art-making with mature age students at Karrayili Adult Education Centre, the project was developed by accomplished Filipino Australian artist and teacher Alwin Reamillo, with Roselin Eaton, an Walmajarri artist, student and arts worker. -

Distinción Taxonómica De Los Moluscos De Fondos Blandos Del Golfo De Batabanó, Cuba
Lat. Am. J. Aquat. Res., 43(5): 856-872, 2015Distinción taxonómica de los moluscos del Golfo de Batabanó, Cuba 856 1 DOI: 10.3856/vol43-issue5-fulltext-6 Research Article Distinción taxonómica de los moluscos de fondos blandos del Golfo de Batabanó, Cuba Norberto Capetillo-Piñar1, Marcial Trinidad Villalejo-Fuerte1 & Arturo Tripp-Quezada1 1Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional P.O. Box 592, La Paz, 23096 Baja California Sur, México Corresponding author: Arturo Tripp-Quezada ([email protected]) RESUMEN. La distinción taxonómica es una medida de diversidad que presenta una serie de ventajas que dan connotación relevante a la ecología teórica y aplicada. La utilidad de este tipo de medida como otro método para evaluar la biodiversidad de los ecosistemas marinos bentónicos de fondos blandos del Golfo de Batabanó (Cuba) se comprobó mediante el uso de los índices de distinción taxonómica promedio (Delta+) y la variación en la distinción taxonómica (Lambda+) de las comunidades de moluscos. Para este propósito, se utilizaron los inventarios de especies de moluscos bentónicos de fondos blandos obtenidos en el periodo 1981-1985 y en los años 2004 y 2007. Ambos listados de especies fueron analizados y comparados a escala espacial y temporal. La composición taxonómica entre el periodo y años estudiados se conformó de 3 clases, 20 órdenes, 60 familias, 137 géneros y 182 especies, observándose, excepto en el nivel de clase, una disminución no significativa de esta composición en 2004 y 2007. A escala espacial se detectó una disminución significativa en la riqueza taxonómica en el 2004. No se detectaron diferencias significativas en Delta+ y Lambda+ a escala temporal, pero si a escala espacial, hecho que se puede atribuir al efecto combinado del incremento de las actividades antropogénicas en la región con los efectos inducidos por los huracanes. -

Veliger151973berk.Pdf
NVmOSHillMS ;S SMITHS0N1AN""|NSTITUTI0N NOliniliSNl SBiyvaan libraries SMITt^SONlAN instituti Z m Z C/7 Z £/) *. Z u, ^ Ni NViNOSHii/js SBiavyan libraries Smithsonian institution NoiiniiiSNi nvinoshIiws saiyvyanf -J z _i — ^ -J z Z "S _J z INSTITUTION NOliniliSNl NVINOSHilWS S3iyvaan LIBRARIES SMITHSONIRN INSTITUTION! S SMITHSONIAN — z r^, z — — Ni NVlNOSHilWS SBiyvaaiT LIBRARIES SMITHSONIAN INSTITUTION NOliniliSNl NVINOSHimS S3iyvaan 00 C/) ^ z 5 ^ 2! ^ ^ ^ Z _J Z _1 Z -J z _ ES SMITHSONIAN INSTITUTION NOliniliSNl NVINOSHlllNS - SHIHVyan LIBRARIES SMITHSONIAN INSTITUTION z r- z - m NJvirjosHiiws SHiavaan libraries Smithsonian institution NoiiniiiSNi nvinoshiiws SBiavaan CO CO Z W Z ^ ^ Z » CO Z . OCO NOliniliSNl NVINOSHlllAls'^ I d ES SMITHSONIAN INSTITUTION S 3 V a 3 11 LI B RAR I Es'^SMITHSONIAN^INSTITUTION ^ «^ ^ .-^ <^ 5 ^ ^ . z \ —^ 5; o z ± " ^ ' ± C/) C/> \ Z to ± CO iisNi NViNOSHiiiMS S3iyvyan libraries Smithsonian institution NoiiniiiSNi nvinoshiiins S3iyvda in 2 . ^ CO X </J Z GO Z Z CO 2 MES SMITHSONIAN INSTITUTION NOIinillSNI NVlNOSHilWS SBiyvyan LIBRARIES SMITHSONIAN INSTITUTH — — to =: CO — >v m S m 5 \>^^ ^ 5 ^^^^ N^;^^;^ 5 N^i^^ 3 iSNI~'NVINOSHilWS S3 I y VH 3 11 LI B RAR I ES^SMITHSONIAN~'lNSTITUTION^ NOIiDiliSNI ""NVINOSHimS 3 I y V y a >" , Z ^ .. [I z ^ z ^^^'^ m I "^i^^ "^^^ m ^^^^^^ g ^^^^ m f — W _C/) „ C/)_ I ES SMITHSONIAN INSTITUTION NOIinillSNI NVlNOSHiiWS S3iyvyan LIBRARIES SMITHSONIAN INSTITUTK ^ ^ ^ Zr CO z co z- c/) z:» •*'"' 2 CO Z C/5 Z CO Z Jo LSNI_NVINOSHillAIS SSiyVyail libraries SMITHSONIAN INSTITUTION NOIinillSNI NVINOSHIIWS S3iyvya z ^ — E ^ ^ 5 \ ^ ^-^^ " 5 ^^^^ 5 '^i^gj^ ' 5 '^^J^^ ^ ^ -J 2 _i Z ^ Z j :IES SMITHSONIAN INSTITUTION NOIinillSNI NVINOSHIIWS S3iyvyan LIBRARIES SMITHSONIAN INSTITUTK - C/l ± (/, ^ _ _ iSNi NViNosHims S3iyvyan libraries smithsonian~institution NoiJ-niiiSNi nvinoshiiws S3iyvya 2 M * Z >. -
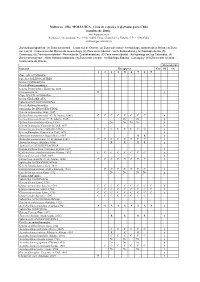
Moluscos - Filo MOLLUSCA
Moluscos - Filo MOLLUSCA. Lista de especies registradas para Cuba (octubre de 2006). José Espinosa Sáez Instituto de Oceanología, Ave 1ª No. 18406, Playa, Ciudad de La Habana, C.P. 11200, Cuba [email protected] Zonas biogeográficas: (1) Zona suroriental – Costa sur de Oriente, (2) Zona surcentral - Archipiélago Jardines de la Reina, (3) Zona sur central - Costa al sur del Macizo de Guamuhaya, (4) Zona suroccidental - Golfo de Batabanó y Archipiélago de los, (5) Canarreos, (6) Zona suroccidental - Península de Guanahacabibes, (7) Zona noroccidental - Archipiélago de Los Colorados, (8) Zona noroccidental - Norte Habana-Matanzas, (9) Zona norte-central - Archipiélago Sabana - Camagüey, (10) Zona norte-oriental - Costa norte de Oriente Abreviaturas Especies Bioegiones Cu Pl Oc 1 2 3 4 5 6 7 8 9 Clase APLACOPHORA Subclase SOLENOGASTRES Orden CAVIBELONIA Familia Proneomeniidae Género Proneomenia Hubrecht, 1880 Proneomenia sp . R x Clase POLYPLACOPHORA Orden NEOLORICATA Suborden ISCHNOCHITONINA Familia Ischnochitonidae Subfamilia ISCHNOCHITONINAE Género Ischnochiton Gray, 1847 Ischnochiton erythronotus (C. B. Adams, 1845) C C C C C C C C x Ischnochiton papillosus (C. B. Adams, 1845) Nc Nc x Ischnochiton striolatus (Gray, 1828) Nc Nc Nc Nc x Género Ischnoplax Carpenter in Dall, 1879 x Ischnoplax pectinatus (Sowerby, 1832) C C C C C C C C x Género Stenoplax Carpenter in Dall, 1879 x Stenoplax bahamensis Kaas y Belle, 1987 R R x Stenoplax purpurascens (C. B. Adams, 1845) C C C C C C C C x Stenoplax boogii (Haddon, 1886) R R R R x Subfamilia CALLISTOPLACINAE Género Callistochiton Carpenter in Dall, 1879 x Callistochiton shuttleworthianus Pilsbry, 1893 C C C C C C C C x Género Ceratozona Dall, 1882 x Ceratozona squalida (C. -

Host Specificity and Phylogenetic Relationships Among Atlantic Ovulidae (Mollusca: Gastropoda)
Cover Page The handle http://hdl.handle.net/1887/43471 holds various files of this Leiden University dissertation Author: Reijnen, Bastian T. Title: Phylogenetic ecology of octocoral - gastropod associations Issue Date: 2016-10-11 Chapter 1 Host specificity and phylogenetic relationships among Atlantic Ovulidae (Mollusca: Gastropoda) Bastian T. Reijnen, Bert W. Hoeksema, Edmund Gittenberger Contributions to Zoology (2010) 79: 69-78 Abstract Ovulid gastropods and their octocoral hosts were collected along the leeward coast of Curaçao, Netherlands Antilles. New molecular data of Caribbean and a single Atlantic species were combined with comparable data of Indo-Pacific Ovulidae and a single East-Pacific species from GenBank. Based on two DNA markers, viz. COI and 16S, the phylogenetic relationships among all ovulid spe- cies of which these data are available are reconstructed. The provisional results suggest a dichotomy between the Atlantic and the Indo-Pacific taxa. Fully grownSimnialena uniplicata closely resembles juvenile Cyphoma gibbosum conchologically. Cymbovula acicularis and C. bahamaensis might be synonyms. The assignments of Caribbean host species for Cyphoma gibbosum, C. signatum, Cymbovula acicularis and Simnialena uniplicata are revised. Hfst 01 Thesis BR.indd 17 26-08-16 09:18 CHAPTER 1 Introduction Ovulid snails are obligate associates of Cnidaria. As far as known, most occur associated with octocorals (Anthozoa: Octocorallia: Alcyonacea), but in both the Caribbean and the Indo-Pacific some ovulid species feed on antipatharians (Anthozoa: Hexacorallia: Antipatharia) (Tazioli et al., 2007). The species of Pedicularia Swainson, 1840, that have been classified with the Ovulidae for a long time (Goud and Hoeksema, 2001), live on stylasterid corals (Hydrozoa: Athecatae: Filefera). -

44-Sep-2016.Pdf
Page 2 Vol. 44, No. 3 In 1972, a group of shell collectors saw the need for a national organization devoted to the interests of shell collec- tors; to the beauty of shells, to their scientific aspects, and to the collecting and preservation of mollusks. This was the start of COA. Our member- AMERICAN CONCHOLOGIST, the official publication of the Conchol- ship includes novices, advanced collectors, scientists, and shell dealers ogists of America, Inc., and issued as part of membership dues, is published from around the world. In 1995, COA adopted a conservation resolution: quarterly in March, June, September, and December, printed by JOHNSON Whereas there are an estimated 100,000 species of living mollusks, many PRESS OF AMERICA, INC. (JPA), 800 N. Court St., P.O. Box 592, Pontiac, IL 61764. All correspondence should go to the Editor. ISSN 1072-2440. of great economic, ecological, and cultural importance to humans and Articles in AMERICAN CONCHOLOGIST may be reproduced with whereas habitat destruction and commercial fisheries have had serious ef- proper credit. We solicit comments, letters, and articles of interest to shell fects on mollusk populations worldwide, and whereas modern conchology collectors, subject to editing. Opinions expressed in “signed” articles are continues the tradition of amateur naturalists exploring and documenting those of the authors, and are not necessarily the opinions of Conchologists the natural world, be it resolved that the Conchologists of America endors- of America. All correspondence pertaining to articles published herein es responsible scientific collecting as a means of monitoring the status of or generated by reproduction of said articles should be directed to the Edi- mollusk species and populations and promoting informed decision making tor. -

Marine Mollusks of Bahía Málaga, Colombia (Tropical Eastern Pacific)
10TH ANNIVERSARY ISSUE Check List the journal of biodiversity data LISTS OF SPECIES Check List 11(1): 1497, January 2015 doi: http://dx.doi.org/10.15560/11.1.1497 ISSN 1809-127X © 2015 Check List and Authors Marine mollusks of Bahía Málaga, Colombia (Tropical Eastern Pacific) Luz Ángela López de Mesa1* and Jaime R. Cantera2 1 Texas A&M University-Corpus Christi, Biology, 6300 Ocean Dr. CS 239 annex, Corpus Christi, TX, USA 2 Universidad del Valle, Departamento de Biología, Facultad de Ciencias Naturales y Exactas, Calle 13 # 100-00, Cali, Colombia * Corresponding author. E-mail: [email protected] Abstract: A checklist of mollusks reported in Bahía Málaga hence high biodiversity. Its littoral zone, with an area of 136 (Valle del Cauca, Colombia) was developed through recent km2, is composed of different ecosystems, such as rocky and samplings in the zone (2004–2012), together with bibliograph- sandy shores, muddy flats, and mangrove forests (Cantera ic and museums’ collections reviews. Species’ distributions 1991). in Bahía Málaga were established through 18 different sub- Rocky shores in Bahía Málaga may consist of cliffs and/or regions, which included the inner, middle and outer zones of boulders. The range in the size and texture of the particles the bay. A revision of the western American distribution for present in the rocky shores allow for a variety of microhabi- the species was also carried out. A total of 426 species were tats, making it a very diverse ecosystem (INVEMAR et al. found, of which 44 were new reports for the Colombian Pacific 2007). Sandy beaches consist of very fine particles that may coast. -

The Seashells of an Iconic Public Artwork: Diversity and Provenance of the Mollusks of the Watts Towers
Pernet, B, et al. 2019. The Seashells of an Iconic Public Artwork: Diversity and Provenance of the Mollusks of the Watts Towers. Journal of Conservation and Museum Studies, 17(1): 1, pp. 1–11. DOI: https:// doi.org/10.5334/jcms.177 RESEARCH ARTICLE The Seashells of an Iconic Public Artwork: Diversity and Provenance of the Mollusks of the Watts Towers Bruno Pernet*, Emma R. Silverman† and Paul Valentich Scott‡ The Watts Towers (WT), an iconic Los Angeles artwork created by Sabato Rodia in 1921–1954, is covered with mosaics whose elements include thousands of mollusk shells. Little is known about the diversity or sources of these shells. Here, we document the diversity of mollusk shells present in the WT and use data on their characteristics to make inferences about their provenance. We identified shells of 34 species, 24 of them bivalves (clams and their relatives) and 10 gastropods (snails). Almost all (29/34) of these spe- cies are native to southern California shorelines, especially those of bays and estuaries. Rodia could have accessed these sites on foot, by automobile, or by using the Red Car trolley system. Some of the bivalve shells bear drill holes made by naticid gastropods, suggesting that they were collected post-mortem, presumably after they had washed up on beaches. These observations are consistent with the sparse documentary evidence on the origin of the shells of the WT. This detailed information on the diversity of the seashells of the WT should be of utility to conservators, and of interest to scholars of and visitors to the WT.