Biblioteca Digital | FCEN-UBA | . ""
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Diversity and Structure of Bird and Mammal Communities in the Semiarid Chaco Region: Response to Agricultural Practices and Landscape Alterations
Diversity and structure of bird and mammal communities in the Semiarid Chaco Region: response to agricultural practices and landscape alterations Julieta Decarre March 2015 A thesis submitted for the degree of Doctor of Philosophy Division of Ecology and Evolution, Department of Life Sciences Imperial College London 2 Imperial College London Department of Life Sciences Diversity and structure of bird and mammal communities in the Semiarid Chaco Region: response to agricultural practices and landscape alterations Supervised by Dr. Chris Carbone Dr. Cristina Banks-Leite Dr. Marcus Rowcliffe Imperial College London Institute of Zoology Zoological Society of London 3 Declaration of Originality I herewith certify that the work presented in this thesis is my own and all else is referenced appropriately. I have used the first-person plural in recognition of my supervisors’ contribution. People who provided less formal advice are named in the acknowledgments. Julieta Decarre 4 Copyright Declaration The copyright of this thesis rests with the author and is made available under a Creative Commons Attribution Non-Commercial No Derivatives licence. Researchers are free to copy, distribute or transmit the thesis on the condition that they attribute it, that they do not use it for commercial purposes and that they do not alter, transform or build upon it. For any reuse or redistribution, researchers must make clear to others the licence terms of this work 5 “ …and we wandered for about four hours across the dense forest…Along the path I could see several footprints of wild animals, peccaries, giant anteaters, lions, and the footprint of a tiger, that is the first one I saw.” - Emilio Budin, 19061 I dedicate this thesis To my mother and my father to Virginia, Juan Martin and Alejandro, for being there through space and time 1 Book: “Viajes de Emilio Budin: La Expedición al Chaco, 1906-1907”. -

Web-Book Catalog 2021-05-10
Lehigh Gap Nature Center Library Book Catalog Title Year Author(s) Publisher Keywords Keywords Catalog No. National Geographic, Washington, 100 best pictures. 2001 National Geogrpahic. Photographs. 779 DC Miller, Jeffrey C., and Daniel H. 100 butterflies and moths : portraits from Belknap Press of Harvard University Butterflies - Costa 2007 Janzen, and Winifred Moths - Costa Rica 595.789097286 th tropical forests of Costa Rica Press, Cambridge, MA rica Hallwachs. Miller, Jeffery C., and Daniel H. 100 caterpillars : portraits from the Belknap Press of Harvard University Caterpillars - Costa 2006 Janzen, and Winifred 595.781 tropical forests of Costa Rica Press, Cambridge, MA Rica Hallwachs 100 plants to feed the bees : provide a 2016 Lee-Mader, Eric, et al. Storey Publishing, North Adams, MA Bees. Pollination 635.9676 healthy habitat to help pollinators thrive Klots, Alexander B., and Elsie 1001 answers to questions about insects 1961 Grosset & Dunlap, New York, NY Insects 595.7 B. Klots Cruickshank, Allan D., and Dodd, Mead, and Company, New 1001 questions answered about birds 1958 Birds 598 Helen Cruickshank York, NY Currie, Philip J. and Eva B. 101 Questions About Dinosaurs 1996 Dover Publications, Inc., Mineola, NY Reptiles Dinosaurs 567.91 Koppelhus Dover Publications, Inc., Mineola, N. 101 Questions About the Seashore 1997 Barlowe, Sy Seashore 577.51 Y. Gardening to attract 101 ways to help birds 2006 Erickson, Laura. Stackpole Books, Mechanicsburg, PA Birds - Conservation. 639.978 birds. Sharpe, Grant, and Wenonah University of Wisconsin Press, 101 wildflowers of Arcadia National Park 1963 581.769909741 Sharpe Madison, WI 1300 real and fanciful animals : from Animals, Mythical in 1998 Merian, Matthaus Dover Publications, Mineola, NY Animals in art 769.432 seventeenth-century engravings. -
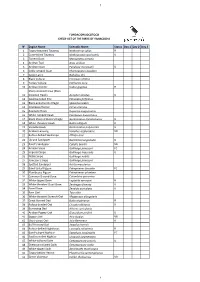
N° English Name Scientific Name Status Day 1
1 FUNDACIÓN JOCOTOCO CHECK-LIST OF THE BIRDS OF YANACOCHA N° English Name Scientific Name Status Day 1 Day 2 Day 3 1 Tawny-breasted Tinamou Nothocercus julius R 2 Curve-billed Tinamou Nothoprocta curvirostris U 3 Torrent Duck Merganetta armata 4 Andean Teal Anas andium 5 Andean Guan Penelope montagnii U 6 Sickle-winged Guan Chamaepetes goudotii 7 Cattle Egret Bubulcus ibis 8 Black Vulture Coragyps atratus 9 Turkey Vulture Cathartes aura 10 Andean Condor Vultur gryphus R Sharp-shinned Hawk (Plain- 11 breasted Hawk) Accipiter striatus U 12 Swallow-tailed Kite Elanoides forficatus 13 Black-and-chestnut Eagle Spizaetus isidori 14 Cinereous Harrier Circus cinereus 15 Roadside Hawk Rupornis magnirostris 16 White-rumped Hawk Parabuteo leucorrhous 17 Black-chested Buzzard-Eagle Geranoaetus melanoleucus U 18 White-throated Hawk Buteo albigula R 19 Variable Hawk Geranoaetus polyosoma U 20 Andean Lapwing Vanellus resplendens VR 21 Rufous-bellied Seedsnipe Attagis gayi 22 Upland Sandpiper Bartramia longicauda R 23 Baird's Sandpiper Calidris bairdii VR 24 Andean Snipe Gallinago jamesoni FC 25 Imperial Snipe Gallinago imperialis U 26 Noble Snipe Gallinago nobilis 27 Jameson's Snipe Gallinago jamesoni 28 Spotted Sandpiper Actitis macularius 29 Band-tailed Pigeon Patagoienas fasciata FC 30 Plumbeous Pigeon Patagioenas plumbea 31 Common Ground-Dove Columbina passerina 32 White-tipped Dove Leptotila verreauxi R 33 White-throated Quail-Dove Zentrygon frenata U 34 Eared Dove Zenaida auriculata U 35 Barn Owl Tyto alba 36 White-throated Screech-Owl Megascops -

Abstract Book
Welcome to the Ornithological Congress of the Americas! Puerto Iguazú, Misiones, Argentina, from 8–11 August, 2017 Puerto Iguazú is located in the heart of the interior Atlantic Forest and is the portal to the Iguazú Falls, one of the world’s Seven Natural Wonders and a UNESCO World Heritage Site. The area surrounding Puerto Iguazú, the province of Misiones and neighboring regions of Paraguay and Brazil offers many scenic attractions and natural areas such as Iguazú National Park, and provides unique opportunities for birdwatching. Over 500 species have been recorded, including many Atlantic Forest endemics like the Blue Manakin (Chiroxiphia caudata), the emblem of our congress. This is the first meeting collaboratively organized by the Association of Field Ornithologists, Sociedade Brasileira de Ornitologia and Aves Argentinas, and promises to be an outstanding professional experience for both students and researchers. The congress will feature workshops, symposia, over 400 scientific presentations, 7 internationally renowned plenary speakers, and a celebration of 100 years of Aves Argentinas! Enjoy the book of abstracts! ORGANIZING COMMITTEE CHAIR: Valentina Ferretti, Instituto de Ecología, Genética y Evolución de Buenos Aires (IEGEBA- CONICET) and Association of Field Ornithologists (AFO) Andrés Bosso, Administración de Parques Nacionales (Ministerio de Ambiente y Desarrollo Sustentable) Reed Bowman, Archbold Biological Station and Association of Field Ornithologists (AFO) Gustavo Sebastián Cabanne, División Ornitología, Museo Argentino -

Ultimate Bolivia Tour Report 2019
Titicaca Flightless Grebe. Swimming in what exactly? Not the reed-fringed azure lake, that’s for sure (Eustace Barnes) BOLIVIA 8 – 29 SEPTEMBER / 4 OCTOBER 2019 LEADER: EUSTACE BARNES Bolivia, indeed, THE land of parrots as no other, but Cotingas as well and an astonishing variety of those much-loved subfusc and generally elusive denizens of complex uneven surfaces. Over 700 on this tour now! 1 BirdQuest Tour Report: Ultimate Bolivia 2019 www.birdquest-tours.com Blue-throated Macaws hoping we would clear off and leave them alone (Eustace Barnes) Hopefully, now we hear of colourful endemic macaws, raucous prolific birdlife and innumerable elusive endemic denizens of verdant bromeliad festooned cloud-forests, vast expanses of rainforest, endless marshlands and Chaco woodlands, each ringing to the chorus of a diverse endemic avifauna instead of bleak, freezing landscapes occupied by impoverished unhappy peasants. 2 BirdQuest Tour Report: Ultimate Bolivia 2019 www.birdquest-tours.com That is the flowery prose, but Bolivia IS that great destination. The tour is no longer a series of endless dusty journeys punctuated with miserable truck-stop hotels where you are presented with greasy deep-fried chicken and a sticky pile of glutinous rice every day. The roads are generally good, the hotels are either good or at least characterful (in a good way) and the food rather better than you might find in the UK. The latter perhaps not saying very much. Palkachupe Cotinga in the early morning light brooding young near Apolo (Eustace Barnes). That said, Bolivia has work to do too, as its association with that hapless loser, Che Guevara, corruption, dust and drug smuggling still leaves the country struggling to sell itself. -

Dacninae Species Tree, Part I
Dacninae I: Nemosiini, Conirostrini, & Diglossini Hooded Tanager, Nemosia pileata Cherry-throated Tanager, Nemosia rourei Nemosiini Blue-backed Tanager, Cyanicterus cyanicterus White-capped Tanager, Sericossypha albocristata Scarlet-throated Tanager, Sericossypha loricata Bicolored Conebill, Conirostrum bicolor Pearly-breasted Conebill, Conirostrum margaritae Chestnut-vented Conebill, Conirostrum speciosum Conirostrini White-eared Conebill, Conirostrum leucogenys Capped Conebill, Conirostrum albifrons Giant Conebill, Conirostrum binghami Blue-backed Conebill, Conirostrum sitticolor White-browed Conebill, Conirostrum ferrugineiventre Tamarugo Conebill, Conirostrum tamarugense Rufous-browed Conebill, Conirostrum rufum Cinereous Conebill, Conirostrum cinereum Stripe-tailed Yellow-Finch, Pseudochloris citrina Gray-hooded Sierra Finch, Phrygilus gayi Patagonian Sierra Finch, Phrygilus patagonicus Peruvian Sierra Finch, Phrygilus punensis Black-hooded Sierra Finch, Phrygilus atriceps Gough Finch, Rowettia goughensis White-bridled Finch, Melanodera melanodera Yellow-bridled Finch, Melanodera xanthogramma Inaccessible Island Finch, Nesospiza acunhae Nightingale Island Finch, Nesospiza questi Wilkins’s Finch, Nesospiza wilkinsi Saffron Finch, Sicalis flaveola Grassland Yellow-Finch, Sicalis luteola Orange-fronted Yellow-Finch, Sicalis columbiana Sulphur-throated Finch, Sicalis taczanowskii Bright-rumped Yellow-Finch, Sicalis uropigyalis Citron-headed Yellow-Finch, Sicalis luteocephala Patagonian Yellow-Finch, Sicalis lebruni Greenish Yellow-Finch, -

Bolivia: the Andes and Chaco Lowlands
BOLIVIA: THE ANDES AND CHACO LOWLANDS TRIP REPORT OCTOBER/NOVEMBER 2017 By Eduardo Ormaeche Blue-throated Macaw www.birdingecotours.com [email protected] 2 | T R I P R E P O R T Bolivia, October/November 2017 Bolivia is probably one of the most exciting countries of South America, although one of the less-visited countries by birders due to the remoteness of some birding sites. But with a good birding itinerary and adequate ground logistics it is easy to enjoy the birding and admire the outstanding scenery of this wild country. During our 19-day itinerary we managed to record a list of 505 species, including most of the country and regional endemics expected for this tour. With a list of 22 species of parrots, this is one of the best countries in South America for Psittacidae with species like Blue-throated Macaw and Red-fronted Macaw, both Bolivian endemics. Other interesting species included the flightless Titicaca Grebe, Bolivian Blackbird, Bolivian Earthcreeper, Unicolored Thrush, Red-legged Seriema, Red-faced Guan, Dot-fronted Woodpecker, Olive-crowned Crescentchest, Black-hooded Sunbeam, Giant Hummingbird, White-eared Solitaire, Striated Antthrush, Toco Toucan, Greater Rhea, Brown Tinamou, and Cochabamba Mountain Finch, to name just a few. We started our birding holiday as soon as we arrived at the Viru Viru International Airport in Santa Cruz de la Sierra, birding the grassland habitats around the terminal. Despite the time of the day the airport grasslands provided us with an excellent introduction to Bolivian birds, including Red-winged Tinamou, White-bellied Nothura, Campo Flicker, Chopi Blackbird, Chotoy Spinetail, White Woodpecker, and even Greater Rhea, all during our first afternoon. -

Predation on Vertebrates by Neotropical Passerine Birds Leonardo E
Lundiana 6(1):57-66, 2005 © 2005 Instituto de Ciências Biológicas - UFMG ISSN 1676-6180 Predation on vertebrates by Neotropical passerine birds Leonardo E. Lopes1,2, Alexandre M. Fernandes1,3 & Miguel Â. Marini1,4 1 Depto. de Biologia Geral, Instituto de Ciências Biológicas, Universidade Federal de Minas Gerais, 31270-910, Belo Horizonte, MG, Brazil. 2 Current address: Lab. de Ornitologia, Depto. de Zoologia, Instituto de Ciências Biológicas, Universidade Federal de Minas Gerais, Av. Antônio Carlos, 6627, Pampulha, 31270-910, Belo Horizonte, MG, Brazil. E-mail: [email protected]. 3 Current address: Coleções Zoológicas, Aves, Instituto Nacional de Pesquisas da Amazônia, Avenida André Araújo, 2936, INPA II, 69083-000, Manaus, AM, Brazil. E-mail: [email protected]. 4 Current address: Lab. de Ornitologia, Depto. de Zoologia, Instituto de Biologia, Universidade de Brasília, 70910-900, Brasília, DF, Brazil. E-mail: [email protected] Abstract We investigated if passerine birds act as important predators of small vertebrates within the Neotropics. We surveyed published studies on bird diets, and information on labels of museum specimens, compiling data on the contents of 5,221 stomachs. Eighteen samples (0.3%) presented evidence of predation on vertebrates. Our bibliographic survey also provided records of 203 passerine species preying upon vertebrates, mainly frogs and lizards. Our data suggest that vertebrate predation by passerines is relatively uncommon in the Neotropics and not characteristic of any family. On the other hand, although rare, the ability to prey on vertebrates seems to be widely distributed among Neotropical passerines, which may respond opportunistically to the stimulus of a potential food item. -

Notes on the Plumages of the Paramo Seedeater (Catamenia Homochroa)
January1986] ShortCommunications 227 shortcomingof the modal method is that it estimates -, & J. T. EMLEN. 1966. A technique for record- only the direction of activity and gives no indication ing migratory orientation of captive birds. Auk of the scatterof hopping, whereas the traditional 83: 361-367. method indicates the degree of concentration of a HAMILTONßW. J., III. 1966. Analysis of bird navi- bird's hopping (mean vector length, r). This is not gationexperiments. Pp. 147-178in Systemsanal- often a major problem becausemost recent studies ysis in ecology (K. E. F. Watt, Ed.). New York, have relied on second-orderanalyses of mean direc- Academic Press. tions that ignore the mean vector lengths. Indeed, at MARDIA, K. V. 1972. Statistics of directional data. this point the biological meaning of the dispersion New York, Academic Press. of a bird's hoppingactivity is not clearand is in part MOORE,F. R. 1985. Individual variability in the mi- a reflection of the idiosyncraciesof individual birds gratory orientation of the Savannah Sparrow, (Wiltschko and Wiltschko 1978, Moore 1985). Passerculussandwichensis. Z. Tierpsychol. 67: 144- 153. LITERATURE CITED RABOL,J. 1969. Orientation of autumn migrating Garden Warblers (Sylvia borin) after displace- BATSCHELET,E. 1978. Second-order statistical anal- ment from western Denmark (Blfivand) to east- ysisof directions.Pp. 3-24 in Animal migration, ern Sweden (Ottenby). A preliminary experi- navigation, and homing (K. Schmidt-Koenig and ment. Dansk Ornithol. Foren. Tids. 63: 93-104. W. T. Keeton, Eds.).Berlin, Springer-Verlag. 1970. Transformationof colour degreesto 1981. Circular statisticsin biology. New number of jumps using the Emlen orientation York, Academic Press. -

Full Article
Ardeola 50(2), 2003, 223-235 GEOGRAPHIC VARIATION IN THE GREAT PAMPA-FINCH EMBERNAGRA PLATENSIS COMPLEX: EVIDENCE FOR TWO SPECIES Floyd E. HAYES*1 SUMMARY.—Geographic variation in the Great Pampa-Finch Embernagra platensis complex: evidence for two species. Aims: The Great Pampa-Finch Embernagra platensis is represented by four subspecies belonging to two dis- tinct groups occurring in allopatry: (1) nominate E. p. platensis in the east; and (2) E. p. olivascens, E. p. gos- sei and E. p. catamarcanus in the west. Morphological variation within the complex was assessed to infer the taxonomic relationship between the two forms. Location: Southern South America. Methods: Several size, plumage and soft part traits were measured for 339 specimens and analysed with uni- variate and multivariate statistical methods. Results: I found no evidence for long-distance migration, conflicting support for Bergmann’s rule (body size negatively correlated with latitude and positively correlated with elevation), and more support for Gloger’s rule. The structure and colouration of the bill were the most diagnostic traits. The absence of intermediate spe- cimens and lack of clinal variation of bill colouration within each form demonstrates that intergradation eit- her does not occur or is potentially restricted to a narrow, still undiscovered contact zone. Conclusions: Given the likelihood that bill structure and colour, combined with other traits, may represent re- productive isolating mechanisms between the two groups, I tentatively propose the recognition of two species within the E. platensis complex: the monotypic Great Pampa-Finch, E. platensis, and the polytypic Olive Pampa-Finch, E. olivascens. Key words: Embernagra platensis, geographic variation, Great Pampa-Finch, South America, taxo- nomy. -

Defining a Monophyletic Cardinalini
Available online at www.sciencedirect.com Molecular Phylogenetics and Evolution 45 (2007) 1014–1032 www.elsevier.com/locate/ympev Defining a monophyletic Cardinalini: A molecular perspective John Klicka a,*, Kevin Burns b, Garth M. Spellman a,1 a Barrick Museum of Natural History, Box 454012, University of Nevada Las Vegas, 4505 Maryland, Parkway, Las Vegas, NV 89154-4012, USA b Department of Biology, San Diego State University, San Diego, CA 92182-4614, USA Received 28 March 2007; revised 29 June 2007; accepted 10 July 2007 Available online 19 July 2007 Abstract Within the New World nine-primaried oscine assemblage, feeding morphology and behavior have long been used as a guideline for assigning membership to subgroups. For example, birds with stout, conical bills capable of crushing heavy seeds have generally been placed within the tribe Cardinalini (cardinal-grosbeaks). Many workers have tried to characterize this group more definitively, using a variety of morphological characters; however, the characters used often conflicted with one another. Previous molecular studies addressing the monophyly of Cardinalini have had only limited sampling within the group. In this study, we analyze mtDNA sequence data from all genera and 34 of the 42 Cardinalini species (sensu [Sibley, C.G., Monroe, B.L., 1990. Distribution and Taxonomy of the Birds of the World, Yale University Press, New Haven, CT]) to address the monophyly of the group and to reconstruct the most com- plete phylogeny of this tribe published to date. We found strong support for a redefined Cardinalini that now includes some members previously placed within Thraupini (tanagers; the genera Piranga, Habia, Chlorothraupis, and Amaurospiza) and some members previ- ously placed within the Parulini (wood-warblers; the genus Granatellus). -

21 Sep 2018 Lists of Victims and Hosts of the Parasitic
version: 21 Sep 2018 Lists of victims and hosts of the parasitic cowbirds (Molothrus). Peter E. Lowther, Field Museum Brood parasitism is an awkward term to describe an interaction between two species in which, as in predator-prey relationships, one species gains at the expense of the other. Brood parasites "prey" upon parental care. Victimized species usually have reduced breeding success, partly because of the additional cost of caring for alien eggs and young, and partly because of the behavior of brood parasites (both adults and young) which may directly and adversely affect the survival of the victim's own eggs or young. About 1% of all bird species, among 7 families, are brood parasites. The 5 species of brood parasitic “cowbirds” are currently all treated as members of the genus Molothrus. Host selection is an active process. Not all species co-occurring with brood parasites are equally likely to be selected nor are they of equal quality as hosts. Rather, to varying degrees, brood parasites are specialized for certain categories of hosts. Brood parasites may rely on a single host species to rear their young or may distribute their eggs among many species, seemingly without regard to any characteristics of potential hosts. Lists of species are not the best means to describe interactions between a brood parasitic species and its hosts. Such lists do not necessarily reflect the taxonomy used by the brood parasites themselves nor do they accurately reflect the complex interactions within bird communities (see Ortega 1998: 183-184). Host lists do, however, offer some insight into the process of host selection and do emphasize the wide variety of features than can impact on host selection.