Hábitos Alimentarios Del “Pez Tunco” Pseudobalistes Naufragium
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Balistapus Undulatus (Park, 1797) Frequent Synonyms / Misidentifications: None / None
click for previous page Tetraodontiformes: Balistidae 3919 Balistapus undulatus (Park, 1797) Frequent synonyms / misidentifications: None / None. FAO names: En - Orangestriped triggerfish. Diagnostic characters: Body deep, compressed. Large scale plates forming regular rows; and scales of cheek in an even, relatively complete covering. Scales enlarged above pectoral-fin base and just behind gill opening to form a flexible tympanum; scales of caudal peduncle with 2 longitudinal rows of large anteriorly projecting spines. No groove in front of eye. Mouth terminal; teeth pointed, the central pair in each jaw largest. First dorsal fin with III prominent spines, the first capable of being locked in an erected position by the second, the third short but distinct; dorsal-fin rays 24 to 27 (usually 25 or 26); anal-fin rays 20 to 24; caudal fin slightly rounded; pectoral-fin rays 13 to 15 (usually 14). Caudal peduncle compressed. Colour: dark green to dark brown with oblique curved orange lines on posterior head and body; an oblique band of narrow blue and orange stripes from around mouth to below pectoral fins; a large round black blotch around peduncular spines; rays of soft dorsal, anal, and pectoral fins orange; caudal fin orange. Size: Maximum total length 30 cm. Habitat, biology, and fisheries: Occurs in coral reefs at depths to 30 m. Feeds on various organisms, including live coral, algae, sea urchins, crabs and other crustaceans, molluscs, tunicates, and fishes. Marketed fresh and dried-salted. Distribution: Widespread in the tropical Indo-West Pacific, from East Africa, including the Red Sea, through Indonesia to the Tuamotu Islands; north to southern Japan, south to New Caledonia. -

Pacific Plate Biogeography, with Special Reference to Shorefishes
Pacific Plate Biogeography, with Special Reference to Shorefishes VICTOR G. SPRINGER m SMITHSONIAN CONTRIBUTIONS TO ZOOLOGY • NUMBER 367 SERIES PUBLICATIONS OF THE SMITHSONIAN INSTITUTION Emphasis upon publication as a means of "diffusing knowledge" was expressed by the first Secretary of the Smithsonian. In his formal plan for the Institution, Joseph Henry outlined a program that included the following statement: "It is proposed to publish a series of reports, giving an account of the new discoveries in science, and of the changes made from year to year in all branches of knowledge." This theme of basic research has been adhered to through the years by thousands of titles issued in series publications under the Smithsonian imprint, commencing with Smithsonian Contributions to Knowledge in 1848 and continuing with the following active series: Smithsonian Contributions to Anthropology Smithsonian Contributions to Astrophysics Smithsonian Contributions to Botany Smithsonian Contributions to the Earth Sciences Smithsonian Contributions to the Marine Sciences Smithsonian Contributions to Paleobiology Smithsonian Contributions to Zoo/ogy Smithsonian Studies in Air and Space Smithsonian Studies in History and Technology In these series, the Institution publishes small papers and full-scale monographs that report the research and collections of its various museums and bureaux or of professional colleagues in the world cf science and scholarship. The publications are distributed by mailing lists to libraries, universities, and similar institutions throughout the world. Papers or monographs submitted for series publication are received by the Smithsonian Institution Press, subject to its own review for format and style, only through departments of the various Smithsonian museums or bureaux, where the manuscripts are given substantive review. -

Parasites of Coral Reef Fish: How Much Do We Know? with a Bibliography of Fish Parasites in New Caledonia
Belg. J. Zool., 140 (Suppl.): 155-190 July 2010 Parasites of coral reef fish: how much do we know? With a bibliography of fish parasites in New Caledonia Jean-Lou Justine (1) UMR 7138 Systématique, Adaptation, Évolution, Muséum National d’Histoire Naturelle, 57, rue Cuvier, F-75321 Paris Cedex 05, France (2) Aquarium des lagons, B.P. 8185, 98807 Nouméa, Nouvelle-Calédonie Corresponding author: Jean-Lou Justine; e-mail: [email protected] ABSTRACT. A compilation of 107 references dealing with fish parasites in New Caledonia permitted the production of a parasite-host list and a host-parasite list. The lists include Turbellaria, Monopisthocotylea, Polyopisthocotylea, Digenea, Cestoda, Nematoda, Copepoda, Isopoda, Acanthocephala and Hirudinea, with 580 host-parasite combinations, corresponding with more than 370 species of parasites. Protozoa are not included. Platyhelminthes are the major group, with 239 species, including 98 monopisthocotylean monogeneans and 105 digeneans. Copepods include 61 records, and nematodes include 41 records. The list of fish recorded with parasites includes 195 species, in which most (ca. 170 species) are coral reef associated, the rest being a few deep-sea, pelagic or freshwater fishes. The serranids, lethrinids and lutjanids are the most commonly represented fish families. Although a list of published records does not provide a reliable estimate of biodiversity because of the important bias in publications being mainly in the domain of interest of the authors, it provides a basis to compare parasite biodiversity with other localities, and especially with other coral reefs. The present list is probably the most complete published account of parasite biodiversity of coral reef fishes. -

UNIVERSITY of CALIFORNIA Los Angeles Design and Implementation of Environmental DNA Metabarcoding Methods for Monitoring the So
UNIVERSITY OF CALIFORNIA Los Angeles Design and Implementation of Environmental DNA Metabarcoding Methods for Monitoring the Southern California Marine Protected Area Network A dissertation submitted in partial satisfaction of the requirements for the degree Doctor of Philosophy in Biology by Zachary Jacob Gold 2020 © Copyright by Zachary Jacob Gold 2020 ABSTRACT OF THE DISSERTATION Design and Implementation of Environmental DNA Metabarcoding Methods for Monitoring the Southern California Marine Protected Area Network by Zachary Jacob Gold Doctor of Philosophy in Biology University of California, Los Angeles, 2020 Professor Paul Barber, Chair Marine protected areas (MPAs) are important tools for maintaining biodiversity and abundance of marine species. However, key to the effectiveness of MPAs is monitoring of marine communities. Current monitoring methods rely heavily on SCUBA-based visual observations that are costly and time consuming, limiting the scope of MPA monitoring. Environmental DNA (eDNA) metabarcoding is a promising cost effective, rapid, and automatable alternative for marine ecosystem monitoring. However, as a developing tool, the utility of eDNA metabarcoding requires improved bioinformatic techniques and reference barcode databases. Furthermore, it is important to understand how eDNA metabarcoding performs relative to visual surveys to better understand the strengths and limitations of each approach. This thesis improves eDNA metabarcoding approaches to survey the nearshore rocky reef and kelp forest ecosystems within the Southern California MPA network. It then tests the effectiveness of eDNA metabarcoding against visual surveys conducted by the Channel Islands National Park Service ii Kelp Forest Monitoring Program and Reef Check California. In Chapter 1, I develop FishCARD, a 12S reference barcode database specific to fishes of the California Current ecosystem. -

In Marine Fishes, Abalistes Stellaris (Balistidae) from the Red Sea, Coast of Yemen
JKAU: Mar. Sci., Vol. 22, No. 1, pp: 3-13 (2011 A.D. / 1432 A.H.) DOI : 10.4197/Mar. 22-1.1 Hypocreadium cavum (Digenea: Lepocreadiidae: Hypocreadium) in Marine Fishes, Abalistes stellaris (Balistidae) From the Red Sea, Coast of Yemen. Ali B. Al-Zubaidy Department of Marine Biology and Fisheries, Faculty of Marine Science and Environment, Hodeidah University, Yemen Abstract. Specimens of the marine fish, Abalistes stellaris (Balistidae) were collected from local fish market in Hodeidah during the period between September 2008 and July 2010 . Six out of 80 (7.5%) of these fish were found to harbour intestinal trematodes, Hypocreadium cavum Bray and Cribb, 1996 (Lepocreadiidae). Since there is no previous report on these digenetic trematode from any fish host in Yemen, the present recording may well be considered the first in this country. Introduction Members of the Lepocreadiidae Odhner, 1905 have a cosmopolitan distribution as intestinal parasites of marine teleosts (Bartoli and Bray, 2004). They are recognizable as worms with widely distributed Vitelline folices, a spinous tegument, a cirrus-sac, usually with a distinct external seminal vesicle and a typically I-shaped excretory vesicle (Bray, 2005). Ozaki (1936) erected the genus Hypocreadium to include H.symmetrorchis in Monocanthus cirrhifer from Japan. Manter (1940), Arai (1962) and Nahhas and Cable (1964) concluded that Hypocreadium Ozaki,1936 should be considered as a synonym to Pseudocreadium Layman,1930. However, Yamaguti (1971) refused these conclusions and preferred to retain the genus Hypocreadium Ozaki, 1936 as a separate 3 4 Ali B. Al-Zubaidy genus which could be easily separated from other related genera according to the position of genital pore, ovary and prostate cells as well as the extension of the excretory vesicle. -

Redalyc.Peces De La Fauna De Acompañamiento En La Pesca
Revista de Biología Tropical ISSN: 0034-7744 [email protected] Universidad de Costa Rica Costa Rica López-Martínez, Juana; Herrera-Valdivia, Eloisa; Rodríguez-Romero, Jesús; Hernández-Vázquez, Sergio Peces de la fauna de acompañamiento en la pesca industrial de camarón en el Golfo de California, México Revista de Biología Tropical, vol. 58, núm. 3, septiembre, 2010, pp. 925-942 Universidad de Costa Rica San Pedro de Montes de Oca, Costa Rica Disponible en: http://www.redalyc.org/articulo.oa?id=44918839010 Cómo citar el artículo Número completo Sistema de Información Científica Más información del artículo Red de Revistas Científicas de América Latina, el Caribe, España y Portugal Página de la revista en redalyc.org Proyecto académico sin fines de lucro, desarrollado bajo la iniciativa de acceso abierto Peces de la fauna de acompañamiento en la pesca industrial de camarón en el Golfo de California, México Juana López-Martínez1, Eloisa Herrera-Valdivia1, Jesús Rodríguez-Romero2 & Sergio Hernández-Vázquez2 1. Centro de Investigaciones Biológicas del Noroeste, S.C. Km 2.35 Carretera a Las Tinajas, S/N Colonia Tinajas, Guaymas, Sonora, México C. P. 85460; [email protected], [email protected] 2. Centro de Investigaciones Biológicas del Noroeste, S.C. Apdo. postal 128 La Paz, B.C.S. C.P. 23000; [email protected], [email protected] Recibido 19-VII-2009. Corregido 15-III-2010. Aceptado 16-IV-2010. Abstract: Bycatch fish species from shrimp industrial fishery in the Gulf of California, Mexico. The shrimp fishery in the Gulf of California is one the most important activities of revenue and employment for communi- ties. -
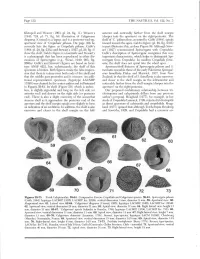
(1943: 724, Pi. 71, Fig. 16) Illustration of Calyptraea (Deeper Into the Aperture) on the Right/Posterior
Page 118 THE NAUTILUS, Vol. 122, No. 3 Kleinpeil and Weaver (1963, pi. 24, fig. 11). Weavers anterior and noticeably farther from the shell margin (1943: 724, pi. 71, fig. 16) illustration of Calyptraea (deeper into the aperture) on the right/posterior. The diegoana (Conrad) is a lapsus and is a posterior-end-up, shelf of 'C.y pileum thus, as noted by Gabb (1864), spirals apertural view of 'Crepidula' pileum. On page 356 he inward toward the apex. Gabb's figure (pi. 29, fig. 233b) correctly lists the figure as Crepidula pileum. Gabb's in part illustrates this, as does Figure 59. Although Stew- (1864: pi. 29, fig. 233a) and Stewart's (1927, pi. 29, fig. 3) art (1927) synonomized Spirocrypta with Crepidula, show the shelf. Gabb's figure is a fascimile and Stewart's Gabb's description of Spirocrypta recognizes this very is a photograph that has been reproduced in other dis- important characteristic, which helps to distinguish Spi- cussions of Spirocrypta (e.g., Wenz, 1940: 903, fig. rocrypta from Crepidula. In modern Crepidula forni- 2660a). Gabb's and Stewart's figures are based on lecto- cata, the shelf does not spiral into the whorl apex. type ANSP 4221, but, unfortunately, the shelf of this Aperture/shelf features of Spirocrypta pileum and S. specimen is broken. Both figures create the false impres- inomata resemble those of the early Paleocene Spirogal- sion that there is a sinus near both ends of the shelf and erus lamellaria Finlay and Marwick, 1937, from New that the middle part protrudes and is concave. -

Training Manual Series No.15/2018
View metadata, citation and similar papers at core.ac.uk brought to you by CORE provided by CMFRI Digital Repository DBTR-H D Indian Council of Agricultural Research Ministry of Science and Technology Central Marine Fisheries Research Institute Department of Biotechnology CMFRI Training Manual Series No.15/2018 Training Manual In the frame work of the project: DBT sponsored Three Months National Training in Molecular Biology and Biotechnology for Fisheries Professionals 2015-18 Training Manual In the frame work of the project: DBT sponsored Three Months National Training in Molecular Biology and Biotechnology for Fisheries Professionals 2015-18 Training Manual This is a limited edition of the CMFRI Training Manual provided to participants of the “DBT sponsored Three Months National Training in Molecular Biology and Biotechnology for Fisheries Professionals” organized by the Marine Biotechnology Division of Central Marine Fisheries Research Institute (CMFRI), from 2nd February 2015 - 31st March 2018. Principal Investigator Dr. P. Vijayagopal Compiled & Edited by Dr. P. Vijayagopal Dr. Reynold Peter Assisted by Aditya Prabhakar Swetha Dhamodharan P V ISBN 978-93-82263-24-1 CMFRI Training Manual Series No.15/2018 Published by Dr A Gopalakrishnan Director, Central Marine Fisheries Research Institute (ICAR-CMFRI) Central Marine Fisheries Research Institute PB.No:1603, Ernakulam North P.O, Kochi-682018, India. 2 Foreword Central Marine Fisheries Research Institute (CMFRI), Kochi along with CIFE, Mumbai and CIFA, Bhubaneswar within the Indian Council of Agricultural Research (ICAR) and Department of Biotechnology of Government of India organized a series of training programs entitled “DBT sponsored Three Months National Training in Molecular Biology and Biotechnology for Fisheries Professionals”. -

The Marine Biodiversity and Fisheries Catches of the Pitcairn Island Group
The Marine Biodiversity and Fisheries Catches of the Pitcairn Island Group THE MARINE BIODIVERSITY AND FISHERIES CATCHES OF THE PITCAIRN ISLAND GROUP M.L.D. Palomares, D. Chaitanya, S. Harper, D. Zeller and D. Pauly A report prepared for the Global Ocean Legacy project of the Pew Environment Group by the Sea Around Us Project Fisheries Centre The University of British Columbia 2202 Main Mall Vancouver, BC, Canada, V6T 1Z4 TABLE OF CONTENTS FOREWORD ................................................................................................................................................. 2 Daniel Pauly RECONSTRUCTION OF TOTAL MARINE FISHERIES CATCHES FOR THE PITCAIRN ISLANDS (1950-2009) ...................................................................................... 3 Devraj Chaitanya, Sarah Harper and Dirk Zeller DOCUMENTING THE MARINE BIODIVERSITY OF THE PITCAIRN ISLANDS THROUGH FISHBASE AND SEALIFEBASE ..................................................................................... 10 Maria Lourdes D. Palomares, Patricia M. Sorongon, Marianne Pan, Jennifer C. Espedido, Lealde U. Pacres, Arlene Chon and Ace Amarga APPENDICES ............................................................................................................................................... 23 APPENDIX 1: FAO AND RECONSTRUCTED CATCH DATA ......................................................................................... 23 APPENDIX 2: TOTAL RECONSTRUCTED CATCH BY MAJOR TAXA ............................................................................ -

First Documented Record of the Ocean Sunfish, Mola Mola
ZOBODAT - www.zobodat.at Zoologisch-Botanische Datenbank/Zoological-Botanical Database Digitale Literatur/Digital Literature Zeitschrift/Journal: Stuttgarter Beiträge Naturkunde Serie A [Biologie] Jahr/Year: 2013 Band/Volume: NS_6_A Autor(en)/Author(s): Jawad Laith A. Artikel/Article: First documented record of the ocean sunfish, Mola mola (Linnaeus), from the Sea of Oman, Sultanate of Oman (Teleostei: Molidae) 287-290 Stuttgarter Beiträge zur Naturkunde A, Neue Serie 6: 287–290; Stuttgart, 30.IV.2013 287 First documented record of the ocean sunfish, Mola mola (Linnaeus), from the Sea of Oman, Sultanate of Oman (Teleostei: Molidae) LAITH A. JAWAD Abstract The first assured record of the ocean sunfish, Mola mola (Linnaeus, 1758), in Omani waters is reported based on a specimen of 1350 mm total length which has stranded on the coast of Quriat City, 120 km north of Muscat, the capital of Oman. Morphometric and meristic data are provided and compared with those of several specimens of this species from other parts of the world. K e y w o r d s : Sea of Oman; Molidae; range extension. Zusammenfassung Der Mondfisch, Mola mola (Linnaeus, 1758), wird zum ersten Mal für Oman bestätigt. Der Nachweis basiert auf einem 1350 mm langen Exemplar, das an der Küste von Quriat City, 120 km nördlich der omanischen Hauptstadt Muscat gestrandet ist. Morphometrische und meristische Daten dieses Exemplares werden gegeben und mit einigen anderen Belegen weltweit verglichen. Contents 1 Introduction ...........................................................................................................................................................287 -

(Digenea: Lepocreadiidae) in The
Zootaxa 1326: 37–44 (2006) ISSN 1175-5326 (print edition) www.mapress.com/zootaxa/ ZOOTAXA 1326 Copyright © 2006 Magnolia Press ISSN 1175-5334 (online edition) Hypocreadium toombo n. sp. (Digenea: Lepocreadiidae) in the yellow-spotted triggerfish Pseudobalistes fuscus (Perciformes: Balistidae) and additional lepocreadiids parasitizing fishes from the waters off New Caledonia RODNEY A. BRAY1 & JEAN-LOU JUSTINE2 1Department of Zoology, Natural History Museum, Cromwell Road, London SW7 5BD, UK. 2Équipe Biogéographie Marine Tropicale, Unité Systématique, Adaptation, Évolution (CNRS, UPMC, MNHN, IRD), Institut de Recherche pour le Développement, BP A5, 98848 Nouméa Cedex, Nouvelle Calédonie. Abstract Hypocreadium toombo n. sp. is described from the balistid Pseudobalistes fuscus from the waters off New Caledonia. It is distinguished by a series of characters shared by no other Hypocreadium species. The specimens are always slightly longer than wide, have a distinct anterior notch, have the vitelline fields confluent or nearly so in the forebody and have the terminal ends of the caeca pointing anteriorly. Other lepocreadiid species also recorded from New Caledonian waters are Lobatocreadium exiguum from P. fuscus, Intusatrium robustum from Bodianus perditio and B. loxozonus, Postlepidapedon secundum from Choerodon graphicus and Lepidapedoides angustus from Epinephelus fasciatus. Key words: Digenea, Lepocreadiidae, Hypocreadium toombo n. sp., Balistidae, Pseudobalistes fuscus, Lobatocreadium exiguum, Intusatrium robustum, Bodianus perditio, Bodianus loxozonus, Postlepidapedon secundum, Choerodon graphicus, Lepidapedoides angustus, Epinephelus fasciatus, New Caledonia Introduction In their review of Hypocreadium Ozaki, Bray & Cribb (1996) summarised members as being ‘Broadly oval to rounded worms, with a weakly lobed or entire ovary, and with the dorsal excretory pore at the level of the caecal ends or more anterior, nearly always in Tetraodontiformes’. -

Bivalves and Gastropods of the Gulf of Tehuantepec, Mexico: a Checklist of Species with Notes on Their Habitat and Local Distribution
Hindawi Publishing Corporation Journal of Marine Biology Volume 2009, Article ID 176801, 12 pages doi:10.1155/2009/176801 Research Article Bivalves and Gastropods of the Gulf of Tehuantepec, Mexico: A Checklist of Species with Notes on Their Habitat and Local Distribution Eduardo Rıos-Jara,´ Ceciel-M. Navarro-Caravantes, Cristian-M. Galvan-Villa,´ and Ernesto Lopez-Uriarte Laboratorio de Ecosistemas Marinos y Acuicultura, Departamento de Ecolog´ıa, Centro Universitario de Ciencias Biologicas´ y Agropecuarias, Universidad de Guadalajara, Carretera a Nogales Km. 15.5, Las Agujas Nextipac, Zapopan, Jalisco 45110, Mexico Correspondence should be addressed to Eduardo R´ıos-Jara, [email protected] Received 1 April 2009; Accepted 19 October 2009 Recommended by Ricardo Serrao˜ Santos The taxonomic composition of 160 species of bivalves and gastropods recorded in the Gulf of Tehuantepec is presented with information on their habitat and distribution along 10 different localities of the shoreline and 42 stations of the continental shelf. The species were on sandy and rocky beaches, coastal lagoons, estuaries, mangroves, rocky breakwaters of ports, and shallow subtidal areas (14–47 m depth). A total of 78 bivalve species and 82 gastropod species were recorded. Most of these were associated with sandy and rocky beaches and breakwaters of ports. The estuaries host 30 species and the coastal lagoons only two. In the shallow subtidal there were 18 gastropod species and 40 bivalve species representing 36.3% of all. This study adds 24 bivalve species and 29 gastropod species not recorded in previous studies for a total count of 213 species (102 bivalves and 111 gastropods) for Gulf of Tehuantepec.