Revista UVO 2018.Indd
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Notas De La Anidación Del Rascón De Manglar Rallus Longirostris (Gruiformes: Rallidae) En El Salvador
Revista Multidisciplinaria de la Universidad de El Salvador • Revista Minerva (2020) 3(1) • pp. 141-150 Plataforma digital de la revista: https://minerva.sic.ues.edu.sv Notas de la anidación del Rascón de Manglar Rallus longirostris (Gruiformes: Rallidae) en El Salvador Nesting notes of the Mangrove Rail Rallus longirostris (Gruiformes: Rallidae) in El Salvador Luis Pineda1, Larissa Beltrán2, Moisés Herrera3, Alcides Sorto3 RESUMEN Presentamos información de la anidación del Rascón de Manglar Rallus longirostris en Bahía de La Unión, que representa la primera zona reproductiva de esta especie en El Salvador. Describimos características de los nidos, huevos, polluelos y su ubicación. La especie fue registrada por primera vez en 2013 mediante la grabación de vocalizaciones en el Golfo de Fonseca. El nido se encontró a una altura de 1 m, elaborado de ramas de mangle entrelazadas y una base de hojas, en forma de canasta de 28 cm de diámetro, contenía cinco huevos de coloración blanquecinos con manchas marrones, los cuales median 4.5x3.5 cm, el período reproductivo es de mayo a noviembre. Palabras clave: Anidación, La Unión, Rascón de Manglar, Rallus longirostris, reproducción. ABSTRACT We present information on the nesting of the Mangrove Rail Rallus longirostris in Bahía de La Unión, which represents the first reproductive area of this species in El Salvador. We describe the characteristics of nests, eggs, chicks and their location. The species was first recorded in 2013 when recording vocalizations in the Golfo de Fonseca. The nest was found at a height of 1 m, made of interlocking mangrove branches and a base of leaves, in the form of a 28 cm diameter basket, containing five whitish eggs with brown spots, measuring 4.5x3.5 cm, the reproductive period is from May to November. -

Breeding Biology of the Sayaca Tanager (Thraupis Sayaca)In Southeast Brazil A
JOURNAL OF NATURAL HISTORY 2019, VOL. 53, NOS. 39–40, 2397–2412 https://doi.org/10.1080/00222933.2019.1704462 Breeding biology of the Sayaca Tanager (Thraupis sayaca)in southeast Brazil A. F. Batisteli a, E. N. da Silva Netoa, T. P. Soaresb, M. A. Pizo c and H. Sarmento d aPrograma de Pós-Graduação em Ecologia e Recursos Naturais, Universidade Federal de São Carlos, São Carlos, Brazil; bCentro de Ciências Biológicas e da Saúde, Universidade Federal de São Carlos, São Carlos, Brazil; cInstituto de Biociências, Universidade Estadual Paulista Júlio de Mesquita Filho, Rio Claro, Brazil; dDepartamento de Hidrobiologia, Universidade Federal de São Carlos, São Carlos, Brazil ABSTRACT ARTICLE HISTORY Thraupis is a genus of the American endemic Thraupidae (subfamily Received 15 July 2019 Thraupinae), comprising seven species that inhabit tropical forests Accepted 10 December 2019 to urban centres. The Sayaca Tanager (Thraupis sayaca)is KEYWORDS a disturbance-tolerant species of high representativeness in plant- Neotropical; nesting frugivore networks, but information on its breeding biology is behaviour; parental care; scarce and often restricted to non-systematic surveys. We studied Thraupidae; urban bird the breeding biology of the T. sayaca, following 39 active nests in a periurban area of southeast Brazil during two breeding seasons (2017/2018, 2018/2019). The breeding season ranged from early September to middle December, and the nests were placed in native and exotic plants and human buildings (nest height above ground: 3.35 ± 1.73 m, mean ± SD). Only females incubated and brooded, but both adults built the nests, fed the nestlings, and removed their faecal sacs. -

Download Download
Journal of Caribbean Ornithology RESEARCH ARTICLE Vol. 33:1–14. 2020 Composition of bird community in Portachuelo Pass (Henri Pittier National Park, Venezuela) Cristina Sainz-Borgo Jhonathan Miranda Miguel Lentino Photo: Pedro Arturo Amaro Journal of Caribbean Ornithology jco.birdscaribbean.org ISSN 1544-4953 RESEARCH ARTICLE Vol. 33:1–14. 2020 birdscaribbean.org Composition of bird community in Portachuelo Pass (Henri Pittier National Park, Venezuela) Cristina Sainz-Borgo1, Jhonathan Miranda2, and Miguel Lentino3 Abstract The purpose of this study was to describe the composition of the bird community in Portachuelo Pass, located in Henri Pittier National Park, Venezuela. Portachuelo Pass is an important route for migratory birds between northern South America and the Southern Cone. During 11 months of sampling between 2010 and 2012, we captured 1,460 birds belonging to 125 identified species, 29 families, and 9 orders. The families with the highest relative abundance and species richness were Trochilidae and Thraupidae and the most common species were the Violet-chested Hummingbird (Sternoclyta cyanopectus), Olive-striped Flycatcher (Mionectes olivaceus), Plain-brown Woodcreeper (Dendrocincla fuliginosa), Orange-bellied Euphonia (Euphonia xanthogaster), Violet-fronted Brilliant (Heliodoxa leadbeateri), Vaux’s Swift (Chaetura vauxi), Red-eared Parakeet (Pyrrhura hoematotis), Golden-tailed Sapphire (Chrysuronia oenone), Black-hooded Thrush (Turdus olivater), and Gray-rumped Swift (Chaetura cinereiventris). These species represented 52.4% of total captures and 8.0% of identified species. We captured 5 endemic species and 8 migratory species. The months of greatest relative abundance and species richness were June and July 2010 and January 2011. Birds captured belonged to the following feeding guilds: insectivorous, nectarivorous-insectivorous, frugivorous, frugivorous-insectivorous, granivorous, frugivorous-folivorous, omnivorous, carnivorous, and frugivorous-graniv- orous. -

Ecuador: HARPY EAGLE & EAST ANDEAN FOOTHILLS EXTENSION
Tropical Birding Trip Report Ecuador: HARPY EAGLE & East Andean Foothills Extension (Jan-Feb 2021) A Tropical Birding custom extension Ecuador: HARPY EAGLE & EAST ANDEAN FOOTHILLS EXTENSION th nd 27 January - 2 February 2021 The main motivation for this custom extension was this Harpy Eagle. This was one of an unusually accessible nesting pair near the Amazonian town of Limoncocha that provided a worthy add-on to The Andes Introtour in northwest Ecuador that preceded this (Jose Illanes/Tropical Birding Tours). Guided by Jose Illanes Birds in the photos within this report are denoted in RED, all photos were taken by the Tropical Birding guide. 1 www.tropicalbirding.com +1-409-515-9110 [email protected] Tropical Birding Trip Report Ecuador: HARPY EAGLE & East Andean Foothills Extension (Jan-Feb 2021) INTRODUCTION This custom extension trip was set up for one person who simply could not get enough of Ecuador…John had just finished Ecuador: The Andes Introtour, in the northwest of the country, and also joined the High Andes Extension to that tour, which sampled the eastern highlands too. However, he was still missing vast chunks of this small country that is bursting with bird diversity. Most importantly, he was keen to get in on the latest “mega bird” in Ecuador, a very accessible Harpy Eagle nest, near a small Amazonian town, which had been hitting the local headlines and drawing the few birding tourists in the country at this time to come see it. With this in mind, TROPICAL BIRDING has been offering custom add-ons to all of our Ecuador offerings (for 2021 and 2022) to see this Harpy Eagle pair, with only three extra days needed to see it. -

Information Sheet on Ramsar Wetlands (RIS) – 2009-2012 Version Available for Download From
Information Sheet on Ramsar Wetlands (RIS) – 2009-2012 version Available for download from http://www.ramsar.org/ris/key_ris_index.htm. Categories approved by Recommendation 4.7 (1990), as amended by Resolution VIII.13 of the 8th Conference of the Contracting Parties (2002) and Resolutions IX.1 Annex B, IX.6, IX.21 and IX. 22 of the 9th Conference of the Contracting Parties (2005). Notes for compilers: 1. The RIS should be completed in accordance with the attached Explanatory Notes and Guidelines for completing the Information Sheet on Ramsar Wetlands. Compilers are strongly advised to read this guidance before filling in the RIS. 2. Further information and guidance in support of Ramsar site designations are provided in the Strategic Framework and guidelines for the future development of the List of Wetlands of International Importance (Ramsar Wise Use Handbook 14, 3rd edition). A 4th edition of the Handbook is in preparation and will be available in 2009. 3. Once completed, the RIS (and accompanying map(s)) should be submitted to the Ramsar Secretariat. Compilers should provide an electronic (MS Word) copy of the RIS and, where possible, digital copies of all maps. 1. Name and address of the compiler of this form: FOR OFFICE USE ONLY. DD MM YY Beatriz de Aquino Ribeiro - Bióloga - Analista Ambiental / [email protected], (95) Designation date Site Reference Number 99136-0940. Antonio Lisboa - Geógrafo - MSc. Biogeografia - Analista Ambiental / [email protected], (95) 99137-1192. Instituto Chico Mendes de Conservação da Biodiversidade - ICMBio Rua Alfredo Cruz, 283, Centro, Boa Vista -RR. CEP: 69.301-140 2. -

Alpha Codes for 2168 Bird Species (And 113 Non-Species Taxa) in Accordance with the 62Nd AOU Supplement (2021), Sorted Taxonomically
Four-letter (English Name) and Six-letter (Scientific Name) Alpha Codes for 2168 Bird Species (and 113 Non-Species Taxa) in accordance with the 62nd AOU Supplement (2021), sorted taxonomically Prepared by Peter Pyle and David F. DeSante The Institute for Bird Populations www.birdpop.org ENGLISH NAME 4-LETTER CODE SCIENTIFIC NAME 6-LETTER CODE Highland Tinamou HITI Nothocercus bonapartei NOTBON Great Tinamou GRTI Tinamus major TINMAJ Little Tinamou LITI Crypturellus soui CRYSOU Thicket Tinamou THTI Crypturellus cinnamomeus CRYCIN Slaty-breasted Tinamou SBTI Crypturellus boucardi CRYBOU Choco Tinamou CHTI Crypturellus kerriae CRYKER White-faced Whistling-Duck WFWD Dendrocygna viduata DENVID Black-bellied Whistling-Duck BBWD Dendrocygna autumnalis DENAUT West Indian Whistling-Duck WIWD Dendrocygna arborea DENARB Fulvous Whistling-Duck FUWD Dendrocygna bicolor DENBIC Emperor Goose EMGO Anser canagicus ANSCAN Snow Goose SNGO Anser caerulescens ANSCAE + Lesser Snow Goose White-morph LSGW Anser caerulescens caerulescens ANSCCA + Lesser Snow Goose Intermediate-morph LSGI Anser caerulescens caerulescens ANSCCA + Lesser Snow Goose Blue-morph LSGB Anser caerulescens caerulescens ANSCCA + Greater Snow Goose White-morph GSGW Anser caerulescens atlantica ANSCAT + Greater Snow Goose Intermediate-morph GSGI Anser caerulescens atlantica ANSCAT + Greater Snow Goose Blue-morph GSGB Anser caerulescens atlantica ANSCAT + Snow X Ross's Goose Hybrid SRGH Anser caerulescens x rossii ANSCAR + Snow/Ross's Goose SRGO Anser caerulescens/rossii ANSCRO Ross's Goose -

ABSTRACT Title of Dissertation: SECRETIVE MARSHBIRDS of URBAN WETLANDS in the WASHINGTON, DC METROPOLITAN AREA Patrice Nielson
ABSTRACT Title of Dissertation: SECRETIVE MARSHBIRDS OF URBAN WETLANDS IN THE WASHINGTON, DC METROPOLITAN AREA Patrice Nielson, Doctor of Philosophy 2016 Dissertation directed by: Dr. William Bowerman and Dr. Andrew Baldwin Environmental Science and Technology Secretive marshbirds are in decline across their range and are species of greatest conservation need in state Wildlife Action Plans. However, their secretive nature means there is relatively sparse information available on their ecology. There is demand for this information in the Washington, DC area for updating conservation plans and guiding wetland restoration. Rapid Wetland Assessment Methods are often used to monitor success of restoration but it is unknown how well they indicate marshbird habitat. Using the Standardized North American Marshbird Monitoring Protocol, I surveyed 51 points in 25 marshes in the DC area in 2013 – 2015. I also collected data on marsh area, buffer width, vegetation/water interspersion, vegetation characteristics, flooding, and invertebrates. At each bird survey point I assessed wetland quality using the Floristic Quality Assessment Index (FQAI) and California Rapid Wetland Assessment (CRAM) methods. I used Program Presence to model detection and occupancy probabilities of secretive marshbirds as a function of habitat variables. I found king rails (Rallus elegans) at five survey sites and least bittern (Ixobrychus exilis) at thirteen survey sites. Secretive marshbirds were using both restored and natural marshes, marshes with and without invasive plant species, and marshes with a variety of dominant vegetation species. King rail occupancy was positively correlated with plant diversity and invertebrate abundance and weakly negatively correlated with persistent vegetation. Least bittern occupancy was strongly negatively correlated woody vegetation and invertebrate abundance and weakly positively correlated with persistent vegetation. -
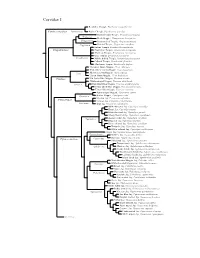
Corvidae Species Tree
Corvidae I Red-billed Chough, Pyrrhocorax pyrrhocorax Pyrrhocoracinae =Pyrrhocorax Alpine Chough, Pyrrhocorax graculus Ratchet-tailed Treepie, Temnurus temnurus Temnurus Black Magpie, Platysmurus leucopterus Platysmurus Racket-tailed Treepie, Crypsirina temia Crypsirina Hooded Treepie, Crypsirina cucullata Rufous Treepie, Dendrocitta vagabunda Crypsirininae ?Sumatran Treepie, Dendrocitta occipitalis ?Bornean Treepie, Dendrocitta cinerascens Gray Treepie, Dendrocitta formosae Dendrocitta ?White-bellied Treepie, Dendrocitta leucogastra Collared Treepie, Dendrocitta frontalis ?Andaman Treepie, Dendrocitta bayleii ?Common Green-Magpie, Cissa chinensis ?Indochinese Green-Magpie, Cissa hypoleuca Cissa ?Bornean Green-Magpie, Cissa jefferyi ?Javan Green-Magpie, Cissa thalassina Cissinae ?Sri Lanka Blue-Magpie, Urocissa ornata ?White-winged Magpie, Urocissa whiteheadi Urocissa Red-billed Blue-Magpie, Urocissa erythroryncha Yellow-billed Blue-Magpie, Urocissa flavirostris Taiwan Blue-Magpie, Urocissa caerulea Azure-winged Magpie, Cyanopica cyanus Cyanopica Iberian Magpie, Cyanopica cooki Siberian Jay, Perisoreus infaustus Perisoreinae Sichuan Jay, Perisoreus internigrans Perisoreus Gray Jay, Perisoreus canadensis White-throated Jay, Cyanolyca mirabilis Dwarf Jay, Cyanolyca nanus Black-throated Jay, Cyanolyca pumilo Silvery-throated Jay, Cyanolyca argentigula Cyanolyca Azure-hooded Jay, Cyanolyca cucullata Beautiful Jay, Cyanolyca pulchra Black-collared Jay, Cyanolyca armillata Turquoise Jay, Cyanolyca turcosa White-collared Jay, Cyanolyca viridicyanus -

Splits, Lumps and Shuffles Splits, Lumps and Shuffles Alexander C
>> SPLITS, LUMPS AND SHUFFLES Splits, lumps and shuffles Alexander C. Lees This series focuses on recent taxonomic proposals—be they entirely new species, splits, lumps or reorganisations—that are likely to be of greatest interest to birders. This latest instalment includes papers relating to a stunning new species of storm petrel, a barrage of rail, woodpecker and tyrannulet splits, insights into some duck, parrot and parrotlet relationships, the to-be-expected furnariid splits, lumps and shuffles (note however not an antbird or tapaculo in sight) and more analyses of old favourites such a Common Bush Tanagers and Rufous-naped Wrens. Get your lists out! A new storm petrel from Chile cyanoptera occurring from southern Peru and southern Brazil to Tierra del Fuego. Wilson et The saga of the uniquely-patterned storm petrels al. (2013) investigated patterns of genetic and first seen on ferry crossings in the Puerto Montt phenotypic divergence between the small-bodied and Chacao channel area (crossing to the Chiloé lowland A. c. cyanoptera and the larger bodied Archipelago), Chile, has finally ended with the highland A. c. orinomus which inhabits hypoxic formal description of a new species. First seen in (low oxygen) Andean water bodies. The subspecies the field as long ago as 1983, it wasn’t until the orinomus is significantly larger with significant publication of a series of images (O’Keeffe et al. frequency differences in a single α-hemoglobin 2009) that the wider birding public became aware amino acid polymorphism (adaptions both to of this undescribed taxon. However, all-the-while, the cold and to low oxygen environments). -

Adobe PDF, Job 6
Noms français des oiseaux du Monde par la Commission internationale des noms français des oiseaux (CINFO) composée de Pierre DEVILLERS, Henri OUELLET, Édouard BENITO-ESPINAL, Roseline BEUDELS, Roger CRUON, Normand DAVID, Christian ÉRARD, Michel GOSSELIN, Gilles SEUTIN Éd. MultiMondes Inc., Sainte-Foy, Québec & Éd. Chabaud, Bayonne, France, 1993, 1re éd. ISBN 2-87749035-1 & avec le concours de Stéphane POPINET pour les noms anglais, d'après Distribution and Taxonomy of Birds of the World par C. G. SIBLEY & B. L. MONROE Yale University Press, New Haven and London, 1990 ISBN 2-87749035-1 Source : http://perso.club-internet.fr/alfosse/cinfo.htm Nouvelle adresse : http://listoiseauxmonde.multimania. -

Suriname! (Dani Lopez-Velasco)
Visiting a lek of the stunning Guianan Cock-of-the-Rock is definitely a must for any birder. And there´s no better place to do it than Suriname! (Dani Lopez-Velasco) SURINAME 23 FEBRUARY – 9/14 MARCH 2015 LEADER: DANI LOPEZ VELASCO and SEAN DILROSUN On our third tour to Suriname we amassed a great list of Guianan specialities, next to a splendid selection of more widespread, but rarely seen species. Our intrepid group recorded 404 species of birds, 16 mammals and some lovely ‘herps’ in this little country with its surface of about eight times Wales and its population of just over half a million people. We visited five different areas comprising three distinct ecosystems. It started with a short visit to the white sand grasslands and scrub of central Suriname where Black-faced Hawk, Bronzy Jacamar, Point-tailed Palmcreeper, Saffron-crested Tyrant–Manakin, Black Manakin and Glossy- backed Becard grabbed our attention. It continued with the famous Raleigh Falls and the Voltzberg, where many Guianan Cocks-of-the-Rock put on an unforgettable show on their lek, while other major avian highlights included brilliant Pompadour Cotingas, massive Black-throated and the very localized Band-tailed 1 BirdQuest Tour Report: Suriname www.birdquest-tours.com Antshrikes and delightful Red-billed Pied Tanagers. The misty forests of the Brownsberg were lighted up by incredibly tame Grey-winged Trumpeters and Black Curassows, rare Racket-tailed and stunning Tufted Coquettes, gaudy Blue-backed Tanagers and delicate White-fronted Manakins, colorful Rose-breasted Chats and much wanted Red-and black Grosbeaks. The coastal area held goodies like Scarlet Ibis, Rufous Crab Hawk, localized Arrowhead Piculets and Blood-coloured Woodpeckers and striking Crimson-hooded Manakins. -

Succinct Suriname: Cotingas & Trumpeters 2020
Field Guides Tour Report Succinct Suriname: Cotingas & Trumpeters 2020 Jan 18, 2020 to Jan 29, 2020 Dave Stejskal & Micah Riegner with Sean Dilrosun For our tour description, itinerary, past triplists, dates, fees, and more, please VISIT OUR TOUR PAGE. We were able to get eyeball-to-eyeball views of several incomparable male Guianan Cocks-of-the-rock at Fredberg. (photo by guide Micah Riegner) This was the first 'official' run of our revamped Succinct Suriname tour, and I'd have to say that it was roaring success! With productive visits to all four of our varied habitat venues, we really cleaned up on the overwhelming majority of the possible Guianan Shield specialties. The generally good weather helped us out – as did that nice guide/client ratio! After a late-arriving flight from Miami at the start of the tour, our eager group wanted to get out there and start birding right away. So, it was off to Peperpot Nature Park across the Suriname River for an excellent morning of birding in the coastal plain habitats. The old, overgrown coffee and cacao plantation at this site held some of our most localized targets – Arrowhead Piculet & Blood-colored Woodpecker – both eventually showing well. A stunning Cream-colored Woodpecker and a male Crimson-hooded Manakin were breathtaking to see. We also had a great morning with the antbirds in this habitat, scoring on not only nominate Blackish Antbird, but also Silvered, White-browed, Black-chinned, and Black-throated antbirds, too! We'd go on to tally some 40 species of "antthings" during the course of this tour.