Spektrum Humangenetik 2016
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

A Computational Approach for Defining a Signature of Β-Cell Golgi Stress in Diabetes Mellitus
Page 1 of 781 Diabetes A Computational Approach for Defining a Signature of β-Cell Golgi Stress in Diabetes Mellitus Robert N. Bone1,6,7, Olufunmilola Oyebamiji2, Sayali Talware2, Sharmila Selvaraj2, Preethi Krishnan3,6, Farooq Syed1,6,7, Huanmei Wu2, Carmella Evans-Molina 1,3,4,5,6,7,8* Departments of 1Pediatrics, 3Medicine, 4Anatomy, Cell Biology & Physiology, 5Biochemistry & Molecular Biology, the 6Center for Diabetes & Metabolic Diseases, and the 7Herman B. Wells Center for Pediatric Research, Indiana University School of Medicine, Indianapolis, IN 46202; 2Department of BioHealth Informatics, Indiana University-Purdue University Indianapolis, Indianapolis, IN, 46202; 8Roudebush VA Medical Center, Indianapolis, IN 46202. *Corresponding Author(s): Carmella Evans-Molina, MD, PhD ([email protected]) Indiana University School of Medicine, 635 Barnhill Drive, MS 2031A, Indianapolis, IN 46202, Telephone: (317) 274-4145, Fax (317) 274-4107 Running Title: Golgi Stress Response in Diabetes Word Count: 4358 Number of Figures: 6 Keywords: Golgi apparatus stress, Islets, β cell, Type 1 diabetes, Type 2 diabetes 1 Diabetes Publish Ahead of Print, published online August 20, 2020 Diabetes Page 2 of 781 ABSTRACT The Golgi apparatus (GA) is an important site of insulin processing and granule maturation, but whether GA organelle dysfunction and GA stress are present in the diabetic β-cell has not been tested. We utilized an informatics-based approach to develop a transcriptional signature of β-cell GA stress using existing RNA sequencing and microarray datasets generated using human islets from donors with diabetes and islets where type 1(T1D) and type 2 diabetes (T2D) had been modeled ex vivo. To narrow our results to GA-specific genes, we applied a filter set of 1,030 genes accepted as GA associated. -
(P -Value<0.05, Fold Change≥1.4), 4 Vs. 0 Gy Irradiation
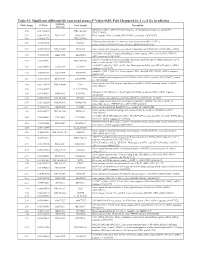
Table S1: Significant differentially expressed genes (P -Value<0.05, Fold Change≥1.4), 4 vs. 0 Gy irradiation Genbank Fold Change P -Value Gene Symbol Description Accession Q9F8M7_CARHY (Q9F8M7) DTDP-glucose 4,6-dehydratase (Fragment), partial (9%) 6.70 0.017399678 THC2699065 [THC2719287] 5.53 0.003379195 BC013657 BC013657 Homo sapiens cDNA clone IMAGE:4152983, partial cds. [BC013657] 5.10 0.024641735 THC2750781 Ciliary dynein heavy chain 5 (Axonemal beta dynein heavy chain 5) (HL1). 4.07 0.04353262 DNAH5 [Source:Uniprot/SWISSPROT;Acc:Q8TE73] [ENST00000382416] 3.81 0.002855909 NM_145263 SPATA18 Homo sapiens spermatogenesis associated 18 homolog (rat) (SPATA18), mRNA [NM_145263] AA418814 zw01a02.s1 Soares_NhHMPu_S1 Homo sapiens cDNA clone IMAGE:767978 3', 3.69 0.03203913 AA418814 AA418814 mRNA sequence [AA418814] AL356953 leucine-rich repeat-containing G protein-coupled receptor 6 {Homo sapiens} (exp=0; 3.63 0.0277936 THC2705989 wgp=1; cg=0), partial (4%) [THC2752981] AA484677 ne64a07.s1 NCI_CGAP_Alv1 Homo sapiens cDNA clone IMAGE:909012, mRNA 3.63 0.027098073 AA484677 AA484677 sequence [AA484677] oe06h09.s1 NCI_CGAP_Ov2 Homo sapiens cDNA clone IMAGE:1385153, mRNA sequence 3.48 0.04468495 AA837799 AA837799 [AA837799] Homo sapiens hypothetical protein LOC340109, mRNA (cDNA clone IMAGE:5578073), partial 3.27 0.031178378 BC039509 LOC643401 cds. [BC039509] Homo sapiens Fas (TNF receptor superfamily, member 6) (FAS), transcript variant 1, mRNA 3.24 0.022156298 NM_000043 FAS [NM_000043] 3.20 0.021043295 A_32_P125056 BF803942 CM2-CI0135-021100-477-g08 CI0135 Homo sapiens cDNA, mRNA sequence 3.04 0.043389246 BF803942 BF803942 [BF803942] 3.03 0.002430239 NM_015920 RPS27L Homo sapiens ribosomal protein S27-like (RPS27L), mRNA [NM_015920] Homo sapiens tumor necrosis factor receptor superfamily, member 10c, decoy without an 2.98 0.021202829 NM_003841 TNFRSF10C intracellular domain (TNFRSF10C), mRNA [NM_003841] 2.97 0.03243901 AB002384 C6orf32 Homo sapiens mRNA for KIAA0386 gene, partial cds. -

1 the TRAPP Complex Mediates Secretion Arrest Induced
bioRxiv preprint doi: https://doi.org/10.1101/528380; this version posted January 23, 2019. The copyright holder for this preprint (which was not certified by peer review) is the author/funder, who has granted bioRxiv a license to display the preprint in perpetuity. It is made available under aCC-BY-ND 4.0 International license. 1 The TRAPP complex mediates secretion arrest induced by stress granule assembly 2 3 Francesca Zappa1, Cathal Wilson1, Giuseppe Di Tullio1, Michele Santoro1, Piero Pucci2, 4 Maria Monti2, Davide D’Amico1, Sandra Pisonero Vaquero1, Rossella De Cegli1, 5 Alessia Romano1, Moin A. Saleem3, Elena Polishchuk1, Mario Failli1, Laura Giaquinto1, 6 Maria Antonietta De Matteis1, 2 7 1 Telethon Institute of Genetics and Medicine, Pozzuoli (Naples), Italy 8 2 Federico II University, Naples, Italy 9 3 Bristol Renal, Bristol Medical School, University of Bristol, UK 10 11 Correspondence to: [email protected], [email protected] 12 1 bioRxiv preprint doi: https://doi.org/10.1101/528380; this version posted January 23, 2019. The copyright holder for this preprint (which was not certified by peer review) is the author/funder, who has granted bioRxiv a license to display the preprint in perpetuity. It is made available under aCC-BY-ND 4.0 International license. 13 The TRAnsport Protein Particle (TRAPP) complex controls multiple steps along the 14 secretory, endocytic and autophagic pathways and is thus strategically positioned 15 to mediate the adaptation of membrane trafficking to diverse environmental 16 conditions including acute stress. We identified TRAPP as a key component of a 17 branch of the integrated stress response that impinges on the secretory pathway. -

X-Linked Spondyloepiphyseal Dysplasia Tarda
X-linked spondyloepiphyseal dysplasia tarda Description X-linked spondyloepiphyseal dysplasia tarda is a condition that impairs bone growth and occurs almost exclusively in males. The name of the condition indicates that it affects the bones of the spine (spondylo-) and the ends of long bones (epiphyses) in the arms and legs. "Tarda" indicates that signs and symptoms of this condition are not present at birth, but appear later in childhood, typically between ages 6 and 10. Males with X-linked spondyloepiphyseal dysplasia tarda have skeletal abnormalities and short stature. Affected boys grow steadily until late childhood, when their growth slows. Their adult height ranges from 4 feet 6 inches (137 cm) to 5 feet 4 inches (163 cm). Impaired growth of the spinal bones (vertebrae) primarily causes the short stature. Spinal abnormalities include flattened vertebrae (platyspondyly) with hump-shaped bulges, progressive thinning of the discs between vertebrae, and an abnormal curvature of the spine (scoliosis or kyphosis). These spinal problems also cause back pain in people with this condition. Individuals with X-linked spondyloepiphyseal dysplasia tarda have a short torso and neck, and their arms are disproportionately long compared to their height. Other skeletal features of X-linked spondyloepiphyseal dysplasia tarda include an abnormality of the hip joint that causes the upper leg bones to turn inward (coxa vara); multiple abnormalities of the epiphyses, including a short upper end of the thigh bone ( femoral neck); and a broad, barrel-shaped chest. A painful joint condition called osteoarthritis that typically occurs in older adults often develops in early adulthood in people with X-linked spondyloepiphyseal dysplasia tarda and worsens over time, most often affecting the hips, knees, and shoulders. -

1 the TRAPP Complex Mediates Secretion Arrest Induced by Stress Granule Assembly Francesca Zappa1, Cathal Wilson1, Giusepp
bioRxiv preprint doi: https://doi.org/10.1101/528380; this version posted February 5, 2019. The copyright holder for this preprint (which was not certified by peer review) is the author/funder, who has granted bioRxiv a license to display the preprint in perpetuity. It is made available under aCC-BY-ND 4.0 International license. The TRAPP complex mediates secretion arrest induced by stress granule assembly Francesca Zappa1, Cathal Wilson1, Giuseppe Di Tullio1, Michele Santoro1, Piero Pucci2, Maria Monti2, Davide D’Amico1, Sandra Pisonero Vaquero1, Rossella De Cegli1, Alessia Romano1, Moin A. Saleem3, Elena Polishchuk1, Mario Failli1, Laura Giaquinto1, Maria Antonietta De Matteis1, 2 1 Telethon Institute of Genetics and Medicine, Pozzuoli (Naples), Italy 2 Federico II University, Naples, Italy 3 Bristol Renal, Bristol Medical School, University of Bristol, UK Correspondence to: [email protected], [email protected] 1 bioRxiv preprint doi: https://doi.org/10.1101/528380; this version posted February 5, 2019. The copyright holder for this preprint (which was not certified by peer review) is the author/funder, who has granted bioRxiv a license to display the preprint in perpetuity. It is made available under aCC-BY-ND 4.0 International license. The TRAnsport-Protein-Particle (TRAPP) complex controls multiple membrane trafficking steps and is thus strategically positioned to mediate cell adaptation to diverse environmental conditions, including acute stress. We have identified TRAPP as a key component of a branch of the integrated stress response that impinges on the early secretory pathway. TRAPP associates with and drives the recruitment of the COPII coat to stress granules (SGs) leading to vesiculation of the Golgi complex and an arrest of ER export. -

Novel Loss-Of-Function Variants of TRAPPC2
Won et al. BMC Medical Genetics (2019) 20:70 https://doi.org/10.1186/s12881-019-0802-2 CASEREPORT Open Access Novel loss-of-function variants of TRAPPC2 manifesting X-linked spondyloepiphyseal dysplasia tarda: report of two cases Joon Yeon Won1†, Dayeon Kim1†, Seon Young Park1, Hye Ran Lee2, Jong-Seok Lim1, Jong Hoon Park1, Mi Hyun Song3, Hae Ryong Song3, Ok-Hwa Kim4, Yonghwan Kim1* and Tae-Joon Cho2,5* Abstract Background: X-linked spondyloepiphyseal dysplasia tarda (SEDT-XL) is a skeletal disorder characterized by defective structures of vertebral bodies and/or of epiphyses of the long bones, resulting in moderately short stature and early joint degeneration. TRAPPC2 gene, which is important for collagen secretion, has been reported as causative for SEDT-XL. Case presentation: Here, we report two variants of TRAPPC2 gene of SEDT-XL patients, a missense variant of start codon, c.1A > T, and a deletion variant, c.40delG. To understand molecular consequence of the variants, we establish an in vitro gene expression assay system and demonstrate that both mutated genes are transcribed, but are not properly translated, indicative of the pathogenic nature of those TRAPPC2 variants. Conclusions: In the current study, we provide additional experimental data showing that loss-of-function TRAPPC2 variants are probably causative for SEDT-XL phenotype. These findings further contribute to the understanding the clinical picture related to TRAPPC2 gene. Keywords: X-linked spondyloepiphyseal dysplasia tarda, TRAPPC2, Skeletal dysplasia, Gene expression Background TRAPPC2 in different ethnic groups, it was suggested X-linked spondyloepiphyseal dysplasia tarda (SEDT-XL) that there is no specific population with increased risks is a skeletal dysplasia affecting male subjects, character- for inherited SEDT-XL [7]. -

Downloaded Per Proteome Cohort Via the Web- Site Links of Table 1, Also Providing Information on the Deposited Spectral Datasets
www.nature.com/scientificreports OPEN Assessment of a complete and classifed platelet proteome from genome‑wide transcripts of human platelets and megakaryocytes covering platelet functions Jingnan Huang1,2*, Frauke Swieringa1,2,9, Fiorella A. Solari2,9, Isabella Provenzale1, Luigi Grassi3, Ilaria De Simone1, Constance C. F. M. J. Baaten1,4, Rachel Cavill5, Albert Sickmann2,6,7,9, Mattia Frontini3,8,9 & Johan W. M. Heemskerk1,9* Novel platelet and megakaryocyte transcriptome analysis allows prediction of the full or theoretical proteome of a representative human platelet. Here, we integrated the established platelet proteomes from six cohorts of healthy subjects, encompassing 5.2 k proteins, with two novel genome‑wide transcriptomes (57.8 k mRNAs). For 14.8 k protein‑coding transcripts, we assigned the proteins to 21 UniProt‑based classes, based on their preferential intracellular localization and presumed function. This classifed transcriptome‑proteome profle of platelets revealed: (i) Absence of 37.2 k genome‑ wide transcripts. (ii) High quantitative similarity of platelet and megakaryocyte transcriptomes (R = 0.75) for 14.8 k protein‑coding genes, but not for 3.8 k RNA genes or 1.9 k pseudogenes (R = 0.43–0.54), suggesting redistribution of mRNAs upon platelet shedding from megakaryocytes. (iii) Copy numbers of 3.5 k proteins that were restricted in size by the corresponding transcript levels (iv) Near complete coverage of identifed proteins in the relevant transcriptome (log2fpkm > 0.20) except for plasma‑derived secretory proteins, pointing to adhesion and uptake of such proteins. (v) Underrepresentation in the identifed proteome of nuclear‑related, membrane and signaling proteins, as well proteins with low‑level transcripts. -

Characterization of Three TRAPPC11 Variants Suggests a Critical Role For
www.nature.com/scientificreports OPEN Characterization of three TRAPPC11 variants suggests a critical role for the extreme carboxy Received: 10 April 2019 Accepted: 11 September 2019 terminus of the protein Published: xx xx xxxx Miroslav P. Milev1, Daniela Stanga1, Anne Schänzer2, Andrés Nascimento3,4, Djenann Saint-Dic1, Carlos Ortez3, Daniel Natera-de Benito3, Desiré González Barrios5, Jaume Colomer3, Carmen Badosa3, Cristina Jou4,6, Pia Gallano4,7, Lidia Gonzalez-Quereda4,7, Ana Töpf8, Katherine Johnson8,9, Volker Straub8, Andreas Hahn10, Michael Sacher1,11 & Cecilia Jimenez-Mallebrera3,4 TRAPPC11 was identifed as a component of the TRAPP III complex that functions in membrane trafcking and autophagy. Variants in TRAPPC11 have been reported to be associated with a broad spectrum of phenotypes but all afected individuals display muscular pathology. Identifying additional variants will further our understanding of the clinical spectrum of phenotypes and will reveal regions of the protein critical for its functions. Here we report three individuals from unrelated families that have bi-allellic TRAPPC11 variants. Subject 1 harbors a compound heterozygous variant (c.1287 + 5G > A and c.3379_3380insT). The former variant results in a partial deletion of the foie gras domain (p.Ala372_ Ser429del), while the latter variant results in a frame-shift and extension at the carboxy terminus (p.Asp1127Valfs*47). Subjects 2 and 3 both harbour a homozygous missense variant (c.2938G > A; p.Gly980Arg). Fibroblasts from all three subjects displayed membrane trafcking defects manifested as delayed endoplasmic reticulum (ER)-to-Golgi transport and/or a delay in protein exit from the Golgi. All three individuals also show a defect in glycosylation of an ER-resident glycoprotein. -

Tissue-Specific Disallowance of Housekeeping Genes
Downloaded from genome.cshlp.org on September 29, 2021 - Published by Cold Spring Harbor Laboratory Press Tissue-specific disallowance of housekeeping genes: the other face of cell differentiation Lieven Thorrez1,2,4, Ilaria Laudadio3, Katrijn Van Deun4, Roel Quintens1,4, Nico Hendrickx1,4, Mikaela Granvik1,4, Katleen Lemaire1,4, Anica Schraenen1,4, Leentje Van Lommel1,4, Stefan Lehnert1,4, Cristina Aguayo-Mazzucato5, Rui Cheng-Xue6, Patrick Gilon6, Iven Van Mechelen4, Susan Bonner-Weir5, Frédéric Lemaigre3, and Frans Schuit1,4,$ 1 Gene Expression Unit, Dept. Molecular Cell Biology, Katholieke Universiteit Leuven, 3000 Leuven, Belgium 2 ESAT-SCD, Department of Electrical Engineering, Katholieke Universiteit Leuven, 3000 Leuven, Belgium 3 Université Catholique de Louvain, de Duve Institute, 1200 Brussels, Belgium 4 Center for Computational Systems Biology, Katholieke Universiteit Leuven, 3000 Leuven, Belgium 5 Section of Islet Transplantation and Cell Biology, Joslin Diabetes Center, Harvard University, Boston, MA 02215, US 6 Unité d’Endocrinologie et Métabolisme, University of Louvain Faculty of Medicine, 1200 Brussels, Belgium $ To whom correspondence should be addressed: Frans Schuit O&N1 Herestraat 49 - bus 901 3000 Leuven, Belgium Email: [email protected] Phone: +32 16 347227 , Fax: +32 16 345995 Running title: Disallowed genes Keywords: disallowance, tissue-specific, tissue maturation, gene expression, intersection-union test Abbreviations: UTR UnTranslated Region H3K27me3 Histone H3 trimethylation at lysine 27 H3K4me3 Histone H3 trimethylation at lysine 4 H3K9ac Histone H3 acetylation at lysine 9 BMEL Bipotential Mouse Embryonic Liver Downloaded from genome.cshlp.org on September 29, 2021 - Published by Cold Spring Harbor Laboratory Press Abstract We report on a hitherto poorly characterized class of genes which are expressed in all tissues, except in one. -

Human Genes Escaping X-Inactivation Revealed by Single Cell Expression Data
bioRxiv preprint doi: https://doi.org/10.1101/486084; this version posted December 11, 2018. The copyright holder for this preprint (which was not certified by peer review) is the author/funder, who has granted bioRxiv a license to display the preprint in perpetuity. It is made available under aCC-BY-ND 4.0 International license. _______________________________________________________________________________ Human Genes Escaping X-inactivation Revealed by Single Cell Expression Data Kerem Wainer Katsir and Michal Linial* Department of Biological Chemistry, The Institute of Life Sciences, The Hebrew University of Jerusalem, Jerusalem, Israel * Corresponding author Prof. Michal Linial, Department of Biological Chemistry, Institute of Life Sciences, The Hebrew University of Jerusalem, Edmond J. Safra Campus, Givat Ram, Jerusalem 9190400, ISRAEL Telephone: +972-2-6584884; +972-54-8820035; FAX: 972-2-6523429 KWK: [email protected] ML: [email protected] Running title: Human X-inactivation escapee genes from single cells Tables 1-2 Figures 1-6 Additional files: 7 Keywords: X-inactivation, Allelic bias, RNA-Seq, Escapees, single cell, Allele specific expression. 1 bioRxiv preprint doi: https://doi.org/10.1101/486084; this version posted December 11, 2018. The copyright holder for this preprint (which was not certified by peer review) is the author/funder, who has granted bioRxiv a license to display the preprint in perpetuity. It is made available under aCC-BY-ND 4.0 International license. Abstract Background: In mammals, sex chromosomes pose an inherent imbalance of gene expression between sexes. In each female somatic cell, random inactivation of one of the X-chromosomes restores this balance. -

A Novel RNA-Splicing Mutation in TRAPPC2 Gene Causing X-Linked Spondyloepiphyseal Dysplasia Tarda in a Large Chinese Family
c Indian Academy of Sciences RESEARCH NOTE A novel RNA-splicing mutation in TRAPPC2 gene causing X-linked spondyloepiphyseal dysplasia tarda in a large Chinese family † † ∗ HONG GUO1 , XUEQING XU1 , KAI WANG1, BO ZHANG1, GUOHONG DENG2, YAN WANG1 and YUN BAI1 1Department of Medical Genetics, Third Military Medical University, Gaotanyan St, Chongqing 400038, People’s Republic of China 2Department of Infectious Diseases, Southwest Hospital, Third Military Medical University, Gaotanyan St, Chongqing 400038, People’s Republic of China Introduction have been confirmed to cause SEDT (Gedeon et al. 1999). This gene contains six exons, spanning about 20 kb of ge- X-linked spondyloepiphyseal dysplasia tarda (SEDT; OMIM nomic DNA in Xp22. The coding region is 420 bp in size 313400) is a rare osteochondrodysplasia that occurs in af- and encompassed by exons 3, 4, 5 and 6. The coding region fected individuals between 3 and 12 yr of age. Clinical yields a 140 amino acid protein referred to as TRAPPC2 pro- features include short trunk, barrel-shaped chest and dis- tein (Gecz et al. 2000; Mumm et al. 2001). The function proportionate short stature. Radiological abnormalities may of TRAPPC2 protein is still unclear. Based on the previ- become evident between 10 and 14 yr of age and include ous studies of the yeast homologue, it was postulated that platyspondyly with hump-shaped central and posterior por- TRAPPC2 protein might have a role in the endoplasmic retic- tions of the vertebrae, narrow disc spaces and moderate epi- ulum (ER) to golgi vesicular transport compartments. Forty- physeal dysplasia of the long bones, which may be associated four different mutations of the TRAPPC2 gene in various eth- with osteoarthritis. -

High Expression of the Sd Synthase B4GALNT2 Associates with Good
cells Article High Expression of the Sda Synthase B4GALNT2 Associates with Good Prognosis and Attenuates Stemness in Colon Cancer Michela Pucci y, Inês Gomes Ferreira y, Martina Orlandani, Nadia Malagolini, Manuela Ferracin and Fabio Dall’Olio * Department of Experimental, Diagnostic and Specialty Medicine (DIMES), General Pathology Building, University of Bologna, Via San Giacomo 14, Via San Giacomo 14, 40126 Bologna, Italy; [email protected] (M.P.); [email protected] (I.G.F.); [email protected] (M.O.); [email protected] (N.M.); [email protected] (M.F.) * Correspondence: [email protected]; Tel.: +39-051-2094704 These authors have equal contribution. y Received: 25 February 2020; Accepted: 7 April 2020; Published: 11 April 2020 Abstract: Background: The carbohydrate antigen Sda and its biosynthetic enzyme B4GALNT2 are highly expressed in normal colonic mucosa but are down-regulated to a variable degree in colon cancer tissues. Here, we investigated the clinical and biological importance of B4GALNT2 in colon cancer. Methods: Correlations of B4GALNT2 mRNA with clinical data were obtained from The Cancer Genome Atlas (TCGA) database; the phenotypic and transcriptomic changes induced by B4GALNT2 were studied in LS174T cells transfected with B4GALNT2 cDNA. Results: TCGA data indicate that patients with high B4GALNT2 expression in cancer tissues display longer survival than non-expressers. In LS174T cells, expression of B4GALNT2 did not affect the ability to heal a scratch wound or to form colonies in standard growth conditions but markedly reduced the growth in soft agar, the tridimensional (3D) growth as spheroids, and the number of cancer stem cells, indicating a specific effect of B4GALNT2 on the growth in poor adherence and stemness.