Abies Guatemalensis Rehder)
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

The Role of Fir Species in the Silviculture of British Forests
Kastamonu Üni., Orman Fakültesi Dergisi, 2012, Özel Sayı: 15-26 Kastamonu Univ., Journal of Forestry Faculty, 2012, Special Issue The Role of True Fir Species in the Silviculture of British Forests: past, present and future W.L. MASON Forest Research, Northern Research Station, Roslin, Midlothian, Scotland EH25 9SY, U.K. E.mail:[email protected] Abstract There are no true fir species (Abies spp.) native to the British Isles: the first to be introduced was Abies alba in the 1600s which was planted on some scale until the late 1800s when it proved vulnerable to an insect pest. Thereafter interest switched to North American species, particularly grand (Abies grandis) and noble (Abies procera) firs. Provenance tests were established for A. alba, A. amabilis, A. grandis, and A. procera. Other silver fir species were trialled in forest plots with varying success. Although species such as grand fir have proved highly productive on favourable sites, their initial slow growth on new planting sites and limited tolerance of the moist nutrient-poor soils characteristic of upland Britain restricted their use in the afforestation programmes of the last century. As a consequence, in 2010, there were about 8000 ha of Abies species in Britain, comprising less than one per cent of the forest area. Recent species trials have confirmed that best growth is on mineral soils and that, in open ground conditions, establishment takes longer than for other conifers. However, changes in forest policies increasingly favour the use of Continuous Cover Forestry and the shade tolerant nature of many fir species makes them candidates for use with selection or shelterwood silvicultural systems. -

Climate Change and Coffee Adaptation: Developing Dendroclimatological Records in the Southern Volcanic Chain of Guatemala
Climate Change and Coffee Adaptation: Developing Dendroclimatological Records In the Southern Volcanic Chain of Guatemala. LASG Field Study Awards 2015. Report of fieldwork activities. Diego Pons My main objective was to collect several dendrochronological samples from the southern slope of the volcanic chain in Guatemala in sites above 2,500 m ASL. I worked with increment core samples from Abies guatemalensis Rehder (Guatemalan Fir) in order to reconstruct the climatic signal of precipitation for the region. This species has proven to be sensitive to the late dry season rainfall and negatively correlated with growing season temperature as well as negatively correlated with eastern tropical Pacific SST anomalies. The absence of long-term instrumental records represents a challenge for coffee growers in the region in terms of understanding and adapting to climate changes. Coffee still represents one of the main sources of income to the Guatemalan economy and it has been historically affected by variability of precipitation patterns, leading to several coffee crises in the country. With the chronologies derived from the field trip partially covered with funds from LASG Field Study Award, I intend to improve the overall understanding of the climate variability of the region. Following my stated objectives, I spend about two months is Guatemala for the purpose of collecting dendrochronological samples from the southern slopes of Guatemala’s volcanic chain. I visited the forest known as “Kanchej” located in Cantel, Quetzaltenango (14°46'21.47"N 91°26'35.56"W) at 10,200 ft. Several samples were collected during an intense fieldtrip to these Guatemalan highlands within the Samalá River upper watershed (figure 1). -

A Case Study of the Vulnerable Abies Guatemalensis in Guatemala
Conservation through utilization: a case study of the Vulnerable Abies guatemalensis in Guatemala Uffe Strandby Andersen,JosE´ Pablo Prado CO´ rdova Ulrik BrA¨ uner Nielsen,Carsten Smith Olsen,Charlotte Nielsen Marten SØrensen and Johannes Kollmann Abstract Conservation through utilization is a controversial Introduction strategy that deserves more attention from researchers and practitioners. This case study focuses on Abies guatemalen- ocio-economic research has established that strict con- sis, a Vulnerable Mesoamerican conifer that is illegally used Sservation by suspension of the rights of local commu- for timber, shingles, charcoal and Christmas tree produc- nities to use forests is problematic in developing countries tion. Conservation of the remnant populations would pre- that have extensive and highly dispersed forest resources serve some unique montane forests, with concomitant and limited capacities for enforcement of legislation 1992 1999 benefits for local water supplies and prevention of landslides. (Oakerson, ; Enters & Anderson, ; Steins & 1999 2003 As a conservation tool we suggest establishment of additional Edwards, ; Edmunds & Wollenberg, ). Conserva- A. guatemalensis Christmas tree plantations. These could tion strategies are needed that work with local communities generate income for local farmers and help halt poaching to ensure they benefit from conservation measures. The from natural stands. So far, 51 such plantations have been concept of conservation through utilization applies this 2008 established in Guatemala -

2 ACUERDO Por El Que Se Da a Conocer La Lista De Especies Y Pobl
Miércoles 5 de marzo de 2014 DIARIO OFICIAL (Primera Sección) 2 ACUERDO por el que se da a conocer la lista de especies y poblaciones prioritarias para la conservación. Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.- Secretaría de Medio Ambiente y Recursos Naturales. JUAN JOSÉ GUERRA ABUD, Secretario de Medio Ambiente y Recursos Naturales, con fundamento en los artículos 32 Bis fracciones I y II, de la Ley Orgánica de la Administración Pública Federal; 5o. fracciones I, XI, 79, fracciones I, II, III, de la Ley General del Equilibrio Ecológico y la Protección al Ambiente; 61 y 62, de la Ley General de Vida Silvestre, y 5, fracción XXV, del Reglamento Interior de la SEMARNAT, y CONSIDERANDO Que la SEMARNAT de acuerdo con el Artículo 61 de la Ley General de Vida Silvestre (LGVS), tiene como obligación elaborar y publicar la lista de especies prioritarias para la conservación, con el fin de promover el desarrollo de proyectos para su conservación y recuperación, y con ello la de ecosistemas, hábitat y especies con los que se encuentran asociadas. Dicha lista se debe elaborar conforme a las disposiciones estipuladas en el artículo 61 de la LGVS y observando el procedimiento establecido para tal efecto y se dará a conocer con la opinión previa del Consejo Técnico Consultivo Nacional para la Conservación y Aprovechamiento Sustentable de la Vida Silvestre (CONAVIS) (LGVS Art. 61 y 62). Que es de suma importancia la conservación de especies, toda vez que presenta ventajas complementarias al atender necesidades específicas para aquellas que se encuentran en alguna categoría de riesgo. -
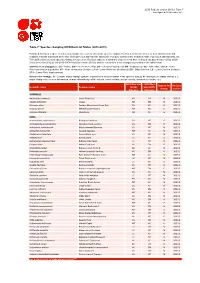
Table 7: Species Changing IUCN Red List Status (2012-2013)
IUCN Red List version 2013.2: Table 7 Last Updated: 25 November 2013 Table 7: Species changing IUCN Red List Status (2012-2013) Published listings of a species' status may change for a variety of reasons (genuine improvement or deterioration in status; new information being available that was not known at the time of the previous assessment; taxonomic changes; corrections to mistakes made in previous assessments, etc. To help Red List users interpret the changes between the Red List updates, a summary of species that have changed category between 2012 (IUCN Red List version 2012.2) and 2013 (IUCN Red List version 2013.2) and the reasons for these changes is provided in the table below. IUCN Red List Categories: EX - Extinct, EW - Extinct in the Wild, CR - Critically Endangered, EN - Endangered, VU - Vulnerable, LR/cd - Lower Risk/conservation dependent, NT - Near Threatened (includes LR/nt - Lower Risk/near threatened), DD - Data Deficient, LC - Least Concern (includes LR/lc - Lower Risk, least concern). Reasons for change: G - Genuine status change (genuine improvement or deterioration in the species' status); N - Non-genuine status change (i.e., status changes due to new information, improved knowledge of the criteria, incorrect data used previously, taxonomic revision, etc.) IUCN Red List IUCN Red Reason for Red List Scientific name Common name (2012) List (2013) change version Category Category MAMMALS Nycticebus javanicus Javan Slow Loris EN CR N 2013.2 Okapia johnstoni Okapi NT EN N 2013.2 Pteropus niger Greater Mascarene Flying -

CITES and Timber (PDF)
This guide covers the main timber species regulated CITES and Timber by the Convention on International Trade in Endangered Species (CITES). It provides information CITES and Timber on the key issues regarding the implementation of the Convention for this important group of plants. A guide to CITES-listed tree species Written for the non-expert, individual sections cover the species found in significant trade, with details on their distribution, uses, traded parts and derivatives, and scientific and common names. Madeleine Groves Madeleine Groves Additional sections cover timber identification and measurement, guidance on CITES documentation and key resources. and Catherine Rutherford shop.kew.org/kewbooksonline Madeleine Groves Catherine Rutherford CITES and Timber A guide to CITES-listed tree species Madeleine Groves Catherine Rutherford © The Board of Trustees of the Royal Botanic Gardens, Kew 2015 Illustrations and photographs © Royal Botanic Gardens, Kew, unless otherwise stated in the captions The authors have asserted their rights to be identified as the authors of this work in accordance with the Copyright, Designs and Patents Act 1988 All rights reserved. No part of this publication may be reproduced, stored in a retrieval system, or transmitted, in any form, or by any means, electronic, mechanical, photocopying, recording or otherwise, without written permission of the publisher unless in accordance with the provisions of the Copyright Designs and Patents Act 1988. Great care has been taken to maintain the accuracy of the information contained in this work. However, neither the publisher, the editors nor authors can be held responsible for any consequences arising from use of the information contained herein. -

Exploring Historical Coffee and Climate Relations in Southern Guatemala: an Integration of Tree Ring Analysis and Remote Sensing Data
University of Denver Digital Commons @ DU Electronic Theses and Dissertations Graduate Studies 1-1-2017 Exploring Historical Coffee and Climate Relations in Southern Guatemala: An Integration of Tree Ring Analysis and Remote Sensing Data Diego Pons University of Denver Follow this and additional works at: https://digitalcommons.du.edu/etd Part of the Forest Sciences Commons, and the Plant Sciences Commons Recommended Citation Pons, Diego, "Exploring Historical Coffee and Climate Relations in Southern Guatemala: An Integration of Tree Ring Analysis and Remote Sensing Data" (2017). Electronic Theses and Dissertations. 1356. https://digitalcommons.du.edu/etd/1356 This Dissertation is brought to you for free and open access by the Graduate Studies at Digital Commons @ DU. It has been accepted for inclusion in Electronic Theses and Dissertations by an authorized administrator of Digital Commons @ DU. For more information, please contact [email protected],[email protected]. EXPLORING HISTORICAL COFFEE AND CLIMATE RELATIONS IN SOUTHERN GUATEMALA: AN INTEGRATION OF TREE RING ANALYSIS AND REMOTE SENSING DATA __________ A Dissertation Presented to the Faculty of Natural Sciences and Mathematics University of Denver __________ In Partial Fulfillment of the Requirements for the Degree Doctor of Philosophy __________ By Diego Pons August 2017 Advisor: Matthew Taylor © Copyright by Diego Pons 2017 All Rights Reserved Author: Diego Pons Title: EXPLORING HISTORICAL COFFEE AND CLIMATE RELATIONS IN SOUTHERN GUATEMALA: AN INTEGRATION OF TREE RING ANALYSIS AND REMOTE SENSING DATA Advisor: Matthew Taylor Degree Date: August 2017 ABSTRACT This dissertation makes use of a physical geography perspective to examine the relationship between agriculture and climate in Guatemala using dendrochronology. -

Linkages Between an Endangered Endemic Fir (Abies Guatemalensis Rehder) and Peasant Economies in the Guatemalan Western Highlands1
José Pablo Prado Córdova Conservation by cultivation: Linkages between an endangered endemic fir (Abies guatemalensis Rehder) and peasant economies in the Guatemalan 1 Western Highlands Introduction As one of the components of the project “Sustainable greenery production – an innovative tool for improving rural livelihood and rescuing endemic conifers in Central America”, this proposal aims at exploring to what extent an endangered endemic fir (Abies guatemalensis Rehder) plays a role within local peasant economies and can be properly preserved and harvested by means of taking the first steps for the implementation of a conservation-by- cultivation strategy. Such a concern stems from the need to provide local markets in Guatemala with sustainably produced Christmas trees, and eventually greenery pieces, of good quality. By doing so, the conservation status of the species might be significantly improved as arguably rural villages can benefit directly from its use. Research questions - What’s the role of A. guatemalensis within the local peasant economies in its natural distribution area? - Can those collective schemes be functional for communal plantations management as well? - Would new forestry activities, such as Christmas trees plantations´ establishment, further or tackle existing patterns of collective action? Hypotheses - Small farming systems in the study sites have incorporated both direct and indirect benefits from the use of A. guatemalensis. However, market driven policies such as the increasing demand for greenery and Christmas trees have pushed this species into the verge of extinction. Livelihoods assets in this context can only be enhanced sustainably by strengthening local capacities for land stewardship and local enforcement of adequate rules and regulations, and by adjusting national legislation to local realities. -

Wood Anatomy of the Genus Abies Luis García Esteban*, Paloma
IAWA Journal, Vol. 30 (3), 2009: 231–245 WOOD ANATOMY OF THE GENUS ABIES A REVIEW Luis García Esteban*, Paloma de Palacios, Francisco García Fernández and Ruth Moreno Universidad Politécnica de Madrid. Escuela Técnica Superior de Ingenieros de Montes, Departamento de Ingeniería Forestal, Ciudad Universitaria, 28040 Madrid, Spain *Corresponding author [E-mail: [email protected]] SUMMARY The literature on the wood anatomy of the genus Abies is reviewed and discussed, and complemented with a detailed study of 33 species, 1 sub- species and 4 varieties. In general, the species studied do not show diag- nostic interspecific differences, although it is possible to establish differences between groups of species using certain quantitative and quali- tative features. The marginal axial parenchyma consisting of single cells and the ray parenchyma cells with distinctly pitted horizontal walls, nodular end walls and presence of indentures are constant for the genus, although these features also occur in the other genera of the Abietoideae. The absence of ray tracheids in Abies can be used to distinguish it from Cedrus and Tsuga, and the irregularly shaped parenchymatous marginal ray cells are only shared with Cedrus. The absence of resin canals enables Abies to be distinguished from very closely related genera such as Keteleeria and Nothotsuga. The crystals in the ray cells, taxodioid cross-field pitting and the warty layer in the tracheids can be regarded as diagnostic generic features. Key words: Abies, Abietoideae, anatomy, wood. INTRODUCTION The family Pinaceae, with 11 genera and 225 species, is the largest conifer family. The genus Abies, with 48 species and 24 varieties, has the second highest number of species after the genus Pinus (Farjon 2001). -

Nearctic Avian Migrants in Coffee Plantations and Forest Fragments of South-Western Guatemala
Bird Conservation International (1994) 4:209-232 Nearctic avian migrants in coffee plantations and forest fragments of south-western Guatemala JAY P. VANNINI Summary Habitats at intermediate and upper elevations of the volcanic Cordillera of south- western Guatemala harbour a diverse terrestrial vertebrate fauna that includes at least 423 avian species, 108 of which are known to be Nearctic migrants, and 43 of which are known or suspected to have both resident and long-distance migrant populations. During the course of floral and faunal inventories in a proposed Multiple Use Area in this region from 1987 through 1991, FIIT researchers collected or observed 254 avian species, of which 44 are regarded as Nearctic migrants and 26 are known or suspected to have both resident and long-distance migrant populations. Study sites included climax and selectively logged lower montane forest fragments, as well as subtropical agroecosystems. Data are presented to support the conclusion that a significantly higher percent- age of resident avian species reported from this region in the literature continue to occupy these habitats than do species known to undertake cyclical long- distance migrations. Non-quantitative, historical reports of relative abundance of all Nearctic avian migrants in the region during the early and mid-twentieth century are compared with current status of these species. Threats to Nearctic avian migrants in the western Guatemalan highlands are discussed, and areas of future research for ornithologists working with this community in the region are proposed. Recommendations are made to preserve or improve habitats on wintering grounds and along migration routes considered to be of critical importance for the long-term survival of a number of threatened and vulnerable Nearctic avian migrants in Guatemala. -
Pinabete (Abies Guatemalensis Rehder)
Instituto Nacional de Bosques Ministerio de Ambiente y Recursos Naturales Pinabete Abies guatemalensis Rehder PAQUETE TECNOLÓGICO FORESTAL INFORME FINAL Abies guatemalensis Rehder Fotografías por: Herbario Bigu. 2015. 18 de junio de 2016. http://www.bigu.260mb.com/Galeria/abiesguatemalensispinaceae.html?ckattempt=1; Bisbe, J. 2015 Arkive. 18 de junio de 2016. http://www.arkive.org/guatemalan-fir/abies-guatemalensis/image- G70913.html; Cifuentes, G 2014. 18 de junio de 2016. https://www.flickr.com/photos/gtk1x/15911761917/; Miron, I. 2010. 18 de junio de 2016. https://www.flickr.com/photos/10589073@N05/5249566975/; Bayton, R. 2014. 18de junio de 2016. https://www.flickr.com/photos/109538648@N06/15393402118/; Tobar, F. 2009. 18 de junio de 2016. http://www.conifers.org/pi/Abies_guatemalensis.php 2017 i Instituto Nacional de Bosques -INAB- 7ª Avenida 12-90, zona 13 Guatemala, Guatemala, C.A. www.inab.gob.gt Dirección de Desarrollo Forestal www.inab.gob.gt Tel: 2321-4600 y 2321-4601 Guatemala, Guatemala, C.A. Departamento de Investigación Forestal 7ª Avenida. 12-90, zona 13 Guatemala, Guatemala, C.A. www.inab.gob.gt Ministerio de Ambiente y Recursos Naturales 20 Calle 28-58, zona 10 Guatemala, Guatemala, C.A. www.marn.gob.gt Proyecto: “Sistema de información sobre la productividad de los bosques de Guatemala” Elaborado por: Edwin Enrique Cano Morales Se autoriza la reproducción total o parcial de esta publicación para fines educativos o sin intenciones de lucro, sin ningún otro permiso especial por parte del titular de los derechos, con la condición de que se cite la fuente de donde proviene. -
Abies Guatemalensis Rehder
A Abies guatemalensis Rehder ANA LUCRECIA E. DE MACVEAN Herbario, Instituto de Investigaciones Universidad del Valle de Guatemala PINACEAE (PINE FAMILY) Abies tacanensis Lundell, A. guatemalensis var. tacanensis (Lundell) Martínez Abeto de Guatemala, Guatemalan fir, pacachaque, parchac, pashaque fir (Asociación Becaria Guatemalteca 1995), pinabete (Williams 1981), romerillo (Asociación Becaria Guatemalteca 1995) Abies guatemalensis is native to the highlands of Mexico, buds of the previous season and are borne on the undersides Guatemala, the Santa Barbara Mountains in Honduras, and of the lower crown branches in the axils of the leaves. Ovulate has also been reported by A. Molina (Escuela Panamericana El cones are erect and composed of many bracts, each subtending Zamorano) from El Salvador (Williams 1981). This species has a large scale with two inverted basal ovules (Harlow and Har- the southernmost range for its genus (Donahue and others rar 1969). All species of Abies are monoecious (Dallimore and 1985). It grows in wet, high forests in the Guatemalan Jackson 1974). The erect cones are subsessile, cylindrical, and provinces of Quiché, Chichicastenango, Totonicapán, Sololá, up to 12 cm long and 5 cm wide. The bracts are cuneate obo- Huehuetenango, Quetzaltenango, San Marcos, Jalapa; and in vate, shorter than the cone scales, and concealed by them. The the Mexican states of Chiapas, Oaxaca, and Guerrero (Aso- scales are broader than they are long, with external puberulous ciación Becaria Guatemalteca 1995) associated primarily with margins (Dallimore and Jackson 1974). The seeds are light Pinus ayacahuite C. Ehrenb. ex Schltdl., P. rudis Endl., and brown, up to 8 or 10 mm long; the wings are 15 mm long and Cupressus lusitanica (Perry 1991).