70-84, 2014. Issn
Total Page:16
File Type:pdf, Size:1020Kb

Load more
Recommended publications
-

Impacts of Climate Change on Marine Fisheries and Aquaculture in Chile
See discussions, stats, and author profiles for this publication at: https://www.researchgate.net/publication/319999645 Impacts of Climate Change on Marine Fisheries and Aquaculture in Chile Chapter · September 2017 DOI: 10.1002/9781119154051.ch10 CITATIONS READS 0 332 28 authors, including: Nelson A Lagos Ricardo Norambuena University Santo Tomás (Chile) University of Concepción 65 PUBLICATIONS 1,052 CITATIONS 13 PUBLICATIONS 252 CITATIONS SEE PROFILE SEE PROFILE Claudio Silva Marco A Lardies Pontificia Universidad Católica de Valparaíso Universidad Adolfo Ibáñez 54 PUBLICATIONS 432 CITATIONS 70 PUBLICATIONS 1,581 CITATIONS SEE PROFILE SEE PROFILE Some of the authors of this publication are also working on these related projects: Irish moss - green crab interactions View project Influence of environment on fish stock assessment View project All content following this page was uploaded by Pedro A. Quijón on 11 November 2017. The user has requested enhancement of the downloaded file. 239 10 Impacts of Climate Change on Marine Fisheries and Aquaculture in Chile Eleuterio Yáñez1, Nelson A. Lagos2,13, Ricardo Norambuena3, Claudio Silva1, Jaime Letelier4, Karl-Peter Muck5, Gustavo San Martin6, Samanta Benítez2,13, Bernardo R. Broitman7,13, Heraldo Contreras8, Cristian Duarte9,13, Stefan Gelcich10,13, Fabio A. Labra2, Marco A. Lardies11,13, Patricio H. Manríquez7, Pedro A. Quijón12, Laura Ramajo2,11, Exequiel González1, Renato Molina14, Allan Gómez1, Luis Soto15, Aldo Montecino16, María Ángela Barbieri17, Francisco Plaza18, Felipe Sánchez18, -

Márcia Alexandra the Course of TBT Pollution in Miranda Souto the World During the Last Decade
Márcia Alexandra The course of TBT pollution in Miranda Souto the world during the last decade Evolução da poluição por TBT no mundo durante a última década DECLARAÇÃO Declaro que este relatório é integralmente da minha autoria, estando devidamente referenciadas as fontes e obras consultadas, bem como identificadas de modo claro as citações dessas obras. Não contém, por isso, qualquer tipo de plágio quer de textos publicados, qualquer que seja o meio dessa publicação, incluindo meios eletrónicos, quer de trabalhos académicos. Márcia Alexandra The course of TBT pollution in Miranda Souto the world during the last decade Evolução da poluição por TBT no mundo durante a última década Dissertação apresentada à Universidade de Aveiro para cumprimento dos requisitos necessários à obtenção do grau de Mestre em Toxicologia e Ecotoxicologia, realizada sob orientação científica do Doutor Carlos Miguez Barroso, Professor Auxiliar do Departamento de Biologia da Universidade de Aveiro. O júri Presidente Professor Doutor Amadeu Mortágua Velho da Maia Soares Professor Catedrático do Departamento de Biologia da Universidade de Aveiro Arguente Doutora Ana Catarina Almeida Sousa Estagiária de Pós-Doutoramento da Universidade da Beira Interior Orientador Carlos Miguel Miguez Barroso Professor Auxiliar do Departamento de Biologia da Universidade de Aveiro Agradecimentos A Deus, pela força e persistência que me deu durante a realização desta tese. Ao apoio e a força dados pela minha família para a realização desta tese. Á Doutora Susana Galante-Oliveira, por toda a aprendizagem científica, paciência e pelo apoio que me deu nos momentos mais difíceis ao longo deste percurso. Ao Sr. Prof. Doutor Carlos Miguel Miguez Barroso pela sua orientação científica. -

The Effect of Light Intensity and Tidal Cycle on the Hatching and Larval Behaviour of the Muricid Gastropod Chorus Giganteus
Journal of Experimental Marine Biology and Ecology 440 (2013) 69–73 Contents lists available at SciVerse ScienceDirect Journal of Experimental Marine Biology and Ecology journal homepage: www.elsevier.com/locate/jembe The effect of light intensity and tidal cycle on the hatching and larval behaviour of the muricid gastropod Chorus giganteus José A. Gallardo a,⁎, Antonio Brante b, Juan Miguel Cancino b a Pontificia Universidad Católica de Valparaíso, Avenida Altamirano 1480, Valparaíso, Chile b Departamento de Ecología, Facultad de Ciencias, Universidad Católica de la Santísima Concepción, Casilla 297, Concepción, Chile article info abstract Article history: Encapsulation is a common strategy observed among marine caenogastropods. Although the capsule confers Received 20 August 2012 protection for embryos, its rigidity and strength pose a significant challenge as the larvae hatch. The factors Received in revised form 19 November 2012 that drive hatching among these benthic marine gastropods have scarcely been studied. In this study, we exper- Accepted 22 November 2012 imentally evaluated whether the capsule plug opening and larval release processes were synchronised with day/ Available online xxxx night or tidal cycles in the muricid gastropod Chorus giganteus. In addition, we tested the effect of different levels of light intensity on the swimming behaviour of pre- and post-hatching larvae. The results showed that capsule Keywords: Chorus giganteus plug rupture occurred in synchronous pulses of capsule groups during both day and night. A periodogram anal- Day/night cycle ysis did not show circatidal rhythmicity in either the plug rupture or total number of capsules hatched. The Hatching highest percentage of larvae hatched at sunset and during the night (82.9%), whereas only 17% of them hatched Intracapsular development during the day. -

Are the Traditional Medical Uses of Muricidae Molluscs Substantiated by Their Pharmacological Properties and Bioactive Compounds?
Mar. Drugs 2015, 13, 5237-5275; doi:10.3390/md13085237 OPEN ACCESS marine drugs ISSN 1660-3397 www.mdpi.com/journal/marinedrugs Review Are the Traditional Medical Uses of Muricidae Molluscs Substantiated by Their Pharmacological Properties and Bioactive Compounds? Kirsten Benkendorff 1,*, David Rudd 2, Bijayalakshmi Devi Nongmaithem 1, Lei Liu 3, Fiona Young 4,5, Vicki Edwards 4,5, Cathy Avila 6 and Catherine A. Abbott 2,5 1 Marine Ecology Research Centre, School of Environment, Science and Engineering, Southern Cross University, G.P.O. Box 157, Lismore, NSW 2480, Australia; E-Mail: [email protected] 2 School of Biological Sciences, Flinders University, G.P.O. Box 2100, Adelaide 5001, Australia; E-Mails: [email protected] (D.R.); [email protected] (C.A.A.) 3 Southern Cross Plant Science, Southern Cross University, G.P.O. Box 157, Lismore, NSW 2480, Australia; E-Mail: [email protected] 4 Medical Biotechnology, Flinders University, G.P.O. Box 2100, Adelaide 5001, Australia; E-Mails: [email protected] (F.Y.); [email protected] (V.E.) 5 Flinders Centre for Innovation in Cancer, Flinders University, G.P.O. Box 2100, Adelaide 5001, Australia 6 School of Health Science, Southern Cross University, G.P.O. Box 157, Lismore, NSW 2480, Australia; E-Mail: [email protected] * Author to whom correspondence should be addressed; E-Mail: [email protected]; Tel.: +61-2-8201-3577. Academic Editor: Peer B. Jacobson Received: 2 July 2015 / Accepted: 7 August 2015 / Published: 18 August 2015 Abstract: Marine molluscs from the family Muricidae hold great potential for development as a source of therapeutically useful compounds. -
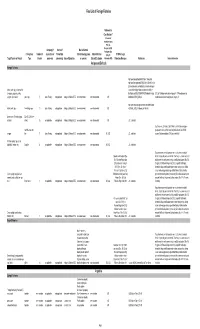
2018 Final LOFF W/ Ref and Detailed Info
Final List of Foreign Fisheries Rationale for Classification ** (Presence of mortality or injury (P/A), Co- Occurrence (C/O), Company (if Source of Marine Mammal Analogous Gear Fishery/Gear Number of aquaculture or Product (for Interactions (by group Marine Mammal (A/G), No RFMO or Legal Target Species or Product Type Vessels processor) processing) Area of Operation or species) Bycatch Estimates Information (N/I)) Protection Measures References Detailed Information Antigua and Barbuda Exempt Fisheries http://www.fao.org/fi/oldsite/FCP/en/ATG/body.htm http://www.fao.org/docrep/006/y5402e/y5402e06.htm,ht tp://www.tradeboss.com/default.cgi/action/viewcompan lobster, rock, spiny, demersal fish ies/searchterm/spiny+lobster/searchtermcondition/1/ , (snappers, groupers, grunts, ftp://ftp.fao.org/fi/DOCUMENT/IPOAS/national/Antigua U.S. LoF Caribbean spiny lobster trap/ pot >197 None documented, surgeonfish), flounder pots, traps 74 Lewis Fishing not applicable Antigua & Barbuda EEZ none documented none documented A/G AndBarbuda/NPOA_IUU.pdf Caribbean mixed species trap/pot are category III http://www.nmfs.noaa.gov/pr/interactions/fisheries/tabl lobster, rock, spiny free diving, loops 19 Lewis Fishing not applicable Antigua & Barbuda EEZ none documented none documented A/G e2/Atlantic_GOM_Caribbean_shellfish.html Queen conch (Strombus gigas), Dive (SCUBA & free molluscs diving) 25 not applicable not applicable Antigua & Barbuda EEZ none documented none documented A/G U.S. trade data Southeastern U.S. Atlantic, Gulf of Mexico, and Caribbean snapper- handline, hook and grouper and other reef fish bottom longline/hook-and-line/ >5,000 snapper line 71 Lewis Fishing not applicable Antigua & Barbuda EEZ none documented none documented N/I, A/G U.S. -

Genetic Structure and Diversity of Squids with Contrasting Life Histories in the Humboldt Current System Estructura Y Diversidad
Genetic diversity of squids Hidrobiológica 204, 24 (): 1-0 Genetic structure and diversity of squids with contrasting life histories in the Humboldt Current System Estructura y diversidad genética de calamares con historias de vida contrastantes en el Sistema de Corrientes de Humboldt Christian Marcelo Ibáñez and Elie Poulin Instituto de Ecología y Biodiversidad, Departamento de Ciencias Ecológicas, Facultad de Ciencias, Universidad de Chile. Las Palmeras # 3425, Ñuñoa. Chile e-mail: [email protected] Ibáñez C. M and Elie Poulin. 204. Genetic structure and diversity of squids with contrasting life histories in the Humboldt Current System. Hidrobiológica 24 (): -0. ABSTRACT Dosidiscus gigas and Doryteuthis gahi are the most abundant squids in the Humboldt Current System (HCS). These species have contrasting life histories. To determine the genetic structure and diversity of these species, we collected samples from different places in the HCS and amplified a fragment of the mitochondrial cytochrome C oxidase I gene. The molecular analysis of D. gigas revealed low genetic diversity, absence of population structure and evidence for a demographic expansion during the transition from the last glacial period to the current interglacial. These results sug- gest that D. gigas is composed of one large population with high levels of gene flow throughout the HCS. In the case of D. gahi, the sequences indicated the presence of two population units in the HCS, one in south-central Chile and one in Peru. The Chilean unit had greater genetic diversity, suggesting that it is an old, relatively stable population. In the Peruvian unit there was less genetic diversity and evidence of a recent demographic expansion. -

Redalyc.Effects of Temperature on Development and Survival Of
Revista de Biología Marina y Oceanografía ISSN: 0717-3326 [email protected] Universidad de Valparaíso Chile Gallardo, José A; Cancino, Juan M Effects of temperature on development and survival of embryos and on larval production of Chorus giganteus (Lesson, 1829) (Gastropoda: Muricidae) Revista de Biología Marina y Oceanografía, vol. 44, núm. 3, diciembre, 2009, pp. 595-602 Universidad de Valparaíso Viña del Mar, Chile Available in: http://www.redalyc.org/articulo.oa?id=47914663007 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Revista de Biología Marina y Oceanografía 44(3): 595-602, diciembre de 2009 Effects of temperature on development and survival of embryos and on larval production of Chorus giganteus (Lesson, 1829) (Gastropoda: Muricidae) Efectos de la temperatura en el desarrollo y la supervivencia de embriones y en la producción larval de Chorus giganteus (Lesson, 1829) (Gastropoda: Muricidae) José A. Gallardo1 and Juan M. Cancino2 1Laboratorio de genética Aplicada, Escuela de Ciencias del Mar, Pontificia Universidad Católica de Valparaíso. Avda. Altamirano 1480, Valparaíso, Chile 2Departamento de Ecología Costera, Facultad de Ciencias, Universidad Católica de la Santísima Concepción. Casilla 297, Concepción, Chile [email protected] Resumen.- Chorus giganteus muestra un rápido desarrollo Abstract.- Chorus giganteus shows faster intracapsular intracapsular en alta temperatura, pero esto tiene como embryonic development at high temperature but this is generally consecuencia una alta mortalidad embrionaria y una baja associated with a high embryonic mortality and low larval producción larval. -

Offspring Size, Provisionin a Function of Maternal in Developing Fspring Size
Offspring size, provisioning and performance as a function of maternal investment in direct developing whelks By Sergio Antonio Carrasco Órdenes A thesis submitted to Victoria University of Wellington in fulfilment of the requirements for the degree of Doctor of Philosophy in Marine Biology Victoria University of Wellington Te Whare Wānanga o te Ūpoko o te Ika a Māui 2012 This thesis was conducted under the supervision of: Dr. Nicole E. Phillips (Primary Supervisor) Victoria University of Wellington Wellington, New Zealand and Dr. Mary A. Sewell (Secondary Supervisor) The University of Auckland Auckland, New Zealand Abstract Initial maternal provisioning has pervasive ecological and evolutionary implications for species with direct development, influencing offspring size and energetic content, with subsequent effects on performance, and consequences in fitness for both offspring and mother. Here, using three sympatric marine intertidal direct developing gastropods as model organisms (Cominella virgata, Cominella maculosa and Haustrum scobina) I examined how contrasting strategies of maternal investment influenced development, hatchling size, maternal provisioning and juvenile performance. In these sympatric whelks, duration of intra-capsular development was similar among species (i.e. 10 wk until hatching); nonetheless, differences in provisioning and allocation were observed. Cominella virgata (1 embryo per capsule; ~3 mm shell length [SL]) and C. maculosa (7.7 ± 0.3 embryos per capsule; ~1.5 mm SL) provided their embryos with a jelly-like albumen matrix and all embryos developed. Haustrum scobina encapsulated on average 235 ± 17 embryos per capsule but only ~10 reached the hatching stage (~1.2 mm SL), with the remaining siblings being consumed as nurse embryos, mainly during the first 4 wk of development. -

Imposex En Crassilabrum Crassilabrum (Neogastropoda: Muricidae) En La Costa Central Del Perú
Rev Inv Vet Perú 2017; 28(4): 834-842 http://dx.doi.org/10.15381/rivep.v28i4.13873 Imposex en Crassilabrum crassilabrum (Neogastropoda: Muricidae) en la Costa Central del Perú IMPOSEX IN CRASSILABRUM CRASSILABRUM (NEOGASTROPODA: MURICIDAE) IN THE PERUVIAN CENTRAL COAST Rolf Rivas1, Renzo Pradel1, Soledad Hurtado1, Dayanne Cornelio1, Jorge Mendoza1, Angélica Guabloche1, José Iannacone2,3, Lorena Alvariño1, Luz Castañeda1 RESUMEN El imposex es un fenómeno que consiste en el desarrollo de caracteres sexuales masculinos sobre el sistema reproductivo de las hembras de caracoles gasterópodos por la contaminación por compuestos organoestañosos (OTs), como el tributil estaño (TBT). En el presente trabajo se evaluó el imposex en Crassilabrum crassilabrum Sowerby, 1834 (Neogastropoda: Muricidae) proveniente de la costa central del Perú, para lo cual se analizaron individuos colectados de la zona intermareal de Pucusana y Ancón, Lima. Se tomaron medidas biométricas y se calcularon los índices de imposex. El porcentaje de imposex en Ancón fue del 98% y en Pucusana de 100%. El índice de la longitud relativa del pene (RPLI) fue de 52.3% y 44.5% para Pucusana y Ancón, respectivamente. Una relación significativa fue encontrada entre la longitud de la conchilla y la longitud del pene en machos en ambas playas, pero no así en las hembras. Crassilabrum crassilabrum es un molusco con aplicación para emplearse como un bioindicador de componentes OTs en la costa central del Perú y en el Pacífico sudamericano. Palabras clave: Crassilabrum crassilabrum; imposex; organoestañosos; Pacífico Sur; Perú; caracol ABSTRACT The imposex is a phenomenon that consists in the development of masculine sexual characteristics on the reproductive system of the gastropod female snails by organotin compounds (OTs), like tributyl tin (TBT). -

Universidad Nacional De San Agustín De Arequipa
UNIVERSIDAD NACIONAL DE SAN AGUSTÍN DE AREQUIPA FACULTAD DE CIENCIAS BIOLÓGICAS ESCUELA PROFESIONAL Y ACADÉMICA DE BIOLOGÍA “ESTIMACIÓN DE LOS ÍNDICES DE CAPTURA POR UNIDAD DE ESFUERZO DE LA PESQUERÍA ARTESANAL DE MARISCOS EN EL PUERTO DE MATARANI. PERIODO ENERO 2012 – DICIEMBRE 2015” Tesis presentada por el bachiller: ERIC FRANCISCO GOMEZ RODRIGUEZ Para optar el Título Profesional de BIÓLOGO AREQUIPA – PERÚ 2016 ASESOR Dr. Pastor Coayla Peñaloza JURADO PRESIDENTE Dr. Graciano Del Carpio Tejada SECRETARIO Blgo. Armando Arenazas Rodriguez INTEGRANTE Dr. Pastor Coayla Peñaloza AGRADECIMIENTO El presente trabajo de investigación es un esfuerzo en el cual, directa o indirectamente, participaron varias personas leyendo, corrigiendo, teniéndome paciencia, dándome ánimo, acompañando en los momentos de crisis y en los momentos de felicidad. Agradezco al Dr. Pastor Coayla Peñaloza, por la paciencia y por la dirección de este trabajo, por el análisis crítico en todo el proceso de elaboración y sus atinadas correcciones. Debo expresar mi más sincero reconocimiento a los docentes catedráticos de la Universidad Nacional de san Agustín y en especial a los catedráticos del laboratorio de Biología Celular y Biología Marina por su colaboración y apoyo. Por permitirme entrar a sus vidas todos estos años de convivencia dentro y fuera de la institución. DEDICATORIA A mi padre Arturo por su comprensión y ayuda, por ser uno de los artífices en la culminación de mis estudios Superiores quien con sus consejos me dio impulso para salir adelante. A mis hermanos Arturo y Zeyla a quienes les debo muchas cosas, quienes han vivido de cerca los distintos procesos de mi vida tanto en los momentos felices y tristes. -

Guía Ilustrada Para El Reconocimiento De Especies De Poliplacóforos
GUÍA ILUSTRADA PARA EL RECONOCIMIENTO DE ESPECIES DE POLIPLACÓFOROS, GASTERÓPODOS Y CEFALÓPODOS CON VALOR COMERCIAL EN EL PERÚ DOCUMENTO ELABORADO CON EL FINANCIAMIENTO DEL PROGRAMA PRESUPUESTAL 0095: “FORTALECIMIENTO DE LA PESCA ARTESANAL” DEL MINISTERIO DE LA PRODUCCIÓN (PRODUCE). Instituto del Mar del Perú (Imarpe) Esquina Gamarra y General Valle s/n, Callao, Perú Teléfono: (511) 208-8650, fax (511) 429-9811 Correo electrónico: [email protected] www.imarpe.gob.pe Autores: Patricia Carbajal, José Santamaría y Danny Baldarrago Área Funcional de Investigación en Biodiversidad (AFIB) Dirección General de Investigaciones de Recursos Demersales y Litorales (DGIRDL) Revisión científica: Violeta Valdivieso Área Funcional del Centro de Documentación (AFCD) Edición, diseño y diagramación: Patricia Carbajal y José Santamaría Área Funcional de Investigación en Biodiversidad (AFIB) Imágenes de portada: - Octopus mimus “pulpo”, Isla Lobos de Tierra, Lambayeque. Fotografía: Patricia Carbajal (superior). - Thaisella chocolata “caracol negro”, Isla San Lorenzo, Callao. Fotografía: Alex Gamarra (inferior). Imágenes de página introductoria: -Fissurella latimarginata “lapa negra”, Isla San Lorenzo, Callao. Fotografía: Alex Gamarra (superior). -Fissurella crassa “lapa”, Fissurella limbata “lapa” y Enoplochiton niger “barquillo”, Ilo, Moquegua. Fotografía: Danny Baldarrago (inferior). Este documento debe ser citado como: Carbajal-Enzian P., Santamaría J., y Danny Baldárrago. 2018. Guía ilustrada para el reconocimiento de poliplacóforos, gasterópodos y cefalópodos con valor comercial en el Perú. Lima, Instituto del Mar del Perú (Imarpe). Hecho el Depósito Legal en la Biblioteca Nacional del Perú N° 2018-20550. Tiraje: 300 ejemplares Impreso en: Gráfica Gianlud Print E.I.R.L. - Jr. Chancay 380, Lima. Cel.: 932107910 El Imarpe se reserva todos los derechos de reproducción, publicación total o parcial, los de traducción y del sitio web. -

Gayana 73(1): 17-27, 2009 ISSN 0717-652X
Gayana 73(1): 17-27, 2009 ISSN 0717-652X MOLECULAR ANALYSIS IN CHILEAN COMMERCIAL GASTROPODS BASED ON 16S rRNA, COI AND ITS1-5.8S rDNA-ITS2 SEQUENCES ANALISIS MOLECULAR EN GASTROPODOS CHILENOS COMERCIALES BASADOS EN LAS SECUENCIAS 16S rRNA,. COI Y ITS1-5.8S rDNA-ITS2 Felipe Aguilera-Muñoz, Fabiola Lafarga-Cruz & Cristian Gallardo-Escárate* Laboratorio de Biotecnología Acuícola, Departamento de Oceanografía, Facultad de Ciencias Naturales y Oceanográficas, Centro de Biotecnología, Universidad de Concepción. Barrio Universitario s/n. Casilla 160-C Concepción, Chile. email: [email protected] ABSTRACT Gastropod mollusks are part of the principal marine resources cultivated and commercialized in Chile. There are native Chilean species such as loco (Concholepas concholepas), locate (Thais chocolata), trumulco snail (Chorus giganteus), keyhole limpets (Fissurella spp.), tegula snail (Tegula atra) as well as exotic species such as red abalone (Haliotis rufescens) and Japanese abalone (Haliotis discus hannai). Despite their importance as marine resources, molecular genetic studies establishing phylogenetic relationships and estimating population genetic parameters are scarce. The aim of this study is to establish a molecular approach among the main commercial gastropod species in Chile. The mitochondrial genes 16S rRNA and COI, and the nuclear ribosomal region ITS1-5.8SrDNA-ITS2 were amplified by PCR and sequencing. Alignment analysis was used to determine systematic relationships at the specific level for the species studied. The results revealed that 7 species are grouped in 4 genetically distinct families (Haliotidae, Trochidae, Muricidae and Fissurellidae). In comparison with COI sequencing, 16S rRNA and ITS1-5.8SrDNA-ITS2 sequencing were relatively more conserved with a divergence percentage for 16S rDNA and ITS1-5.8SrDNA-ITS2 of 1.2% and 1.8%, respectively, contrasting with the value of 10% obtained for COI in abalone.