Известия Тинро Удк 597.556.35–116(265.2) Ю.П. Дьяков
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Bristol Bay, Alaska
EPA 910-R-14-001C | January 2014 An Assessment of Potential Mining Impacts on Salmon Ecosystems of Bristol Bay, Alaska Volume 3 – Appendices E-J Region 10, Seattle, WA www.epa.gov/bristolbay EPA 910-R-14-001C January 2014 AN ASSESSMENT OF POTENTIAL MINING IMPACTS ON SALMON ECOSYSTEMS OF BRISTOL BAY, ALASKA VOLUME 3—APPENDICES E-J U.S. Environmental Protection Agency Region 10 Seattle, WA CONTENTS VOLUME 1 An Assessment of Potential Mining Impacts on Salmon Ecosystems of Bristol Bay, Alaska VOLUME 2 APPENDIX A: Fishery Resources of the Bristol Bay Region APPENDIX B: Non-Salmon Freshwater Fishes of the Nushagak and Kvichak River Drainages APPENDIX C: Wildlife Resources of the Nushagak and Kvichak River Watersheds, Alaska APPENDIX D: Traditional Ecological Knowledge and Characterization of the Indigenous Cultures of the Nushagak and Kvichak Watersheds, Alaska VOLUME 3 APPENDIX E: Bristol Bay Wild Salmon Ecosystem: Baseline Levels of Economic Activity and Values APPENDIX F: Biological Characterization: Bristol Bay Marine Estuarine Processes, Fish, and Marine Mammal Assemblages APPENDIX G: Foreseeable Environmental Impact of Potential Road and Pipeline Development on Water Quality and Freshwater Fishery Resources of Bristol Bay, Alaska APPENDIX H: Geologic and Environmental Characteristics of Porphyry Copper Deposits with Emphasis on Potential Future Development in the Bristol Bay Watershed, Alaska APPENDIX I: Conventional Water Quality Mitigation Practices for Mine Design, Construction, Operation, and Closure APPENDIX J: Compensatory Mitigation and Large-Scale Hardrock Mining in the Bristol Bay Watershed AN ASSESSMENT OF POTENTIAL MINING IMPACTS ON SALMON ECOSYSTEMS OF BRISTOL BAY, ALASKA VOLUME 3—APPENDICES E-J Appendix E: Bristol Bay Wild Salmon Ecosystem: Baseline Levels of Economic Activity and Values Bristol Bay Wild Salmon Ecosystem Baseline Levels of Economic Activity and Values John Duffield Chris Neher David Patterson Bioeconomics, Inc. -

Fishery Management Plan for Groundfish of the Bering Sea and Aleutian Islands Management Area APPENDICES
FMP for Groundfish of the BSAI Management Area Fishery Management Plan for Groundfish of the Bering Sea and Aleutian Islands Management Area APPENDICES Appendix A History of the Fishery Management Plan ...................................................................... A-1 A.1 Amendments to the FMP ......................................................................................................... A-1 Appendix B Geographical Coordinates of Areas Described in the Fishery Management Plan ..... B-1 B.1 Management Area, Subareas, and Districts ............................................................................. B-1 B.2 Closed Areas ............................................................................................................................ B-2 B.3 PSC Limitation Zones ........................................................................................................... B-18 Appendix C Summary of the American Fisheries Act and Subtitle II ............................................. C-1 C.1 Summary of the American Fisheries Act (AFA) Management Measures ............................... C-1 C.2 Summary of Amendments to AFA in the Coast Guard Authorization Act of 2010 ................ C-2 C.3 American Fisheries Act: Subtitle II Bering Sea Pollock Fishery ............................................ C-4 Appendix D Life History Features and Habitat Requirements of Fishery Management Plan SpeciesD-1 D.1 Walleye pollock (Theragra calcogramma) ............................................................................ -

Collapse and Recovery of Marine Fishes
letters to nature sulphide complexes, indicating that Cu sulphide clusters are more 7. Al-Farawati, R. & van den Berg, C. M. G. Metal-sulfide complexation in seawater. Mar. Chem. 63, 331–352 (1999). stable than Cu organic complexes. This explains why laboratory 8. Luther III, G. W., Rickard, D. T., Theberge, S. M. & Olroyd, A. Determination of metal (bi)sulfide cultures of oceanic phytoplankton have been observed to increase stability constants of Mn2+,Fe2+,Co2+,Ni2+,Cu2+, and Zn2+ by voltammetric methods. Environ. Sci. the production of total dissolved sulphides when the concentrations Technol. 30, 671–679 (1996). of free Cu and Zn in the culture media were increased22. Although 9. Helz, G. R, Charnock, J. M., Vaughan, D. J. & Garner, C. D. Multinuclearity of aqueous copper and zinc bisulfide complexes—an EXAFS investigation. Geochim. Cosmochim. Acta 57, the data that we report here suggest that metal sulphide formation is 15–25 (1993). a means of detoxifying trace metals for organisms, further toxico- 10. Luther III, G. W., Theberge, S. M. & Rickard, D. T. Evidence for aqueous clusters as intermediates logical studies are needed to quantify the roles both sulphides and during zinc sulfide formation. Geochim. Cosmochim. Acta 19/20, 3159–3169 (1999). ‘natural’ organic ligands play in controlling Cu toxicity in natural 11. Peters, J. W., Lanzilotta, W. N., Lemon, B. J. & Seefeldt, L. C. X-ray crystal structure of the Fe-only hydrogenase (Cpl) from Clostridium pasteurianum to 1.8 angstrom resolution. Science 282, 1853– waters. 1858 (1998). Sulphur complexation may have a dramatic effect on the acute 12. -

Identification of Larvae of Three Arctic Species of Limanda (Family Pleuronectidae)
Identification of larvae of three arctic species of Limanda (Family Pleuronectidae) Morgan S. Busby, Deborah M. Blood & Ann C. Matarese Polar Biology ISSN 0722-4060 Polar Biol DOI 10.1007/s00300-017-2153-9 1 23 Your article is protected by copyright and all rights are held exclusively by 2017. This e- offprint is for personal use only and shall not be self-archived in electronic repositories. If you wish to self-archive your article, please use the accepted manuscript version for posting on your own website. You may further deposit the accepted manuscript version in any repository, provided it is only made publicly available 12 months after official publication or later and provided acknowledgement is given to the original source of publication and a link is inserted to the published article on Springer's website. The link must be accompanied by the following text: "The final publication is available at link.springer.com”. 1 23 Author's personal copy Polar Biol DOI 10.1007/s00300-017-2153-9 ORIGINAL PAPER Identification of larvae of three arctic species of Limanda (Family Pleuronectidae) 1 1 1 Morgan S. Busby • Deborah M. Blood • Ann C. Matarese Received: 28 September 2016 / Revised: 26 June 2017 / Accepted: 27 June 2017 Ó Springer-Verlag GmbH Germany 2017 Abstract Identification of fish larvae in Arctic marine for L. proboscidea in comparison to the other two species waters is problematic as descriptions of early-life-history provide additional evidence suggesting the genus Limanda stages exist for few species. Our goal in this study is to may be paraphyletic, as has been proposed in other studies. -

Половое Созревание Дальневосточных Камбалообразных Рыб (Pleuronectiformes) Ю.П
ИССЛЕДОВАНИЯ ВОДНЫХ БИОЛОГИЧЕСКИХ РЕСУРСОВ КАМЧАТКИ И СЕВЕРО-ЗАПАДНОЙ ЧАСТИ ТИХОГО ОКЕАНА, 2015, вып. 39 УДК 597.587.9-116 (265.51) DOI 10.15853/2072-8212.2015.39.5-69 ПОЛОВОЕ СОЗРЕВАНИЕ ДАЛЬНЕВОСТОЧНЫХ КАМБАЛООБРАЗНЫХ РЫБ (PLEURONECTIFORMES) Ю.П. Дьяков Гл. н. с., д-р биол. наук, Камчатский научно-исследовательский институт рыбного хозяйства и океанографии 683000 Петропавловск-Камчатский, Набережная, 18 Тел.: (4152) 42-19-87. E-mail: [email protected] КАМБАЛЫ, ДАЛЬНЕВОСТОЧНЫЕ МОРЯ, ПОЛОВОЕ СОЗРЕВАНИЕ, СКОРОСТЬ СОЗРЕВАНИЯ, ГЕОГРАФИЧЕСКАЯ ИЗМЕНЧИВОСТЬ В статье дана характеристика полового созревания около 40 видов камбалообразных рыб, обитающих в морях северной части Тихого океана. Приведены значения длины тела и возраста созревающих рыб. Выполнен сравнительный анализ особенностей созревания разных камбал. Выявлены географические тенденции в половом созревании широко распространенных видов этой группы рыб. Исследована связь географической изменчивости созревания с зоогеографической характеристикой и биотопом. MATURATION OF FAR EASTERN FLOUNDERS (PLEURONECTIFORMES) Yu.P. Diakov Leading scientist, Dr. of Science (Biology), Kamchatka Research Institute of Fisheries and Oceanography 683000 Petropavlovsk-Kamchatsky, Naberedzhnaya, 18 Tel.: (4152) 42-19-87. E-mail: [email protected] FLOUNDERS, FAR EASTERN SEAS, MATURATION PROCESS, MATURATION RATE, GEOGRAPHICAL VARIABILITY The article provides characterization of the process of maturation for almost 40 flounder species, inhabiting the seas of the North Pacific. Body length and age at maturation are demonstrated. Comparative analysis to reveal specifics of maturation by flounder species is made. Geographical trends of maturation are revealed for majority of widespread flounder species in the analyzed group. Dependences between geographical variability of maturation, zoogeographical characteristics and biotops are studied. Половое созревание является важнейшим этапом камбал, в зависимости от размеров и возраста осо- онтогенеза рыб. -

A List of Common and Scientific Names of Fishes from the United States And
t a AMERICAN FISHERIES SOCIETY QL 614 .A43 V.2 .A 4-3 AMERICAN FISHERIES SOCIETY Special Publication No. 2 A List of Common and Scientific Names of Fishes -^ ru from the United States m CD and Canada (SECOND EDITION) A/^Ssrf>* '-^\ —---^ Report of the Committee on Names of Fishes, Presented at the Ei^ty-ninth Annual Meeting, Clearwater, Florida, September 16-18, 1959 Reeve M. Bailey, Chairman Ernest A. Lachner, C. C. Lindsey, C. Richard Robins Phil M. Roedel, W. B. Scott, Loren P. Woods Ann Arbor, Michigan • 1960 Copies of this publication may be purchased for $1.00 each (paper cover) or $2.00 (cloth cover). Orders, accompanied by remittance payable to the American Fisheries Society, should be addressed to E. A. Seaman, Secretary-Treasurer, American Fisheries Society, Box 483, McLean, Virginia. Copyright 1960 American Fisheries Society Printed by Waverly Press, Inc. Baltimore, Maryland lutroduction This second list of the names of fishes of The shore fishes from Greenland, eastern the United States and Canada is not sim- Canada and the United States, and the ply a reprinting with corrections, but con- northern Gulf of Mexico to the mouth of stitutes a major revision and enlargement. the Rio Grande are included, but those The earlier list, published in 1948 as Special from Iceland, Bermuda, the Bahamas, Cuba Publication No. 1 of the American Fisheries and the other West Indian islands, and Society, has been widely used and has Mexico are excluded unless they occur also contributed substantially toward its goal of in the region covered. In the Pacific, the achieving uniformity and avoiding confusion area treated includes that part of the conti- in nomenclature. -

Pictorial Guide to the Gill Arches of Gadids and Pleuronectids in The
Alaska Fisheries Science Center National Marine Fisheries Service U.S. DEPARTMENT OF COMMERCE AFSC PROCESSED REPORT 91.15 Pictorial Guide to the G¡ll Arches of Gadids and Pleuronectids in the Eastern Bering Sea May 1991 This report does not const¡Ute a publicalion and is for lnformation only. All data herein are to be considered provisional. ERRATA NOTICE This document is being made available in .PDF format for the convenience of users; however, the accuracy and correctness of the document can only be certified as was presented in the original hard copy format. Inaccuracies in the OCR scanning process may influence text searches of the .PDF file. Light or faded ink in the original document may also affect the quality of the scanned document. Pictorial Guide to the ciII Arches of Gadids and Pleuronectids in the Eastern Beri-ng Sea Mei-Sun Yang Alaska Fisheries Science Center National Marine Fisheries Se:nrice, NoAÀ 7600 Sand Point Way NE, BIN C15700 Seattle, lÍA 98115-0070 May 1991 11I ABSTRÀCT The strrrctures of the gill arches of three gadids and ten pleuronectids were studied. The purPose of this study is, by using the picture of the gill arches and the pattern of the gi[- rakers, to help the identification of the gadids and pleuronectids found Ín the stomachs of marine fishes in the eastern Bering Sea. INTRODUCTION One purjose of the Fish Food Habits Prograrn of the Resource Ecology and FisherY Managenent Division (REF
Stock Status Table
National Marine Fisheries Service - 2020 Status of U.S. Fisheries Table A. Summary of Stock Status for FSSI Stocks Overfishing? Overfished? (Is Fishing Management Rebuilding (Is Biomass Approaching Jurisdiction FMP Stock Mortality Action Program B/B Points below Overfished MSY above Required Progress Threshold?) Threshold?) Consolidated Atlantic Highly Atlantic sharpnose shark - Atlantic HMS No No No NA NA 2.08 4 Migratory Species Atlantic Consolidated Atlantic Highly Atlantic sharpnose shark - Atlantic HMS No No No NA NA 1.02 4 Migratory Species Gulf of Mexico Reduce Consolidated Atlantic Highly Mortality, Year 8 of 30- Atlantic HMS Blacknose shark - Atlantic Yes Yes NA 0.43-0.64 1 Migratory Species Continue year plan Rebuilding Consolidated Atlantic Highly not Atlantic HMS Blacktip shark - Atlantic Unknown Unknown Unknown NA NA 0 Migratory Species estimated Consolidated Atlantic Highly Blacktip shark - Gulf of Atlantic HMS No No No NA NA 2.62 4 Migratory Species Mexico Consolidated Atlantic Highly Finetooth shark - Atlantic Atlantic HMS No No No NA NA 1.30 4 Migratory Species and Gulf of Mexico Consolidated Atlantic Highly Great hammerhead - Atlantic not Atlantic HMS Unknown Unknown Unknown NA NA 0 Migratory Species and Gulf of Mexico estimated Consolidated Atlantic Highly Lemon shark - Atlantic and not Atlantic HMS Unknown Unknown Unknown NA NA 0 Migratory Species Gulf of Mexico estimated Consolidated Atlantic Highly Sandbar shark - Atlantic and Continue Year 16 of 66- Atlantic HMS No Yes NA 0.77 2 Migratory Species Gulf of Mexico -

Estimating Confidence in Trawl Efficiency and Catch Quantification for the Eastern Bering Sea Shelf Survey
NOAA Technical Memorandum NMFS-AFSC-335 doi:10.7289/V5/TM-AFSC-335 Estimating Confidence in Trawl Efficiency and Catch Quantification for the Eastern Bering Sea Shelf Survey D. E. Stevenson, K. L. Weinberg, and R. R. Lauth U.S. DEPARTMENT OF COMMERCE National Oceanic and Atmospheric Administration National Marine Fisheries Service Alaska Fisheries Science Center November 2016 NOAA Technical Memorandum NMFS The National Marine Fisheries Service's Alaska Fisheries Science Center uses the NOAA Technical Memorandum series to issue informal scientific and technical publications when complete formal review and editorial processing are not appropriate or feasible. Documents within this series reflect sound professional work and may be referenced in the formal scientific and technical literature. The NMFS-AFSC Technical Memorandum series of the Alaska Fisheries Science Center continues the NMFS-F/NWC series established in 1970 by the Northwest Fisheries Center. The NMFS-NWFSC series is currently used by the Northwest Fisheries Science Center. This document should be cited as follows: Stevenson, D. E., K. L. Weinberg, and R. R. Lauth. 2016. Estimating confidence in trawl efficiency and catch quantification for the eastern Bering Sea shelf survey. U.S. Dep. Commer., NOAA Tech. Memo. NMFS-AFSC-335, 51 p. doi:10.7289/V5/TM-AFSC-335. Document available: http://www.afsc.noaa.gov/Publications/AFSC-TM/NOAA-TM-AFSC-335.pdf Reference in this document to trade names does not imply endorsement by the National Marine Fisheries Service, NOAA. NOAA Technical Memorandum NMFS-AFSC-335 doi:10.7289/V5/TM-AFSC-335 Estimating Confidence in Trawl Efficiency and Catch Quantification for the Eastern Bering Sea Shelf Survey D. -
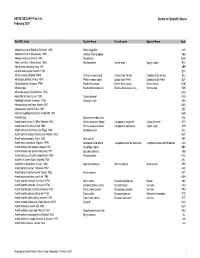
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste -

F Latfishes Families Bothidae, Cvnoalossidae, and F'leuronectidae
NORTHEAST PAC IF IC F latfishes Families Bothidae, Cvnoalossidae, and F'leuronectidae Ponald E, Kramer a i@i!liam H. Bares Brian C. F'aust + Barry E. Bracken illustrated by Terry Josey Alaska 5ea Grant Col/egeProgram Universityor Alaska Fa>rbanks P.O.Pox 755040 Fairbanks,Aiaska 99775-5040 907! 474-6707 ~ Fax 907! 47a 5285 Alaska Rshenes0eveioprnent Foundation 508 West seoono'Avenue, suite 212 Anonorage.Alaska 99501-2208 Marine Advisory Bulletin No. 47 a 1995 a $20.00 ElmerE. RasmusonLibrary Cataloging-in-Publication Data Guide to northeast Pacific flatfishes: families Bothidae, Cynoglossidae, and Pleuronectidae/by Donald E. Kramer ... Iet al,l Marine advisory bulletin; no. 47! 1. Flatfishes Identification. 2. Flattishes North Pacific Ocean. 3. Bothidae. 4. Cynoglossidae.5, Pleuronectidae. I. Kramer,Donald E. II. AlaskaSea Grant College Program. III. AlaskaFisheries Development Foundation. IV, Series. QL637.9.PSG85 1995 ISBN 1-5 !t2-032-2 Credits Thisbook is the resultof work sponsoredby the Universityof AlaskaSea GrantCollege Program, which is cooperativelysupported by the U.S,Depart- mentof Commerce,NOAA Office of SeaGrant and ExtramuralPrograms, undergrant no. NA4f! RG0104, projects A/7 I -01and A/75-01, and by the Universityof Alaskawith statefunds. The Universityof Alaskais an affirma- tive action/equal opportunity employer and educational institution. SeaGrant is a unique partnership with public and private sectors com- bining research,education, and technologytransfer for public service,This national network of universities meets -

61661147.Pdf
Resource Inventory of Marine and Estuarine Fishes of the West Coast and Alaska: A Checklist of North Pacific and Arctic Ocean Species from Baja California to the Alaska–Yukon Border OCS Study MMS 2005-030 and USGS/NBII 2005-001 Project Cooperation This research addressed an information need identified Milton S. Love by the USGS Western Fisheries Research Center and the Marine Science Institute University of California, Santa Barbara to the Department University of California of the Interior’s Minerals Management Service, Pacific Santa Barbara, CA 93106 OCS Region, Camarillo, California. The resource inventory [email protected] information was further supported by the USGS’s National www.id.ucsb.edu/lovelab Biological Information Infrastructure as part of its ongoing aquatic GAP project in Puget Sound, Washington. Catherine W. Mecklenburg T. Anthony Mecklenburg Report Availability Pt. Stephens Research Available for viewing and in PDF at: P. O. Box 210307 http://wfrc.usgs.gov Auke Bay, AK 99821 http://far.nbii.gov [email protected] http://www.id.ucsb.edu/lovelab Lyman K. Thorsteinson Printed copies available from: Western Fisheries Research Center Milton Love U. S. Geological Survey Marine Science Institute 6505 NE 65th St. University of California, Santa Barbara Seattle, WA 98115 Santa Barbara, CA 93106 [email protected] (805) 893-2935 June 2005 Lyman Thorsteinson Western Fisheries Research Center Much of the research was performed under a coopera- U. S. Geological Survey tive agreement between the USGS’s Western Fisheries