Diversidade De Aranhas Em Ecossistemas De Manguezal E De
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Spring/Summer 2016 Program Independent Curators
INDEPENDENT CURATORS INTERNATIONAL SPRING/SUMMER 2016 PROGRAM I C IC I I C IC I I C I C I I C I C I I C I C I EXHIBITIONS PUBLIC PROGRAMS & RESEARCH NETWORK & ACCESS 4 The Ocean After Nature 18 Curatorial Intensive 30 Publications 6 Apichatpong Weerasethakul 22 Alumni Updates 32 Limited Editions 8 Salon de Fleurus 24 Research Fellowships 34 Annual Beneft 10 EN MAS’ 26 Curator’s Perspective 36 Support ICI 12 Free Play 28 Curatorial Hub 13 Harald Szeemann 39 Thank You 14 do it 40 Access ICI 16 Performance Now 17 Project 35: Volume 2 Yonatan Cohen & Raf Segal, detail of Territorial Map of the World, 2013. Courtesy of the artists. INDEPENDENT CURATORS INTERNATIONAL 1 WELCOME Today more than ever—with a region. In addition, ICI will provide a three-part Curatorial growing network of collaborators Mentorship program in collaboration with ArtPrize to take spanning 64 countries—Independent place in Grand Rapids, Michigan, to enhance the learning Curators International (ICI) opens experience of curators and institutions participating in up a multiplicity of perspectives that the ArtPrize Fellowship for Emerging Curators program. are fundamental in understanding And lastly, ICI has teamed up with the Liverpool Biennial contemporary art, through exhibitions, and Cactus Gallery on a major new initiative to provide publications, events, curatorial curatorial guidance and support to artists based in the training and research initiatives. North of England to develop their careers internationally over a three-year period. Like the tens of thousands who visit an ICI exhibition each year, you may know ICI as an access point to Each of these collaborations uniquely refects how ICI’s international developments in contemporary art through network impacts local and regional art scenes within an your local museum. -

Australasian Arachnology 83.Pdf
Australasian Arachnology 83 Page 1 Australasian Arachnology 83 Page 2 THE AUSTRALASIAN ARTICLES ARACHNOLOGICAL SOCIETY The newsletter Australasian Arachnology depends on the contributions of members. www.australasian-arachnology.org Please send articles to the Editor: Acari – Araneae – Amblypygi – Opiliones – Palpigradi – Pseudoscorpiones – Pycnogonida – Michael G. Rix Schizomida – Scorpiones – Uropygi Department of Terrestrial Zoology Western Australian Museum The aim of the society is to promote interest in Locked Bag 49, Welshpool DC, W.A. 6986 the ecology, behaviour and taxonomy of Email: [email protected] arachnids of the Australasian region. Articles should be typed and saved as a MEMBERSHIP Microsoft Word document, with text in Times New Roman 12-point font. Only electronic Membership is open to all who have an interest email (preferred) or posted CD-ROM submiss- in arachnids – amateurs, students and ions will be accepted. professionals – and is managed by our Administrator (note new address ): Previous issues of the newsletter are available at http://www.australasian- Volker W. Framenau arachnology.org/newsletter/issues . Phoenix Environmental Sciences P.O. Box 857 LIBRARY Balcatta, W.A. 6914 Email: [email protected] For those members who do not have access to a scientific library, the society has a large number Membership fees in Australian dollars (per 4 of reference books, scientific journals and paper issues): reprints available, either for loan or as photo- *discount personal institutional copies. For all enquiries concerning publica- Australia $8 $10 $12 tions please contact our Librarian: NZ/Asia $10 $12 $14 Elsewhere $12 $14 $16 Jean-Claude Herremans There is no agency discount. -

Whoswho 2018.Pdf
Hindi version of the Publication is also available सत㔯मेव ज㔯ते PARLIAMENT OF INDIA RAJYA SABHA WHO’S WHO 2018 (Corrected upto November 2018) सं द, र ी㔯 स ाज㔯 त सभ ार ा भ P A A H R B LI A AM S EN JYA T OF INDIA, RA RAJYA SABHA SECRETARIAT NEW DELHI © RAJYA SABHA SECRETARIAT, NEW DELHI http://parliamentofindia.nic.in http://rajyasabha.nic.in E-mail: [email protected] EDITORIAL TEAM Shri D. S. Prasanna Kumar Director Smt. Vandana Singh Additional Director Smt. Asha Singh Joint Director Shri Md. Salim Ali Assistant Research Officer Shri Mohammad Saleem Assistant Research Officer PUBLISHED BY THE SECRETARY-GENERAL, RAJYA SABHA AND PRINTED BY DRV GrafIx Print, 41, Shikshak BHAwAN, INSTITUTIonal AREA, D-BLoCK JANAKPURI, NEw DELHI-110058 PREFACE TO THE THIRTY-FOURTH EDITION Rajya Sabha Secretariat has the pleasure of publishing the updated thirty- fourth edition of ‘Rajya Sabha who’s who’. Subsequent to the retirement of Members and biennial elections and bye- elections held in 2017 and 2018, information regarding bio-data of Members have been updated. The bio-data of the Members have been prepared on the basis of information received from them and edited to keep them within three pages as per the direction of the Hon’ble Chairman, Rajya Sabha, which was published in Bulletin Part-II dated May 28, 2009. The complete bio-data of all the Members are also available on the Internet at http://parliamentofindia.nic.in and http://rajyasabha.nic.in. NEW DELHI; DESH DEEPAK VERMA, December, 2018 Secretary-General, Rajya Sabha CONTENTS PAGES 1. -

(CBCS) & for MA HISTORY
Restructuring of Syllabus according to Choice Based Credit System (CBCS) & Scheme of Instruction and Examination for M.A. HISTORY (Regular) w.e.f. 2017-2018 DEPARTMENT OF HISTORY KAKATIYA UNIVERSITY WARANGAL, TELANGANA 1 M.A. (HISTORY) - SEMESTER – I CHOICE BASED CREDIT SYSTEM (CBCS) PAPER-I - PRE-HISTORIC CULTURE IN DECCAN Unit-I: Survey of Pre-historical Studies in India - The Deccan - Its Ecological Setting - Meaning and Scope of the terms Paleolithic - Neolithic - Chalcolithic and Megalithic. Unit-II: Economy and Technology of the Paleolithic and Mesolithic Cultures of Deccan - Settlement Patterns of Lower – Middle and Upper Paleolithic Cultures of Deccan - Chronology and Settlement Patterns of Mesolithic Culture. Unit-III: Economy and Technology of the Neolithic Deccan - Typology of the Neolithic Industries - Settlement Patterns of the Neolithic - Neolithic Cultures of Brahmagiri – Sangankallu – Tekkalkota – Utnoor – Maski – Piklihal - Nagarjunakonda and North-Eastern Andhra. Unit-IV: Relationship between the Neolithic and the Chalcolithic Culture of the Study Region - Chalcolithic Culture of Havasa – Jorve - Daimabad and Inangaon. Unit-V: The Megalithic of the Deccan - Their Cultural Ecology - Economy and Technology - The Authors of the Megalithic Monuments – Problems of Iron Age in the Deccan REFERENCE BOOKS: 1. Sundara . A: Early Chamber Tombs of South India, Delhi University Publisher. 2. Deo S.B. and Paddayya, K: Recent Advances in Indian Archaeology, Deccan College, Poona, 1985 3. Dhavalikar H. K: Settlement Archaeology of Inengeon 4. Dhavalikar H. K: Puratattva, 8, 44-54, Challcolithic Cultures o Socio-Economic Perspectives, Puratattva – 13-14: 59-80 5. Allchin, B and F.G: The Rise of Civilization in India and Pakistan, 1983 6. -

Universidade Federal De Minas Gerais Instituto De Ciências Biológicas Philip Russo Da Silva Padrões Biogeográficos E Estrutu
UNIVERSIDADE FEDERAL DE MINAS GERAIS INSTITUTO DE CIÊNCIAS BIOLÓGICAS PHILIP RUSSO DA SILVA PADRÕES BIOGEOGRÁFICOS E ESTRUTURAÇÃO DO CONHECIMENTO TAXONÔMICO DAS ARANHAS ARANEOIDEAS AMERICANAS Belo Horizonte 2019 Philip Russo da Silva PADRÕES BIOGEOGRÁFICOS E ESTRUTURAÇÃO DO CONHECIMENTO TAXONÔMICO DAS ARANHAS ARANEOIDEAS AMERICANAS Dissertação apresentada à Pós-Graduação em Zoologia do Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais, como requisito parcial à obtenção do titulo de Mestre em Zoologia. Área de concentração: Zoologia Orientador: Prof. Dr. Adalberto José dos Santos Coorientador: Dr. Ubirajara de Oliveira Belo Horizonte 2019 Agradecimentos A finalização desse trabalho só foi possível graças àqueles que contribuíram para minha formação acadêmica e suporte psicológico, a todos esses agradeço o tempo e ajuda. Agradeço aos professores e colegas de turma pelos aprendizados ao longo desses sete longos anos de carreira acadêmica e por me mostrarem as oportunidades que a biologia tem a oferecer. Agradeço especialmente ao Adal por aceitar me orientar, mesmo que eu tenha “entrado” no laboratório por difusão, em algum momento minhas visitas ficaram tão frequentes que minha presença se tornou usual e me tornei um membro da aracnologia e estávamos discutindo sobre possíveis trabalhos. Também agradeço pela paciência, compreensão e incentivo em executar um projeto que só tende a crescer, mesmo não tendo o foco sistemático da zoologia. Ao Bira, agradeço a oportunidade de me coorientar e, antes disso, de me apresentar essa disciplina fantástica que é a biogeografia e mostrar que ela não precisa ser o método de um trabalho, mas uma área totalmente diferente. A todos os colegas de laboratório fica um agradecimento especial, obrigado por deixarem o ambiente de trabalho algo tão descontraído e confortável, mesmo que em vários momentos meu humor não estivesse tão bom. -

Enlisting the Diversity of Orb-Weavers of Asia As Well As Endemic Orb-Weaving Species of India
© 2016. Indian Journal of Arachnology 5 (1-2): 176-304 ISSN 2278-1587 (Online) ENLISTING THE DIVERSITY OF ORB-WEAVERS OF ASIA AS WELL AS ENDEMIC ORB-WEAVING SPECIES OF INDIA Anuradha Rajoria* and Harishant Jadhao** *Department of Zoology, Sant Gadge Baba Amravati University, Maharashtra [email protected], ** [email protected] ABSTRACT The present enlisting of the orb-weavers of Asia is done in order to understand the generic as well as species abundance of the orb-weaving families which are recorded from Asian continent till date. This enlisting also highlights the species of the orb-weaving families which are endemic to India. This is a simple, sorted compilation of the diversity of Asian Orb-weavers. Keywords: Asia, India, Araneae, endemic, orb-weavers, spider fauna. INTRODUCTION “Orb-Weavers” as we know, are the most common group of builders of spiral wheel- shaped webs often found in gardens, fields and forests. Their common name is taken from the round shape of this typical web, and the taxon was formerly also referred to as the Orbiculariae and are basically categorized under the Superfamilies Araneoidea, Cyatholipoidea, Deinopoidea, Linyphioidea, Symphytognathoidea and Theridioidea. A total of 20 families are categorised within these superfamilies, while Asian continent records 15 families viz., Anapidae Simon, 1895; Araneidae Clerck, 1757; Deinopidae C.L. Koch, 1850; Linyphiidae Blackwall, 1859; Mimetidae Simon, 1881; Mysmenidae Petrunkevitch, 1928; Nephilidae Simon, 1894; Nesticidae Simon, 1894; Pimoidae Wunderlich, 1986; Symphytognathidae Hickman, 1931; Synaphridae Wunderlich, 1986; Tetragnathidae Menge, 1866; Theridiidae Sundevall, 1833; Theridiosomatidae Simon, 1881 and Uloboridae Thorell, 1869. MATERIALS AND METHODS The present work is based on the review of the orb-weaving families which are included in Platnick’s World Spider Catalog and recently uploaded online version of World Spider Catalog (2016) and also by consulting published books, materials and available literature. -

SHORT COMMUNICATION New Records of the Spider Fauna from Sarawak, Malaysia
Jurnal Biologi Indonesia 12(2): 307-312 (2016) SHORT CO0081,&$7,21 New Records of the Spider Fauna from Sarawak, Malaysia (Catatan Baru Fauna Laba-Laba dari Sarawak, Malaysia) Dzulhelmi Muhammad 1asir*1, Wong Chun Xing2, Nur-Syahirah Mamat3, Yong Min Pui4, & Badiozaman Sulaiman5 1Institute of Biological Sciences, Faculty of Science, Universiti Malaya, 50603 Kuala Lumpur, MALAYS,A 2School of Social Sciences, Faculty of Humanities, Arts and Heritage, Universiti Malaysia Sabah, Jalan UMS, 88400 Kota Kinabalu, Sabah, MALAYSIA 3School of Environmental and Natural Resource Sciences, Faculty of Science and Technology, Universiti .HEangsaan 0alaysia, 43600 Bangi, Selangor, MALAYS,A 4Institute of Biodiversity and Environmental Conservation, Universiti Malaysia Sarawak, 94300 Kota Samarahan, Sarawak, MALAYS,A 5Department of Zoology, Faculty of Resource Science and Technology, Universiti Malaysia Sarawak, 94300 .Rta Samarahan, Sarawak, MALAYS,A *E-mail: [email protected] Received: 1ovember 2015, Accepted: December 2015 Spiders are one of the most diverse orders cies including 46 newly recorded species for Sara- worldwide and ranN seventh in total species diversity waN (.oh et al. 2013). However, other species such among all other group of organisms (Cardoso 0o- as Gasteracantha arcuata, G. hasselti and 3hryna- rano 2010). They are highly adaptaEle, widespread in rachne ceylonica which had also Eeen recorded almost all terrestrial ecosystems, and constitute one of (Grinang 2004) were not listed. Recently, several the most important components of gloEal Eiodiversity newly descriEed species such as -erzego corticicola (0cDonald 2007; Archana 2011). These predators (0addison 3iasciN 2014), Heteropoda parva are good indicators for environmental changes in the (-ager 2014), Aposphragisma Erunomanseri, A. con- ecosystems, potential Eiological invasion, Eiological fluens, A. -
Semester-I Semester-Ii
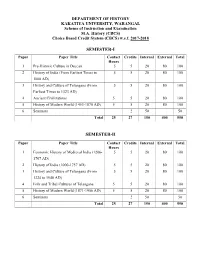
DEPARTMENT OF HISTORY KAKATIYA UNIVERSITY, WARANGAL Scheme of Instruction and Examination M.A. History (CBCS) Choice Based Credit System (CBCS) w.e.f. 2017-2018 SEMESTER-I Paper Paper Title Contact Credits Internal External Total Hours 1 Pre-Historic Culture in Deccan 5 5 20 80 100 2 History of India (From Earliest Times to 5 5 20 80 100 1000 AD) 3 History and Culture of Telangana (From 5 5 20 80 100 Earliest Times to 1323 AD) 4 Ancient Civilizations 5 5 20 80 100 5 History of Modern World (1453-1870 AD) 5 5 20 80 100 6 Seminars 2 50 50 Total 25 27 150 400 550 SEMESTER-II Paper Paper Title Contact Credits Internal External Total Hours 1 Economic History of Medieval India (1206- 5 5 20 80 100 1707 AD) 2 History of India (1000-1757 AD) 5 5 20 80 100 3 History and Culture of Telangana (From 5 5 20 80 100 1324 to 1948 AD) 4 Folk and Tribal Cultures of Telangana 5 5 20 80 100 5 History of Modern World (1871-1956 AD) 5 5 20 80 100 6 Seminars 2 50 50 Total 25 27 150 400 550 SEMESTER-III Paper Paper Title Contact Credits Internal External Total Hours 1 Economic History of Modern India (1757- 5 5 20 80 100 1964 AD) 2 History of Modern India (1757-1950 AD) 5 5 20 80 100 3 History and Culture of Modern Telangana 5 5 20 80 100 (From 1948 to 2014 AD) Elective Papers 4 (A) Principles of Archaeology 5 5 20 80 100 (B) History of Science and Technology in Medieval India (1500-1857 AD) (C) History of Science and Technology in Modern India (1857-1974 AD) 5 (A) History and Culture of the Kakatiyas 5 5 20 80 100 (B) Working Class Movements in Modern India -
ARACHNOLOGY Newsletter of the Australasian Arachnological Society No
AUSTRALASIAN ARACHNOLOGY Newsletter of the Australasian Arachnological Society No. 87 Summer 2018 $5.00 The web is strong Congress NZ 4 Gone fishing 20 Aussie rocks 26 AUSTRALASIAN ARACHNOLOGICAL SOCIETY Australasian Arachnology 87 The Australasian Newsletter Editorial Contents Arachnological Society Australasian Arachnology ISSN 0811-3696 is notion- Maintaining a society of Australian Arachnologists In this issue we range from Shark Bay Western The aim of the Australasian Arachnological Society ally scheduled to appear three times a year but often and issuing newsletters is no easy task, and all credit Australia to Christchurch New Zealand and meet is to promote interest in the ecology, behaviour and appears at far greater intervals. Previous issues are must go to those key members who stepped up over people from Ernst Haeckel to Sarah Crews. taxonomy of arachnids of the Australasian region. available to members at the society website via their the years to take on admin and newsletter duties. 2019 International Congress of Arachnology login. Back issues are available to non members 12 The Australasian Arachnological Society was New Zealand 10–15 February ............................................................. 4 Website months after publication date. formed in November 1979 by Robert Raven who A Game to Identify and Help Save Life by David Haynes ..... 6 produced the first nine issues of Australasian In 2018 the Society website was refreshed with Contributions Arachnology. Life Down Under by Mike Rix .............................................................. 8 a new design , a membership database and In 1983, while Robert Raven was overseas doing Lobster pots and Spider Baskets by Glenda Walter ................ 12 ecommerce abilities. Australasian Arachnology welcomes contributions from members of the Australasian Arachnological post-doctoral research, Richard Faulder, of Yanco This website replaces the previous version which Australian & NZ Arachnid Photography .................................. -
Biodiversity of the Sebangau Tropical Peat Swamp Forest, Indonesian Borneo
Biodiversity of the Sebangau tropical peat swamp forest, Indonesian Borneo S.J. Husson1, S.H. Limin2,3, Adul1,2, N.S. Boyd1, J.J. Brousseau1, S. Collier1,4, S.M. Cheyne1,5, L.J. D’Arcy1, R.A. Dow6, N.W. Dowds1,4, M.L. Dragiewicz1, D.A. Ehlers Smith1,7, Iwan1,2, Hendri1,2, P.R. Houlihan1,8, K.A. Jeffers1, B.J.M. Jarrett1,9, I.P. Kulu2, H.C. Morrogh-Bernard1,4, S.E. Page10, E.D. Perlett1, A. Purwanto1,2, B. Ripoll Capilla1, Salahuddin1,2, Santiano1,2, S.J.J. Schreven1,11, M.J. Struebig12, S.A. Thornton1,10, C. Tremlett1, Z. Yeen1,2,3 and M.E. Harrison1,10 1Borneo Nature Foundation, Palangka Raya, Central Kalimantan, Indonesia; 2UPT CIMTROP, University of Palangka Raya, Central Kalimantan, Indonesia; 3Deceased; 4University of Exeter, Penryn, Cornwall, UK; 5Oxford Brookes University, Oxford, UK; 6Naturalis Biodiversity Center, Leiden, The Netherlands and Sarawak Museum Campus Project, Jabatan Muzium Sarawak, Kuching, Sarawak, Malaysia; 7Current address: University of KwaZulu-Natal, School of Life Sciences, Scottsville, Pietermaritzburg, South Africa; 8Florida Museum of Natural History, University of Florida, Gainesville, Florida, USA; 9Current address: Department of Zoology, University of Cambridge, Cambridge, UK; 10School of Geography, Geology and the Environment, University of Leicester, Leicester, UK; 11Plant Ecology and Nature Conservation Group (current address: Laboratory of Entomology, Plant Sciences Group), Wageningen University & Research, Wageningen, The Netherlands; 12Durrell Institute of Conservation and Ecology, School of Anthropology and Conservation, University of Kent, Canterbury, UK _______________________________________________________________________________________ SUMMARY The importance of Southeast Asia’s tropical peat swamp forests for biodiversity is becoming increasingly recognised. -

The Conservation Value of Secondary Forests in the Southern Brazilian Mata Atlântica from a Spider Perspective
2014. The Journal of Arachnology 42:52–73 The conservation value of secondary forests in the southern Brazilian Mata Atlaˆntica from a spider perspective Florian Raub1, Hubert Ho¨fer1,4, Ludger Scheuermann2 and Roland Brandl3: 1Staatliches Museum fu¨r Naturkunde Karlsruhe, Erbprinzenstr. 13, D-76133 Karlsruhe, Germany; 2Lenzstraße 6, D-76137 Karlsruhe, Germany; 3Department of Animal Ecology, Philipps-Universita¨t Marburg, Karl-von-Frisch-Str. 3, D-35032 Marburg, Germany Abstract. In many tropical areas of the world, pristine forests have become rare. Nevertheless, due to shifts in the human population the area covered by secondary forests is increasing. These forests may harbor a rich flora and fauna and are considered to be main refuges for species of primary forests. However, this issue is far from clear. To assess the conservation value of secondary forests in the Atlantic Forest of Brazil, we compared the diversity of spiders in differently aged secondary forests with old-growth forests. Within a larger project treating several invertebrate taxa, we sampled spiders using a standard protocol in 24 sites of three successional stages (5–8, 15–20, 30–50 years old) and old-growth forests (. 100 years untouched) in two nature reserves. We describe the diversity and structure of the assemblages using morphospecies and genera and analyze richness at the genus level. Generic richness and diversity showed no differences between successional stages; i.e., did not increase from the youngest to older forests, but guild diversity did increase. The youngest stage showed the highest variability in generic composition, and the turnover of genera and species was strong between the younger forests (5–20 years old) and forests older than 30 years. -

Catatan Baru Fauna Laba-Laba Dari Sarawak, Malaysia)
Jurnal Biologi Indonesia 12(2): 307-312 (2016) SHORT COMMUNICATION New Records of the Spider Fauna from Sarawak, Malaysia (Catatan Baru Fauna Laba-Laba dari Sarawak, Malaysia) Dzulhelmi Muhammad Nasir*1, Wong Chun Xing2, Nur-Syahirah Mamat3, Yong Min Pui4, & Badiozaman Sulaiman5 1Institute of Biological Sciences, Faculty of Science, Universiti Malaya, 50603 Kuala Lumpur, MALAYSIA 2School of Social Sciences, Faculty of Humanities, Arts and Heritage, Universiti Malaysia Sabah, Jalan UMS, 88400 Kota Kinabalu, Sabah, MALAYSIA 3School of Environmental and Natural Resource Sciences, Faculty of Science and Technology, Universiti Kebangsaan Malaysia, 43600 Bangi, Selangor, MALAYSIA 4Institute of Biodiversity and Environmental Conservation, Universiti Malaysia Sarawak, 94300 Kota Samarahan, Sarawak, MALAYSIA 5Department of Zoology, Faculty of Resource Science and Technology, Universiti Malaysia Sarawak, 94300 Kota Samarahan, Sarawak, MALAYSIA *E-mail: [email protected] Received: November 2015, Accepted: December 2015 Spiders are one of the most diverse orders cies including 46 newly recorded species for Sara- worldwide and rank seventh in total species diversity wak (Koh et al. 2013). However, other species such among all other group of organisms (Cardoso & Mo- as Gasteracantha arcuata, G. hasselti and Phryna- rano 2010). They are highly adaptable, widespread in rachne ceylonica which had also been recorded almost all terrestrial ecosystems, and constitute one of (Grinang 2004) were not listed. Recently, several the most important components of global biodiversity newly described species such as Jerzego corticicola (McDonald 2007; Archana 2011). These predators (Maddison & Piascik 2014), Heteropoda parva are good indicators for environmental changes in the (Jager 2014), Aposphragisma brunomanseri, A. con- ecosystems, potential biological invasion, biological fluens, A.