Avicennia Portada: Mangle Rojo (Rhizophora Mangle)
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

(10 Y 50 M De Profundidad), Caribe Colombiano*
Bol. Invest. Mar. Cost. 39 (2) 397-416 ISSN 0122-9761 Santa Marta, Colombia, 2010 MOLUSCOS BENTÓNICOS DE LA GUAJIRA (10 Y 50 M DE PROFUNDIDAD), CARIBE COLOMBIANO* Erlenis Fontalvo Palacio 1, Adriana Gracia C. 1 y Guillermo Duque 2 1 Instituto de Investigaciones Marinas y Costeras “José Benito Vives De Andréis”-INVEMAR, Museo de Historia Natural Marina de Colombia (MHNMC), A.A.1016, Santa Marta, Colombia. erlenis_fontalvo@ invemar.org.co (E.F.), [email protected] (A.G.) 2 Universidad Nacional de Colombia, Facultad de Ingeniería y Administración, Departamento de Ingeniería, Ingeniería Ambiental, Carrera 32 Chapinero, Palmira, Colombia. [email protected]. edu.co RESUMEN Se estudi la composicin y abundancia de los moluscos bentnicos encontrados en el departamento de La Guajira al norte del Caribe colombiano. Para esto se realiz un crucero de investigacin a bordo del B/I Ancn del INVEMAR en donde se llevaron a cabo arrastres a 10 y 50 m de profundidad. Se recolect un total de 4840 individuos, identificndose 215 especies pertenecientes a las clases Gastropoda, Bivalvia, Scaphopoda, Cephalopoda y Polyplacophora, dentro de las cuales 19 fueron especies registradas por primera vez para el departamento. La clase Gastropoda present el mayor nmero de especies (52 %) y Bivalvia la mayor abundancia (71 % de los individuos), siendo el bivalvo Laevicardium sybariticum la especie ms abundante del rea de estudio. Los anlisis multivariados utilizados no mostraron patrones claramente definidos con relacin a la profundidad y el tipo de sedimento. PALABRAS CLAVE: Moluscos, Abundancia, Riqueza, La Guajira, Caribe colombiano. ABSTRACT Benthic mollusks of La Guajira (10 and 50 m depths), Colombian Caribbean. -

Os Nomes Galegos Dos Moluscos
A Chave Os nomes galegos dos moluscos 2017 Citación recomendada / Recommended citation: A Chave (2017): Nomes galegos dos moluscos recomendados pola Chave. http://www.achave.gal/wp-content/uploads/achave_osnomesgalegosdos_moluscos.pdf 1 Notas introdutorias O que contén este documento Neste documento fornécense denominacións para as especies de moluscos galegos (e) ou europeos, e tamén para algunhas das especies exóticas máis coñecidas (xeralmente no ámbito divulgativo, por causa do seu interese científico ou económico, ou por seren moi comúns noutras áreas xeográficas). En total, achéganse nomes galegos para 534 especies de moluscos. A estrutura En primeiro lugar preséntase unha clasificación taxonómica que considera as clases, ordes, superfamilias e familias de moluscos. Aquí apúntase, de maneira xeral, os nomes dos moluscos que hai en cada familia. A seguir vén o corpo do documento, onde se indica, especie por especie, alén do nome científico, os nomes galegos e ingleses de cada molusco (nalgún caso, tamén, o nome xenérico para un grupo deles). Ao final inclúese unha listaxe de referencias bibliográficas que foron utilizadas para a elaboración do presente documento. Nalgunhas desas referencias recolléronse ou propuxéronse nomes galegos para os moluscos, quer xenéricos quer específicos. Outras referencias achegan nomes para os moluscos noutras linguas, que tamén foron tidos en conta. Alén diso, inclúense algunhas fontes básicas a respecto da metodoloxía e dos criterios terminolóxicos empregados. 2 Tratamento terminolóxico De modo moi resumido, traballouse nas seguintes liñas e cos seguintes criterios: En primeiro lugar, aprofundouse no acervo lingüístico galego. A respecto dos nomes dos moluscos, a lingua galega é riquísima e dispomos dunha chea de nomes, tanto específicos (que designan un único animal) como xenéricos (que designan varios animais parecidos). -

Una Aproximación a La Florística Y Faunística De La
CICIMAR Oceánides 32(1): 39-58 (2017) UNA APROXIMACIÓN A LA FLORÍSTICA Y FAUNÍSTICA DE LA COSTA ROCOSA EL PULPO, CAZONES, VERACRUZ, MÉXICO De la Cruz-Francisco, Vicencio, Rosa Estela Orduña-Medrano, Josefina Esther Paredes- Flores, Rosa Ivette Vázquez-Estrada, Marlene González-González & Liliana Flores-Galicia Facultad de Ciencias Biológicas y Agropecuarias, Campus Tuxpan. Universidad Veracruzana. Carretera Tuxpan- Tampico Km 7.5, 92895, Tuxpan, Veracruz, México. e-mail: [email protected] RESUMEN. El intermareal rocoso de Veracruz, México, es un ecosistema que resguarda una gran biodiversidad. Sin embargo, no se ha reconocido su relevancia como con otros ecosistemas marinos. El objetivo de este estudio fue elaborar las primeras listas florística y faunística del intermareal rocoso de El Pulpo, localizada en el municipio de Cazones, Veracruz. Para ello, desde el 2013 a 2016 se efectuaron muestreos en la franja intermareal rocosa en periodos de marea baja para el registro de la biota marina y la recolecta de material biológico para su identificación taxonómica. Además, se realizó una revisión bibliográfica para complementar las listas de especies. Se registraron 51 especies de macroalgas bentónicas, una especie de fanerógama, 186 especies de invertebrados, y cinco especies de vertebrados para un total de 243 especies marinas. Las Rhodophyta son la ficoflora más representada con 29 es- pecies, mientras que el Phylum Mollusca lo es para la fauna con 139 especies. La mayoría de las especies marinas se registraron en el intermareal medio e inferior; por consiguiente la menor riqueza se registró en el intermareal superior y la constituyen algas filamentosas y foliosas, así como moluscos y crustáceos con hábitos ramoneadores y filtradores. -

South Carolina Department of Natural Resources
FOREWORD Abundant fish and wildlife, unbroken coastal vistas, miles of scenic rivers, swamps and mountains open to exploration, and well-tended forests and fields…these resources enhance the quality of life that makes South Carolina a place people want to call home. We know our state’s natural resources are a primary reason that individuals and businesses choose to locate here. They are drawn to the high quality natural resources that South Carolinians love and appreciate. The quality of our state’s natural resources is no accident. It is the result of hard work and sound stewardship on the part of many citizens and agencies. The 20th century brought many changes to South Carolina; some of these changes had devastating results to the land. However, people rose to the challenge of restoring our resources. Over the past several decades, deer, wood duck and wild turkey populations have been restored, striped bass populations have recovered, the bald eagle has returned and more than half a million acres of wildlife habitat has been conserved. We in South Carolina are particularly proud of our accomplishments as we prepare to celebrate, in 2006, the 100th anniversary of game and fish law enforcement and management by the state of South Carolina. Since its inception, the South Carolina Department of Natural Resources (SCDNR) has undergone several reorganizations and name changes; however, more has changed in this state than the department’s name. According to the US Census Bureau, the South Carolina’s population has almost doubled since 1950 and the majority of our citizens now live in urban areas. -

Molluscs (Mollusca: Gastropoda, Bivalvia, Polyplacophora)
Gulf of Mexico Science Volume 34 Article 4 Number 1 Number 1/2 (Combined Issue) 2018 Molluscs (Mollusca: Gastropoda, Bivalvia, Polyplacophora) of Laguna Madre, Tamaulipas, Mexico: Spatial and Temporal Distribution Martha Reguero Universidad Nacional Autónoma de México Andrea Raz-Guzmán Universidad Nacional Autónoma de México DOI: 10.18785/goms.3401.04 Follow this and additional works at: https://aquila.usm.edu/goms Recommended Citation Reguero, M. and A. Raz-Guzmán. 2018. Molluscs (Mollusca: Gastropoda, Bivalvia, Polyplacophora) of Laguna Madre, Tamaulipas, Mexico: Spatial and Temporal Distribution. Gulf of Mexico Science 34 (1). Retrieved from https://aquila.usm.edu/goms/vol34/iss1/4 This Article is brought to you for free and open access by The Aquila Digital Community. It has been accepted for inclusion in Gulf of Mexico Science by an authorized editor of The Aquila Digital Community. For more information, please contact [email protected]. Reguero and Raz-Guzmán: Molluscs (Mollusca: Gastropoda, Bivalvia, Polyplacophora) of Lagu Gulf of Mexico Science, 2018(1), pp. 32–55 Molluscs (Mollusca: Gastropoda, Bivalvia, Polyplacophora) of Laguna Madre, Tamaulipas, Mexico: Spatial and Temporal Distribution MARTHA REGUERO AND ANDREA RAZ-GUZMA´ N Molluscs were collected in Laguna Madre from seagrass beds, macroalgae, and bare substrates with a Renfro beam net and an otter trawl. The species list includes 96 species and 48 families. Six species are dominant (Bittiolum varium, Costoanachis semiplicata, Brachidontes exustus, Crassostrea virginica, Chione cancellata, and Mulinia lateralis) and 25 are commercially important (e.g., Strombus alatus, Busycoarctum coarctatum, Triplofusus giganteus, Anadara transversa, Noetia ponderosa, Brachidontes exustus, Crassostrea virginica, Argopecten irradians, Argopecten gibbus, Chione cancellata, Mercenaria campechiensis, and Rangia flexuosa). -

ABSTRACT Title of Dissertation: PATTERNS IN
ABSTRACT Title of Dissertation: PATTERNS IN DIVERSITY AND DISTRIBUTION OF BENTHIC MOLLUSCS ALONG A DEPTH GRADIENT IN THE BAHAMAS Michael Joseph Dowgiallo, Doctor of Philosophy, 2004 Dissertation directed by: Professor Marjorie L. Reaka-Kudla Department of Biology, UMCP Species richness and abundance of benthic bivalve and gastropod molluscs was determined over a depth gradient of 5 - 244 m at Lee Stocking Island, Bahamas by deploying replicate benthic collectors at five sites at 5 m, 14 m, 46 m, 153 m, and 244 m for six months beginning in December 1993. A total of 773 individual molluscs comprising at least 72 taxa were retrieved from the collectors. Analysis of the molluscan fauna that colonized the collectors showed overwhelmingly higher abundance and diversity at the 5 m, 14 m, and 46 m sites as compared to the deeper sites at 153 m and 244 m. Irradiance, temperature, and habitat heterogeneity all declined with depth, coincident with declines in the abundance and diversity of the molluscs. Herbivorous modes of feeding predominated (52%) and carnivorous modes of feeding were common (44%) over the range of depths studied at Lee Stocking Island, but mode of feeding did not change significantly over depth. One bivalve and one gastropod species showed a significant decline in body size with increasing depth. Analysis of data for 960 species of gastropod molluscs from the Western Atlantic Gastropod Database of the Academy of Natural Sciences (ANS) that have ranges including the Bahamas showed a positive correlation between body size of species of gastropods and their geographic ranges. There was also a positive correlation between depth range and the size of the geographic range. -

Mollusks of the Continental Margin of Northeast Brazil Collected During Jops Ii-6
19 MOLLUSKS OF THE CONTINENTAL MARGIN OF NORTHEAST BRAZIL COLLECTED DURING JOPS II-6. (1) DEUSINETE DE OLIVEIRA TENÓRIO (2) GERALDO SEMER POMPONET DE OLIVEIRA 1 - Oceanography Department, Federal University of Pernambuco 2 - Education Department, State of Bahia, Salvador ABSTRACT Geological and biological studies on the recent Quaternary of the northeastern coast of Brazil were accomplished during the 2nd expedition of R.V. Victor Hensen, project JOPS II, leg 6. The biological studies were made based on the material dredged at 17 stations off Ceará and Pernambuco States (04º05,03´ S to 07º59,5´ S), in depths from 20 to 330 meters, using dredges with a capacity of 80 liters of sediment. At some stations, a Van Veen dredge was used. Mollusks were present at 14 stations with 229 individuals that belonged to 66 species. Species associations were studied through cluster analysis (Jaccard index) using WPGMA linkage. Species were grouped mainly by sediment grain size. The gastropods formed 4 large groups at a 50% similarity level with subgroups formed with more than 75% similarity. Bivalves formed 2 groups with 50% and subgroups with larger similarity than 75%. The highest specific diversity was found at station 14. The area with the highest abundance was characterized by sand, mud and gravel. Highest species richness and abundance was found at depths between 20 and 40 meters. Key-words: Mollusks, Oceanographic surveys, Tropical South Atlantic Ocean. RESUMO Pesquisas geológicas e biológicas sobre o Quaternário Recente da costa Nordeste do Brasil foram realizadas durante a 2ª expedição do Navio Oceanográfico Victor Hensen, projeto JOPPS II, 6ª pernada. -

Florida Keys Species List
FKNMS Species List A B C D E F G H I J K L M N O P Q R S T 1 Marine and Terrestrial Species of the Florida Keys 2 Phylum Subphylum Class Subclass Order Suborder Infraorder Superfamily Family Scientific Name Common Name Notes 3 1 Porifera (Sponges) Demospongia Dictyoceratida Spongiidae Euryspongia rosea species from G.P. Schmahl, BNP survey 4 2 Fasciospongia cerebriformis species from G.P. Schmahl, BNP survey 5 3 Hippospongia gossypina Velvet sponge 6 4 Hippospongia lachne Sheepswool sponge 7 5 Oligoceras violacea Tortugas survey, Wheaton list 8 6 Spongia barbara Yellow sponge 9 7 Spongia graminea Glove sponge 10 8 Spongia obscura Grass sponge 11 9 Spongia sterea Wire sponge 12 10 Irciniidae Ircinia campana Vase sponge 13 11 Ircinia felix Stinker sponge 14 12 Ircinia cf. Ramosa species from G.P. Schmahl, BNP survey 15 13 Ircinia strobilina Black-ball sponge 16 14 Smenospongia aurea species from G.P. Schmahl, BNP survey, Tortugas survey, Wheaton list 17 15 Thorecta horridus recorded from Keys by Wiedenmayer 18 16 Dendroceratida Dysideidae Dysidea etheria species from G.P. Schmahl, BNP survey; Tortugas survey, Wheaton list 19 17 Dysidea fragilis species from G.P. Schmahl, BNP survey; Tortugas survey, Wheaton list 20 18 Dysidea janiae species from G.P. Schmahl, BNP survey; Tortugas survey, Wheaton list 21 19 Dysidea variabilis species from G.P. Schmahl, BNP survey 22 20 Verongida Druinellidae Pseudoceratina crassa Branching tube sponge 23 21 Aplysinidae Aplysina archeri species from G.P. Schmahl, BNP survey 24 22 Aplysina cauliformis Row pore rope sponge 25 23 Aplysina fistularis Yellow tube sponge 26 24 Aplysina lacunosa 27 25 Verongula rigida Pitted sponge 28 26 Darwinellidae Aplysilla sulfurea species from G.P. -

By John Martin Chenoweth a Dissertation Submitted in Partial Satisfaction of the Requirements for the Degree of Doctor of Philos
Religion, Archaeology, and Social Relations: A Study of the Practice of Quakerism and Caribbean Slavery in the Eighteenth-Century British Virgin Islands By John Martin Chenoweth A dissertation submitted in partial satisfaction of the requirements for the degree of Doctor of Philosophy in Anthropology in the Graduate Division of the University of California, Berkeley Committee in charge: Professor Laurie A. Wilkie Professor Rosemary A. Joyce Professor Kent G. Lightfoot Professor Ethan Shagan Spring 2011 Copyright 2011 by John Martin Chenoweth Abstract Religion, Archaeology, and Social Relations: A Study of the Practice of Quakerism and Caribbean Slavery in the Eighteenth-Century British Virgin Islands By John Martin Chenoweth Doctor of Philosophy in Anthropology University of California, Berkeley Professor Laurie A. Wilkie, Chair This dissertation considers the social construction and negotiation of religion in a particular place and time: a small, relatively poor cotton plantation in the British Virgin Islands in the eighteenth century. Due to a rich record of archival documents and historical writings, we know that religion, race, class, and other forces of identification were at play on this site, but the specifics of many of the players—their relationships and worldviews—do not survive in texts. To reconstruct these, three seasons of archaeological work were initiated on the site, the home of the Lettsom family and the enslaved people they held. What makes this site unique to the region is the association with known members of the Religious Society of Friends, better known as “Quakers.” The owners, Mary and Edward Lettsom were members of a small group of Quakers which formed from the local planter population about 1740, and both professed Quaker values for the rest of their lives. -

Inventario Sistematico Revisado Y Actualizado De Los Moluscos
Revista Brasileira de Gestão Ambiental e Sustentabilidade (2015): 2(2): 59-75. ISSN 2359-1412 Inventario sistemático revisado y actualizado de los moluscos marinos ocurrentes en el Estado de Santa Catarina, Brasil A. Ignacio Agudo-Padrón Projeto “Avulsos Malacológicos - AM,” Caixa Postal (P.O. Box) 010, Centro, Florianópolis-SC (CEP 88010-970). E-mail: [email protected]. http://noticias- malacologicas-am.webnode.pt. Resumen. Producto de 19 años completos de investigaciones de campo, examen de especímenes depositados em colecciones de Recebido: 13/04/2015 museos y estudios referenciales paralelos, el inventário malacológico sistemático marino del Estado de Santa Catarina, Región Subtropical Aceito: 20/06/2015 Central Sur del Brasil, es finalmente presentado, comportando un total de 671 espécies e subespécies confirmadas (11 Polyplacophora, Publicado: 30/06/2015 400 Gastropoda, 10 Scaphopoda, 226 Bivalvia y 24 Cephalopoda), distribuídas en 365 gêneros e 152 famílias, correspondientes al 42% del total estimado para el Brasil en general. De estas apenas dos son Acesso Aberto Artigo completo contempladas por categorias oficiales de conservación, cuatro constituyen reconocidas formas exóticas invasoras, y al menos otras 10 encuentranse directamente envolvidas en actividades antrópicas de maricultura, pesca y extractivismo. Palabras Clave: Moluscos marinos, Estado de Santa Catarina, Región sur del Brasil, Inventário de espécies. Resumo. Inventário sistemático revisado e atualizado dos moluscos marinhos ocorrentes no Estado de Santa Catarina, -

Macroflora Y Macrofauna De Los Sistemas Estuarinos De Michoacán, México Registrado Para Michoacán Y No Regulado En El País
M acroflora y macrofauna de los sistemas estuarinos de Michoacán, México Andrea Raz-Guzmán Posgrado en Ciencias del Mar y Limnología. UNAM Resumen Los sistemas estuarinos michoacanos han sido estudiados escasamente. Por esto se muestrearon 22 sistemas para registrar la macroflora y macrofauna, registros nuevos, especies bajo algún estatus, especies de importancia comercial y su distribución espacial. Las especies recolectadas y las registradas en la literatura sumaron 123 (29 plantas, 94 animales). Las familias mejor representadas fueron Cyperaceae, Palaemonidae, Gobiidae y Carangidae. Los registros nuevos incluyen 29 especies de plantas, 7 de insectos, 2 de crustáceos, 15 de moluscos y 3 de peces. Las especies bajo algún estatus son Rhizophora mangle , Avicennia germinans , Conocarpus erectus , Laguncularia racemosa y Poecilia butleri . Phragmites australis , Typha domingensis , Macrobrachium hobbsi y M. tenellum presentaron las distribuciones más amplias. Los sistemas con más especies fueron Santa Ana, Salinas del Padre, Nexpa y Coahuayana. Diez especies de plantas y Stramonita biserialis son ornamentales. Los coleópteros, hemípteros y odonatos son depredadores de larvas de mosquitos y, junto con Macrobrachium digueti , son bioindicadores de la calidad del agua. Litopenaeus vannamei , M. americanum y 19 especies de peces sostienen pesquerías importantes, mientras que Callinectes arcuatus , C. toxotes y Cardisoma crassum se comercializan localmente. Melanoides tuberculata es introducido, oportunista, hospedero de tremátodos parásitos, no Ciencia Nicolaita # 76 46 Abril de 2019 Macroflora y macrofauna de los sistemas estuarinos de Michoacán, México registrado para Michoacán y no regulado en el país. La riqueza de especies estuarinas en Michoacán es marcadamente baja en respuesta a sus lagunas y esteros pequeños y oligo-mesohalinos y la resultante heterogeneidad ambiental baja, así como al reducido número de estudios enfocados específicamente a los sistemas estuarinos. -
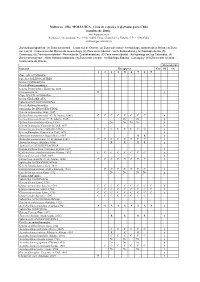
Moluscos - Filo MOLLUSCA
Moluscos - Filo MOLLUSCA. Lista de especies registradas para Cuba (octubre de 2006). José Espinosa Sáez Instituto de Oceanología, Ave 1ª No. 18406, Playa, Ciudad de La Habana, C.P. 11200, Cuba [email protected] Zonas biogeográficas: (1) Zona suroriental – Costa sur de Oriente, (2) Zona surcentral - Archipiélago Jardines de la Reina, (3) Zona sur central - Costa al sur del Macizo de Guamuhaya, (4) Zona suroccidental - Golfo de Batabanó y Archipiélago de los, (5) Canarreos, (6) Zona suroccidental - Península de Guanahacabibes, (7) Zona noroccidental - Archipiélago de Los Colorados, (8) Zona noroccidental - Norte Habana-Matanzas, (9) Zona norte-central - Archipiélago Sabana - Camagüey, (10) Zona norte-oriental - Costa norte de Oriente Abreviaturas Especies Bioegiones Cu Pl Oc 1 2 3 4 5 6 7 8 9 Clase APLACOPHORA Subclase SOLENOGASTRES Orden CAVIBELONIA Familia Proneomeniidae Género Proneomenia Hubrecht, 1880 Proneomenia sp . R x Clase POLYPLACOPHORA Orden NEOLORICATA Suborden ISCHNOCHITONINA Familia Ischnochitonidae Subfamilia ISCHNOCHITONINAE Género Ischnochiton Gray, 1847 Ischnochiton erythronotus (C. B. Adams, 1845) C C C C C C C C x Ischnochiton papillosus (C. B. Adams, 1845) Nc Nc x Ischnochiton striolatus (Gray, 1828) Nc Nc Nc Nc x Género Ischnoplax Carpenter in Dall, 1879 x Ischnoplax pectinatus (Sowerby, 1832) C C C C C C C C x Género Stenoplax Carpenter in Dall, 1879 x Stenoplax bahamensis Kaas y Belle, 1987 R R x Stenoplax purpurascens (C. B. Adams, 1845) C C C C C C C C x Stenoplax boogii (Haddon, 1886) R R R R x Subfamilia CALLISTOPLACINAE Género Callistochiton Carpenter in Dall, 1879 x Callistochiton shuttleworthianus Pilsbry, 1893 C C C C C C C C x Género Ceratozona Dall, 1882 x Ceratozona squalida (C.