Tesis Doctorado
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Amphidromy in Shrimps: a Life Cycle Between Rivers and the Sea
Lat. Am. J. Aquat. Res., 41(4): 633-650, 2013 Amphidromy in shrimps: a life cycle 633 “Studies on Freshwater Decapods in Latin America” Ingo S. Wehrtmann & Raymond T. Bauer (Guest Editors) DOI: 103856/vol41-issue4-fulltext-2 Review Amphidromy in shrimps: a life cycle between rivers and the sea Raymond T. Bauer1 1Department of Biology, University of Louisiana at Lafayette, Lafayette, Louisiana, 70504-2451 USA ABSTRACT. Amphidromy is a diadromous life history pattern, common in tropical and subtropical freshwater caridean shrimps, in which adults live, breed and spawn small-sized embryos in freshwater but have extended larval development (ELD) in marine waters. Most completely freshwater species spawn large embryos with either direct or abbreviated larval development (ALD). An important benefit of amphidromy is dispersal among river systems via marine larvae, which increases their access to alternative habitats. Thus, amphidromous species have much broader geographic distributions than closely related completely freshwater ones with ALD. ALD and freshwater ELD species appear to have evolved from amphidromous species with marine ancestors. Delivery of larvae to the sea in many amphidromous species is accomplished by upstream hatching and river drift of larvae to the sea. In other species, the females themselves apparently migrate down to marine waters to spawn. After development, the postlarvae must find a river mouth and migrate upstream to the adult habitat. Migrations occur at night, with juveniles swimming or crawling along the river or stream bank. Larvae are released during the wet or flood season of the year, while juvenile migrations take place during the dry or low-flow season. -

Rendimiento Reproductivo De Hembras De Cryphiops Caementarius (Crustacea: Palaemonidae) Mantenidas Con Alimento Natural
Rev. peru. biol. 16(2): 191- 193 (Diciembre 2009) © Facultad de Ciencias Biológicas UNMSM Rendimiento reproductivo de hembrasVersión de Online CRYPHIOPS ISSN C AEMENTARIUS 1727-9933 Rendimiento reproductivo de hembras de Cryphiops caementarius (Crustacea: Palaemonidae) mantenidas con alimento natural Reproductive Performance of female of Cryphiops caementarius (Crustacea: Palaemonidae) maintained with natural food Magali Bazán1, Silvia Gámez1 y Walter Eduardo Reyes2 1 Escuela de Biología en Acui- cultura. Universidad Nacional del Resumen Santa. El objetivo del presente trabajo fue determinar el rendimiento reproductivo de hembras de C. caementarius 2 Departamento de Biología, Micro- biología y Biotecnología. Facultad mantenidas con alimento natural. Se empleó 24 hembras inmaduras (5,2 cm y 2,0 g), acondicionadas en ocho de Ciencias. Universidad Nacional acuarios (45 L) y alimentadas durante dos meses de acuerdo a cada tratamiento, con pota (Dosidicus sp.), del Santa. Av. Universitaria s/n Urb. almeja (Semele solida), poliqueto (Pseudonereis sp.) y con alimento balanceado. El rendimiento reproductivo Bellamar. Nvo. Chimbote. Ancash. Perú. Email Walter Reyes: wre- de las hembras fue mejorado cuando se alimentó con poliqueto y pota, lográndose la maduración entre 16 y [email protected] 18 días con alta fecundidad (2627 y 1377 huevos g-1) y fertilidad (2566 y 1364 larvas g-1, respectivamente). Palabras Claves: Camarón, Cryphiops caementarius, nutrición, reproducción. Abstract The aim was to determine the reproductive performance of females of C. caementarius maintained with natural food. Twenty four females inmature were used (5,2 cm and 2,0 g), conditioned in eight aquarium (50 l) and fed Presentado: 30/10/2009 Aceptado: 26/12/2009 during two months according to each treatment, with giant squid (Dosidicus sp), clam (Semele solid), polychaete Publicado online: 12/01/2010 (Pseudonereis sp.) and with balanced. -

Cryphiops Caementarius (Molina, 1782)
FICHA DE ANTECEDENTES DE ESPECIE Id especie: Nombre Científico: Cryphiops caementarius (Molina, 1782) Nombre Común: Camarón de río del Norte de Chile Reino: Animalia Orden: Decapoda Phyllum/División: Arthropoda Familia: Palaemonidae Clase: Malacostraca Género: Cryphiops Sinonimia: Cancer caementarius , Molina Palaemon Gaudichaudii , Poeppig Cryphiops spinuloso-manus , Dana Bithynis longimana , Philippi Bithynis gaudichaudii , Ortman Bithynis caementarius , Ortman Antecedentes Gen erales: ASPECTOS MORFOLÓGICOS: Animal robusto, de abdomen tan largo y grueso como el cefalotórax, rostrum con cresta dorsal adornada por fila de 6 a 7 dientes gruesos, puede tener dientes a lo largo del borde ventral o carecer completamente de ellos, existiendo ejemplares con todos los estados intermedios relativos a estos extremos (Jara 1994). Primer y segundo par de patas caminadoras con quela o tenaza terminal; el segundo par mucho más grande que el primero y una de las patas de mayor tamaño que la opuesta (Jara 1994). El segundo par de patas del macho es distinto del de la hembra; la mayor anchura de los extremos del segundo segmento abdominal, en proporción a la longitud del abdomen y la relación cefalotoráxica, nos dan la evidencia de un dimorfismo sexual (Castro 1966). El espécimen macho más grande medido en la Colección del Instituto de Zoología (UACh) alcanzó a 59 mm, mientras que el más grande registrado en la literatura alcanzó 67 mm (Jara 1994). Rasgos distintivos ASPECTOS REPRODUCTIVOS: La mayor parte de los ejemplares migran activamente hacia la desembocadura de los ríos para la reproducción , liberar las larvas en los estuarios o zonas del potamon. En cuevas los machos tienen varias hembras que fertilizan después de la muda. -

The Effects of Eyestalk Ablation on the Reproductive and Immune
Asusena et al., J Aquacult Res Dev 2012, 3:8 Aquaculture http://dx.doi.org/10.4172/2155-9546.1000156 Research & Development Research Article Article OpenOpen Access Access The Effects of Eyestalk Ablation on the Reproductive and Immune Function of Female Macrobrachium americanum Aguiñaga-Cruz Jazmín Asusena, Sainz-Hernández Juan Carlos*, Fierro-Coronado Jesús Arturo and Diarte- Plata Genaro Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional, Instituto Politécnico Nacional-Unidad Sinaloa (CIIDIR IPN-SINALOA) Departamento de Acuacultura, Blvd. Juan de Dios Bátiz Paredes # 250, Guasave, Sinaloa, México. C. P. 81101. Abstract Eyestalk ablation is the most common procedure used to induce crustacean reproduction in commercial hatcheries. However, other physiological and metabolic processes are affected by the removal of the X-organ sinus gland complex located in the eyestalk. In this study, the effect of unilateral eyestalk ablation on the concentration of several hemolymph metabolites, reproduction and immune function in female Macrobrachium americanum was investigated. Molting cycle time was not significantly P( =0.17) shortened in eyestalk-ablated females. However, an increased number of molts was observed in the eyestalk-ablated group because survival was significantly higher due to increased passivity and lowered aggression. As M. americanum has closed thelyca, reproduction was not accelerated after eyestalk ablation compared to control prawns. Food intake (P=0.007) and oxygen consumption (P=0.047) were both higher in eyestalk-ablated females. Concentrations of protein and glucose in hemolymph were not affected (P=0.54 and P=0.19, respectively), indicating that the demand for these metabolites was met. Glucose was metabolized by aerobic metabolism as shown by the lower lactate concentration (P=0.02) and higher respiration rate after ablation. -

Maduración, Muda Y Crecimiento De Hembras Del Camarón De Río Cryphiops Caementarius Con Ablación Del Pedúnculo Ocular, En Condiciones De Laboratorio
Maduración, muda y crecimiento de hembras del camarón de río Cryphiops caementarius con ablación del pedúnculo ocular, en condiciones de laboratorio Maturation, moulting and growth of females prawn Cryphiops caementarius with eyestalk ablation, in laboratory conditions. Reyes-Avalos, Walter1; Gladis Melgarejo-Velásquez, Gladis2; Rojas-González, Elizabeth2 RESUMEN El objetivo fue estudiar la maduración, muda y crecimiento de hembras de C. caementarius con ablación del pedúnculo ocular. Se emplearon 25 hembras con ovarios en estado II y en muda C y D1: 5 hembras con pedúnculos oculares intactos; 10 con ablación de un solo pedúnculo ocular y 10 con ablación de ambos pedúnculos oculares. El experimento duró 98 días y abarcó época no reproductiva. La ablación unilateral no afectó la maduración ovárica ni la duración del ciclo de muda, solo ocasionó reducido crecimiento por muda (4% en LC) y moderada mortalidad (40%). En cambio la ablación bilateral ocasionó maduración temprana (25 días), menor duración del ciclo de muda (22 días), mayor crecimiento por muda (8% en LC), alta mortalidad (65%) y cambios en la relaciones de las medidas morfométricas. La ablación unilateral y bilateral no alteraron la duración de los estados de muda AB ni C, pero la ablación bilateral redujo la duración del estado D principalmente la división D 1’. Palabras clave: Ablación, maduración, muda, crecimiento, camarón. ABSTRACT The aim was to determine the effects of ablation unilateral and bilateral eyestalk, in maturation, moult and growth female C. caementarius. Twenty-five females were used with ovaries in stage II and in moult C and D1: five females with eyestalk intact, ten with ablation of a single eyestalk and ten with ablation of both eyestalks. -

Biofloc Technology
Reviews in Aquaculture, 1–24 doi: 10.1111/raq.12408 Biofloc technology: principles focused on potential species and the case study of Chilean river shrimp Cryphiops caementarius David Antonio Ulloa Walker1,Marıa Cristina Morales Suazo2 and Maurıcio Gustavo Coelho Emerenciano3 1 Programa Cooperativo Doctorado en Acuicultura, Universidad de Chile, Universidad Catolica del Norte, Pontificia Universidad Catolica de Valparaıso, Chile, Grupo de Marcadores Inmunologicos. Laboratorio de Genetica e Inmunologıa Molecular. Instituto de Biologıa, Pontificia Universidad Catolica de Valparaıso, Valparaiso, Chile 2 Universidad Catolica del Norte, Facultad de Ciencias del Mar, Departamento de Acuicultura- Larrondo 1281, Coquimbo, Chile 3 Santa Catarina State University (UDESC), Aquaculture Laboratory (LAQ), Laguna, SC, Brazil. Present address: CSIRO Agriculture and Food, Aquaculture Program, Bribie Island Research Centre, Bribie Island, Qld, Australia Correspondence Abstract Marıa Cristina Morales Suazo, Universidad Catolica del Norte, Facultad de Ciencias del The accelerated growth of aquaculture has caused environmental impacts in many Mar, Departamento de Acuicultura-Larrondo countries. Examples include the use of large volumes of water, discharge of efflu- 1281, 1781421 Coquimbo, Chile. Email: ents with high nutrient content, the occupation of large areas, natural habitat [email protected] alternation and the escape of exotic species. Biofloc technology (BFT) is an aqua- culture tool that requires minimal water exchange, promotes the nutrient recy- Received 11 September 2019; accepted 9 cling optimizing resources and produces natural food in situ by forming December 2019. suspended microbial aggregates in the water (bioflocs). These microorganisms provide multiple benefits such as water quality control, pathogen resistance and nutritional supplementation. Species such as Litopenaeus vannamei and tilapia have been successfully applied in BFT. -
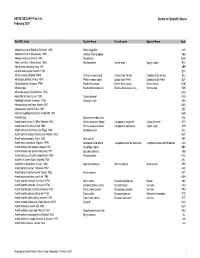
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste -

Revisión De Los Géneros Cryphiops Dana, 1852 Y Bithynops Holthuis, 1973, De La Familia Palaemonidae (Crustacea, Decapoda)
v-we-íoVe s. ¿eseOS Anales Inst. Biol. Uriiv. Nac. Autón. México, Ser. Zool., 60(2): 159-184, 28-XII-1989 )íiM\ REVISIÓN DE LOS GÉNEROS CRYPHIOPS DANA, 1852 Y BITHYNOPS HOLTHUIS, 1973, DE LA FAMILIA PALAEMONIDAE (CRUSTACEA, DECAPODA), Y DESCRIPCIÓN DE UNA ESPECIE NUEVA PARA EL ESTADO DE CHIAPAS, MÉXICO JOSÉ LUIS VILLALOBOS HIRIART* JUAN CARLOS NATES RODRÍGUEZ** ANTONIO CANTÚ DÍAZ BARRIGA** RESUMEN Como resultado de los muestreos realizados por el personal de la Colección Carcinológica del Instituto de Biología, en la Sierra Norte de Chiapas, se revisa la estrecha relación entre los géneros Cryphiops y Bithynops, de la subfamilia Palaemoninae. Este análisis, deja en claro que la posición del género Bithynops está basada en caracteres de escasa relevancia taxo- nómica, por lo cual se propone su sinonimización bajo el género Cryphiops y la redefinición de este último, con base en características morfológicas así como biológicas, en dos sub- géneros nuevos que albergarán a las especies sudamericanas y a las del sur de nuestro país. Por otra parte, se describe una especie nueva del género Cryphiops, recolectada en el municipio de Ocosingo, Chiapas. Se presentan breves descripciones del género, subgéneros y especies; una breve discu- sión acerca de sus relaciones; una clave para la separación de los dos últimos taxa y dibujos de los caracteres morfológicos importantes en la determinación de las especies. PALABRAS CLAVE: Taxonomía, Crustacea, Decapoda, Palaemonidae, Revisión, Cryphiops, Bithynops, Dos Subgéneros y Una Especie Nuevos, Chiapas, México. ABSTRACT On the basis of materials obtained by members of the Colección Carcinológica del Instituto de Biología, the relationship of the genera Cryphiops and Bithynops, members of the sub- family Palaemoninae, are reviewed. -

Producción Larval Del Camarón De Río (Cryphiops Caementarius) En Condiciones De Laboratorio, Huacho, Perú
Recibido: 13-02-2013 Aprobado: 12-06-2013 Producción larval del Camarón de río (Cryphiops caementarius) en condiciones de laboratorio, Huacho, Perú Larval production of Cryphiops caementarius under laboratory conditions, Huacho - Peru Héctor Romero Camarena1, César Augusto Zelada Mendoza2, Jhon P. Álvarez Veliz1 RESUMEN El objetivo de la presente investigación es la producción larval de Camarón de río, en condiciones de laboratorio de la Universidad Nacional José Faustino Sánchez Carrión. Se utilizaron reproductores del Río Pativilca. La fertilización, incubación y desarrollo larval se hicieron bajo condiciones controladas de: calidad de agua, alimentación, mortalidad y control microbiológico. El proceso de incubación duró 27 días, naciendo 3 269 larvas a una temperatura de agua de 27 °C. La primera postlarva apareció a los 77 días. Las larvas se alimentaron con micro algas, nauplios de artemia y flan de huevo. El cultivo se mantuvo a una temperatura del agua de 20°C a 24 °C. y la salinidad fue de 12°/°° a 20°/°° . Finalmente se obtuvieron 503 postlarvas juveniles, equivalente a 15,2 % de sobrevivencia. Las conclusiones fueron que el proceso de incubación duró entre 26 a 27 días, a una temperatura del agua 27°C, la primera post larva y/o juvenil apareció a los 77 días de cultivo, finalmente se logró obtener 503 juveniles del Cryphiops caementarius, lo que significa una sobrevivencia de 15,2% y los alimentos usados fueron aceptados positivamente por las larvas. Los camarones juveniles fueron reservados como futuros reproductores denominados: Camarones de río peruano (cepa faustiniana). Palabras clave: Perú, camarón, reproducción, larvas, juveniles, laboratorio. ABSTRACT The objective of this research is the larval production of Cryphiops caementarius, in the laboratory of the Universidad Nacional José Faustino Sánchez Carrión. -

Instituto Del Mar Del Perú
BOLETÍN INSTITUTO DEL MAR DEL PERÚ ISSN 0458 – 7766 Volumen 27, Números 1-2 CATÁLOGO DE CRUSTÁCEOS DECÁPODOS Y ESTOMATÓPODOS DEL PERÚ Víctor Moscoso Enero - Diciembre 2012 Callao, Perú 1 El INSTITUTO DEL MAR DEL PERÚ (IMARPE) tiene cuatro tipos de publicaciones científicas: BOLETÍN (ISSN 0458–7766), desde 1964.- Es la publicación de rigor científico, que constituye un aporte al mejor conocimiento de los recursos acuáticos, las interacciones entre éstos y su ambiente, y que permite obtener conclusiones preliminares o finales sobre las investigaciones. El BOLETÍN constituye volúmenes y números semestrales, y la referencia a esta publicación es: Bol Inst Mar Perú. INFORME (ISSN 0378 – 7702), desde 1965.- Es la publicación que da a conocer los resultados preliminares o finales de una operación o actividad, programada dentro de un campo específico de la investigación científica y tecnológica y que requiere difusión inmediata. El INFORME ha tenido numeración consecutiva desde 1965 hasta el 2001, con referencia del mes y el año, pero sin reconocer el Volumen. A partir del 2004, se consigna el Volumen 32, que corresponde al número de años que se viene publicando, y además se anota el fascículo o número trimestral respectivo. La referencia a esta publicación es: Inf Inst Mar Perú. INFORME PROGRESIVO, desde 1995 hasta 2001. Una publicación con dos números mensuales, de distribución nacional. Contiene información de investigaciones en marcha, conferencias y otros documentos técnicos sobre temas de vida marina. El INFORME PROGRESIVO tiene numeración consecutiva, sin mencionar el año o volumen. Debe ser citado como Inf Prog Inst Mar Perú. Su publicación ha sido interrumpida. -

PNRAA941.Pdf
AGENCY FOR INTERNATIONAL DEVELOPMENT FOR AID USE ONI Y WASHINGTON. 0. C. 20523 6 BIBLIOGRAPHIC INPUT SHEET ATCN At A. PRIMARY 1. SUBJECT A ricul ture AMnn-nnnn-nsin CLASSI- B. SECONDARY FICATION Fisheries--Peru 2. TITLE AND SUBTITLE Flshculture survey report for Peru 3. AUTHOR(S) Smitherman,R.O.; Moss,D.D. 4. DOCUMENT DATE 5 NUMBER OF PAGES 6. ARC NUMBER 19701 48p. ARC PE639.3.A897 7. REFERENCE ORGANIZATION NAME AND ADDRESS Auburn 8. SUPPLEMENTARY NOTES (Sponeoring Organization, Publlaherap Availability) 9. ABSTRACT 10. CONTROL NUMBER i1. PRICE OF DOCUMENT PN-RAA-941 12. DESCRIPTORS 13. PROJECT NUMBER Peru 14. CSD-2270CONTRACT NUMBERGTS 15. TYPE OF DOCUMENT AID 590.1 (4-74) FISHCULTURE SURVEY REPORT FOR PERU R. 0. Smitherman and D. D. Moss International Center for Aquacultures Auburn University Agricultural Experiment Station Auburn, Alabama 36830 Project: A.I.D./csd-2270 September 30, 1970 TABLE OF CONTENTS Page 1.0 ITINERARY ................................ iv 2.0 RECOMMENDATIONS ....................................... vi 3.0 FISHCULTURE SURVEY REPORT FOR PERU ................ 1 3.01 Introduction ............................................ 1 3.02 Geography, Topography and Climate ..................... 1 3.03 Nutritional and Economic Aspects ........................ 2 3.04 Status of the Fisheries ........ *...... ***..............a 4 3.05 Government Divisions Responsible for Fisheries ........... 5 3.06 Fisheries Training ...... ................................. 7 3.07 Inland Fisheries ........................................ 8 3.071 Trout Fishery ................................. 8 3.0711 Lake Titicaca ......................... 8 3.0712 Hatcheries and Stocking Program ....... 15 3.072 Freshwater Shrimp. ...... ........ ... ..... 15 3.073 Ornamental Fishes ............................. 17 3.074 Commercial Fishery in the Amazonas Region..... 19 3.075 Culture of Warmwater Fishes ................... 24 4.0 SUMMARY .......................... .. ...... .. 29 5,0 CONFERENCES ....................... -

Multigene Phylogeny and Taxonomic Revision of American Shrimps of the Genus Cryphiops Dana, 1852 (Decapoda, Palaemonidae)
ZooKeys 1047: 155–198 (2021) A peer-reviewed open-access journal doi: 10.3897/zookeys.1047.66933 RESEARCH ARTICLE https://zookeys.pensoft.net Launched to accelerate biodiversity research Multigene phylogeny and taxonomic revision of American shrimps of the genus Cryphiops Dana, 1852 (Decapoda, Palaemonidae) implies a proposal for reversal of precedence with Macrobrachium Spence Bate, 1868 Fernando L. Mantelatto1, Leonardo G. Pileggi1, João A. F. Pantaleão1, Célio Magalhães1,2, José Luis Villalobos3, Fernando Álvarez3 1 Laboratório de Bioecologia e Sistemática de Crustáceos (LBSC), Departamento de Biologia, Faculdade de Filosofia, Ciências e Letras de Ribeirão Preto (FFCLRP), Universidade de São Paulo (USP), Ribeirão Preto, São Paulo, Brazil 2 Instituto Nacional de Pesquisas da Amazônia (INPA) (Retired), Manaus, Amazonas, Brazil 3 Colección Nacional de Crustáceos, Instituto de Biología, Universidad Nacional Autónoma de México, Apartado Postal 70-153, 04510 Ciudad de México, Mexico Corresponding author: Fernando L. Mantelatto([email protected]) Academic editor: Ingo S. Wehrtmann | Received 4 April 2021 | Accepted 15 May 2021 | Published 1 July 2021 http://zoobank.org/AA254315-4F9B-43A0-A910-24BEA3298D9D Citation: Mantelatto FL, Pileggi LG, Pantaleão JAF, Magalhães C, Villalobos JL, Álvarez F (2021) Multigene phylogeny and taxonomic revision of American shrimps of the genus Cryphiops Dana, 1852 (Decapoda, Palaemonidae) implies a proposal for reversal of precedence with Macrobrachium Spence Bate, 1868. ZooKeys 1047: 155–198. https:// doi.org/10.3897/zookeys.1047.66933 Abstract The freshwater shrimp genus Cryphiops Dana, 1852 has a disjunct distribution in North (Mexico) and South (Brazil, Chile) America, and is composed of only six species. The current classification of genera in the Palaemonidae is controversial, based on variable morphological characters, and still far from a clear definition.