Aspectos Reprodutivos De Ratos Obesos E Diabéticos
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

The Functional Profiles of Chicken Eggs Incubated Under
THE FUNCTIONAL PROFILES OF CHICKEN EGGS INCUBATED UNDER MONOCHROMATIC LIGHTING A Dissertation by MOHAMED MAGDY ABDELFATTAH IBRAHIM Submitted to the Office of Graduate and Professional Studies of Texas A&M University in partial fulfillment of the requirements for the degree of DOCTOR OF PHILOSOPHY Chair of Committee, Giridhar Athrey Committee Members, John B. Carey Luc R. Berghman Gregory S. Archer Head of Department, Audrey McElroy May 2021 Major Subject: Poultry Science Copyright 2021 Mohamed Magdy Abdelfattah Ibrahim ABSTRACT Poultry production remains susceptible to significant infectious disease threats such as Avian Flu, and Newcastle Disease Virus (NDV), which threaten the supply of poultry production. My dissertation research addresses this challenge by leveraging avian circadian biology to improve responses to vaccines to enhance poultry performance. The central hypothesis is that specific visible light wavelengths would enhance circadian rhythm development in ovo, leading to improved immune responses. I addressed an essential question regarding the effect of providing photoperiods with different wavelengths (Blue, Green, and White) on circadian rhythm development and its interplay with the immune response following the NDV challenge in chick embryos using the RNAseq technology. Our results showed that incubating chicken embryos under blue light 450nm was most efficient in entraining the circadian rhythm in lung tissue, compared to white light or dark treatment. Blue light showed a specific impact on skeletal muscle, regulation of striated muscle contraction, Glycerolipid metabolism, and development of neurons. The white light incubation led to a photo-acceleration stimulant effect on epidermal growth factor receptor signaling pathway, ErbB signaling pathway, MAPK signaling pathway, and Insulin signaling pathway were upregulated in white light non-challenged treatment. -
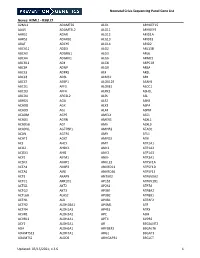
NICU Gene List Generator.Xlsx
Neonatal Crisis Sequencing Panel Gene List Genes: A2ML1 - B3GLCT A2ML1 ADAMTS9 ALG1 ARHGEF15 AAAS ADAMTSL2 ALG11 ARHGEF9 AARS1 ADAR ALG12 ARID1A AARS2 ADARB1 ALG13 ARID1B ABAT ADCY6 ALG14 ARID2 ABCA12 ADD3 ALG2 ARL13B ABCA3 ADGRG1 ALG3 ARL6 ABCA4 ADGRV1 ALG6 ARMC9 ABCB11 ADK ALG8 ARPC1B ABCB4 ADNP ALG9 ARSA ABCC6 ADPRS ALK ARSL ABCC8 ADSL ALMS1 ARX ABCC9 AEBP1 ALOX12B ASAH1 ABCD1 AFF3 ALOXE3 ASCC1 ABCD3 AFF4 ALPK3 ASH1L ABCD4 AFG3L2 ALPL ASL ABHD5 AGA ALS2 ASNS ACAD8 AGK ALX3 ASPA ACAD9 AGL ALX4 ASPM ACADM AGPS AMELX ASS1 ACADS AGRN AMER1 ASXL1 ACADSB AGT AMH ASXL3 ACADVL AGTPBP1 AMHR2 ATAD1 ACAN AGTR1 AMN ATL1 ACAT1 AGXT AMPD2 ATM ACE AHCY AMT ATP1A1 ACO2 AHDC1 ANK1 ATP1A2 ACOX1 AHI1 ANK2 ATP1A3 ACP5 AIFM1 ANKH ATP2A1 ACSF3 AIMP1 ANKLE2 ATP5F1A ACTA1 AIMP2 ANKRD11 ATP5F1D ACTA2 AIRE ANKRD26 ATP5F1E ACTB AKAP9 ANTXR2 ATP6V0A2 ACTC1 AKR1D1 AP1S2 ATP6V1B1 ACTG1 AKT2 AP2S1 ATP7A ACTG2 AKT3 AP3B1 ATP8A2 ACTL6B ALAS2 AP3B2 ATP8B1 ACTN1 ALB AP4B1 ATPAF2 ACTN2 ALDH18A1 AP4M1 ATR ACTN4 ALDH1A3 AP4S1 ATRX ACVR1 ALDH3A2 APC AUH ACVRL1 ALDH4A1 APTX AVPR2 ACY1 ALDH5A1 AR B3GALNT2 ADA ALDH6A1 ARFGEF2 B3GALT6 ADAMTS13 ALDH7A1 ARG1 B3GAT3 ADAMTS2 ALDOB ARHGAP31 B3GLCT Updated: 03/15/2021; v.3.6 1 Neonatal Crisis Sequencing Panel Gene List Genes: B4GALT1 - COL11A2 B4GALT1 C1QBP CD3G CHKB B4GALT7 C3 CD40LG CHMP1A B4GAT1 CA2 CD59 CHRNA1 B9D1 CA5A CD70 CHRNB1 B9D2 CACNA1A CD96 CHRND BAAT CACNA1C CDAN1 CHRNE BBIP1 CACNA1D CDC42 CHRNG BBS1 CACNA1E CDH1 CHST14 BBS10 CACNA1F CDH2 CHST3 BBS12 CACNA1G CDK10 CHUK BBS2 CACNA2D2 CDK13 CILK1 BBS4 CACNB2 CDK5RAP2 -

OXPHOS Remodeling in High-Grade Prostate Cancer Involves Mtdna Mutations and Increased Succinate Oxidation
ARTICLE https://doi.org/10.1038/s41467-020-15237-5 OPEN OXPHOS remodeling in high-grade prostate cancer involves mtDNA mutations and increased succinate oxidation Bernd Schöpf 1, Hansi Weissensteiner 1, Georg Schäfer2, Federica Fazzini1, Pornpimol Charoentong3, Andreas Naschberger1, Bernhard Rupp1, Liane Fendt1, Valesca Bukur4, Irina Giese4, Patrick Sorn4, Ana Carolina Sant’Anna-Silva 5, Javier Iglesias-Gonzalez6, Ugur Sahin4, Florian Kronenberg 1, ✉ Erich Gnaiger 5,6 & Helmut Klocker 7 1234567890():,; Rewiring of energy metabolism and adaptation of mitochondria are considered to impact on prostate cancer development and progression. Here, we report on mitochondrial respiration, DNA mutations and gene expression in paired benign/malignant human prostate tissue samples. Results reveal reduced respiratory capacities with NADH-pathway substrates glu- tamate and malate in malignant tissue and a significant metabolic shift towards higher succinate oxidation, particularly in high-grade tumors. The load of potentially deleterious mitochondrial-DNA mutations is higher in tumors and associated with unfavorable risk factors. High levels of potentially deleterious mutations in mitochondrial Complex I-encoding genes are associated with a 70% reduction in NADH-pathway capacity and compensation by increased succinate-pathway capacity. Structural analyses of these mutations reveal amino acid alterations leading to potentially deleterious effects on Complex I, supporting a causal relationship. A metagene signature extracted from the transcriptome of tumor samples exhibiting a severe mitochondrial phenotype enables identification of tumors with shorter survival times. 1 Institute of Genetic Epidemiology, Department of Genetics and Pharmacology, Medical University Innsbruck, Schöpfstraße 41, A-6020 Innsbruck, Austria. 2 Institute of Pathology, Neuropathology and Molecular Pathology, Medical University Innsbruck, Müllerstraße 44, A-6020 Innsbruck, Austria. -

Lncrna SNHG8 Is Identified As a Key Regulator of Acute Myocardial
Zhuo et al. Lipids in Health and Disease (2019) 18:201 https://doi.org/10.1186/s12944-019-1142-0 RESEARCH Open Access LncRNA SNHG8 is identified as a key regulator of acute myocardial infarction by RNA-seq analysis Liu-An Zhuo, Yi-Tao Wen, Yong Wang, Zhi-Fang Liang, Gang Wu, Mei-Dan Nong and Liu Miao* Abstract Background: Long noncoding RNAs (lncRNAs) are involved in numerous physiological functions. However, their mechanisms in acute myocardial infarction (AMI) are not well understood. Methods: We performed an RNA-seq analysis to explore the molecular mechanism of AMI by constructing a lncRNA-miRNA-mRNA axis based on the ceRNA hypothesis. The target microRNA data were used to design a global AMI triple network. Thereafter, a functional enrichment analysis and clustering topological analyses were conducted by using the triple network. The expression of lncRNA SNHG8, SOCS3 and ICAM1 was measured by qRT-PCR. The prognostic values of lncRNA SNHG8, SOCS3 and ICAM1 were evaluated using a receiver operating characteristic (ROC) curve. Results: An AMI lncRNA-miRNA-mRNA network was constructed that included two mRNAs, one miRNA and one lncRNA. After RT-PCR validation of lncRNA SNHG8, SOCS3 and ICAM1 between the AMI and normal samples, only lncRNA SNHG8 had significant diagnostic value for further analysis. The ROC curve showed that SNHG8 presented an AUC of 0.850, while the AUC of SOCS3 was 0.633 and that of ICAM1 was 0.594. After a pairwise comparison, we found that SNHG8 was statistically significant (P SNHG8-ICAM1 = 0.002; P SNHG8-SOCS3 = 0.031). -

Human Mitochondrial Pathologies of the Respiratory Chain and ATP Synthase: Contributions from Studies of Saccharomyces Cerevisiae
life Review Human Mitochondrial Pathologies of the Respiratory Chain and ATP Synthase: Contributions from Studies of Saccharomyces cerevisiae Leticia V. R. Franco 1,2,* , Luca Bremner 1 and Mario H. Barros 2 1 Department of Biological Sciences, Columbia University, New York, NY 10027, USA; [email protected] 2 Department of Microbiology,Institute of Biomedical Sciences, Universidade de Sao Paulo, Sao Paulo 05508-900, Brazil; [email protected] * Correspondence: [email protected] Received: 27 October 2020; Accepted: 19 November 2020; Published: 23 November 2020 Abstract: The ease with which the unicellular yeast Saccharomyces cerevisiae can be manipulated genetically and biochemically has established this organism as a good model for the study of human mitochondrial diseases. The combined use of biochemical and molecular genetic tools has been instrumental in elucidating the functions of numerous yeast nuclear gene products with human homologs that affect a large number of metabolic and biological processes, including those housed in mitochondria. These include structural and catalytic subunits of enzymes and protein factors that impinge on the biogenesis of the respiratory chain. This article will review what is currently known about the genetics and clinical phenotypes of mitochondrial diseases of the respiratory chain and ATP synthase, with special emphasis on the contribution of information gained from pet mutants with mutations in nuclear genes that impair mitochondrial respiration. Our intent is to provide the yeast mitochondrial specialist with basic knowledge of human mitochondrial pathologies and the human specialist with information on how genes that directly and indirectly affect respiration were identified and characterized in yeast. Keywords: mitochondrial diseases; respiratory chain; yeast; Saccharomyces cerevisiae; pet mutants 1. -

Viewed and Edited the Knowledge of the PT and Urinary Proteome (31–33)
Original Investigation Functionally Essential Tubular Proteins Are Lost to Urine-Excreted, Large Extracellular Vesicles during Chronic Renal Insufficiency Ryan J. Adam,1 Mark R. Paterson,1 Lukus Wardecke,1 Brian R. Hoffmann,1,2,3,4 and Alison J. Kriegel1,3,5 Abstract Background The 5/6 nephrectomy (5/6Nx) rat model recapitulates many elements of human CKD. Within weeks of surgery, 5/6Nx rats spontaneously exhibit proximal tubular damage, including the production of very large extracellular vesicles and brush border shedding. We hypothesized that production and elimination of these structures, termed large renal tubular extracellular vesicles (LRT-EVs), into the urine represents a pathologic mechanism by which essential tubule proteins are lost. Methods LRT-EVs were isolated from 5/6Nx rat urine 10 weeks after surgery. LRT-EV diameters were measured. LRT-EV proteomic analysis was performed by tandem mass spectrometry. Data are available via the Proteo- meXchange Consortium with identifier PXD019207. Kidney tissue pathology was evaluated by trichrome staining, TUNEL staining, and immunohistochemistry. Results LRT-EV size and a lack of TUNEL staining in 5/6Nx rats suggest LRT-EVs to be distinct from exosomes, microvesicles, and apoptotic bodies. LRT-EVs contained many proximal tubule proteins that, upon disruption, are known to contribute to CKD pathologic hallmarks. Select proteins included aquaporin 1, 16 members of the solute carrier family, basolateral Na1/K1-ATPase subunit ATP1A1, megalin, cubilin, and sodium-glucose cotransporters (SLC5A1 and SLC5A2). Histologic analysis confirmed the presence of apical membrane proteins in LRT-EVs and brush border loss in 5/6Nx rats. Conclusions This study provides comprehensive proteomic analysis of a previously unreported category of extracellular vesicles associated with chronic renal stress. -

The Reducible Disulfide Proteome of Synaptosomes Supports a Role For
Neurochemical Research (2020) 45:1825–1838 https://doi.org/10.1007/s11064-020-03046-7 ORIGINAL PAPER The Reducible Disulfde Proteome of Synaptosomes Supports a Role for Reversible Oxidations of Protein Thiols in the Maintenance of Neuronal Redox Homeostasis Timothy D. Foley1 · Giancarlo Montovano1 · Monserrath Camacho Ayala1 Received: 5 March 2020 / Revised: 13 April 2020 / Accepted: 4 May 2020 / Published online: 12 May 2020 © Springer Science+Business Media, LLC, part of Springer Nature 2020 Abstract The mechanisms by which neurons maintain redox homeostasis, disruption of which is linked to disease, are not well known. Hydrogen peroxide, a major cellular oxidant and neuromodulator, can promote reversible oxidations of protein thiols but the scope, targets, and signifcance of such oxidations occurring in neurons, especially in vivo, are uncertain. Using redox phenylarsine oxide (PAO)-afnity chromatography, which exploits the high-afnity of trivalent arsenicals for protein dithiols, this study investigated the occurrence of reducible and, therefore, potentially regulatory, protein disulfde bonds in Triton X-100-soluble protein fractions from isolated nerve-endings (synaptosomes) prepared from rat brains. Postmortem oxida- tions of protein thiols were limited by rapidly freezing the brains following euthanasia and, later, homogenizing them in the presence of the N-ethylmaleimide to trap reduced thiols. The reducible disulfde proteome comprised 5.4% of the total synaptosomal protein applied to the immobilized PAO columns and was overrepresented by pathways underlying ATP syn- aptic supply and demand including synaptic vesicle trafcking. The alpha subunits of plasma membrane Na +, K+-ATPase and the mitochondrial ATP synthase were particularly abundant proteins of the disulfde proteome and were enriched in this fraction by 3.5- and 6.7-fold, respectively. -

Role of MICOS for Mitochondrial Morphology and Function
Role of MICOS for mitochondrial morphology and function Dissertation for the award of the degree "Doctor rerum naturalium" at the Georg-August-University Göttingen within the doctoral program "Molecular Medicine" of the Georg-August University School of Science (GAUSS) submitted by Tobias Müller born in Alfeld (Leine) Göttingen, 2019 Members of the Thesis Committee Prof. Dr. Peter Rehling University Medical Center Göttingen (Supervisor and First Referee) Institute for Cellular Biochemistry Göttingen, Germany PD Dr. Olaf Jahn Proteomics (Second Referee) Max-Planck Institute for Experimental Medicine Göttingen, Germany Prof. Dr. Michael Meinecke University Medical Center Göttingen Institute for Cellular Biochemistry Göttingen, Germany Additional Members of the Examination Board Prof. Dr. Stefan Jakobs Department of Nanobiophotonics Max-Planck Institute for Biophysical Chemistry Göttingen, Germany Dr. Alexander Stein Membrane Protein Biochemistry Max-Planck Institute for Biophysical Chemistry Göttingen, Germany Prof. Dr. Ralph Kehlenbach University Medical Center Göttingen Institute for Molecular Biology Göttingen, Germany Affidativ Herewith I declare that I prepared my dissertation "Role of MICOS for mitochdon- drial morphology and function" on my own and with no other sources and aids than quoted. Göttingen, March 2019 Part of this thesis will be communicated in the following publication: Callegari S., Müller T., Schulz C., Lenz C., Jans D. C., Wissel M., Opazi F., Rizzoli S. O., Jakobs S., Urlaub H., Rehling P., Deckers M. (2019). A MICOS-TIM22 association promotes mitochondrial carrier import in human mitochondria. Journal of Molecular Biology (submitted) Acknowledgements First of all I would like to thank my supervisor Peter Rehling for the opportunity to work in such an interesting and challenging field, for his relentless support throughout the project and his patience with me. -

Supplementary Materials (PDF)
Proteomics of the mediodorsal thalamic nucleus in gastric ulcer induced by restraint-water-immersion-stress Sheng-Nan Gong, Jian-Ping Zhu, Ying-Jie Ma, Dong-Qin Zhao Table S1. The entire list of 2,853 proteins identified between the control and stressed groups Protein NO Protein name Gene name Accession No LogRatio 1 Tubulin alpha-1A chain Tuba1a TBA1A_RAT 0.2320 2 Spectrin alpha chain, non-erythrocytic 1 Sptan1 A0A0G2JZ69_RAT -0.0291 3 ATP synthase subunit alpha, mitochondrial Atp5f1a ATPA_RAT -0.1155 4 Tubulin beta-2B chain Tubb2b TBB2B_RAT 0.0072 5 Actin, cytoplasmic 2 Actg1 ACTG_RAT 0.0001 Sodium/potassium-transporting ATPase Atp1a2 6 subunit alpha-2 AT1A2_RAT -0.0716 7 Spectrin beta chain Sptbn1 A0A0G2K8W9_RAT -0.1158 8 Clathrin heavy chain 1 Cltc CLH1_RAT 0.0788 9 Dihydropyrimidinase-related protein 2 Dpysl2 DPYL2_RAT -0.0696 10 Glyceraldehyde-3-phosphate dehydrogenase Gapdh G3P_RAT -0.0687 Sodium/potassium-transporting ATPase Atp1a3 11 subunit alpha-3 AT1A3_RAT 0.0391 12 ATP synthase subunit beta, mitochondrial Atp5f1b ATPB_RAT 0.1772 13 Cytoplasmic dynein 1 heavy chain 1 Dync1h1 M0R9X8_RAT 0.0527 14 Myelin basic protein transcript variant N Mbp I7EFB0_RAT 0.0696 15 Microtubule-associated protein Map2 F1LNK0_RAT -0.1053 16 Pyruvate kinase PKM Pkm KPYM_RAT -0.2608 17 D3ZQQ5_RAT 0.0087 18 Plectin Plec F7F9U6_RAT -0.0076 19 14-3-3 protein zeta/delta Ywhaz A0A0G2JV65_RAT -0.2431 20 2',3'-cyclic-nucleotide 3'-phosphodiesterase Cnp CN37_RAT -0.0495 21 Creatine kinase B-type Ckb KCRB_RAT -0.0514 Voltage-dependent anion-selective channel -

The Intra-Mitochondrial O-Glcnacylation System Acutely Regulates OXPHOS Capacity and ROS Dynamics in the Heart
The intra-mitochondrial O-GlcNAcylation system acutely regulates OXPHOS capacity and ROS dynamics in the heart Justine Dontaine Asma Bouali Frederic Daussin Laurent Bultot https://orcid.org/0000-0002-5088-0101 Didier Vertommen Manon Martin Rahulan Rathagirishnan Alexanne Cuillerier University of Ottawa Sandrine Horman Christophe Beauloye Université catholique de Louvain, Institut de Recherche Expérimentale et Clinique Laurent Gatto UCLouvain https://orcid.org/0000-0002-1520-2268 Benjamin Lauzier Luc Bertrand https://orcid.org/0000-0003-0655-7099 Yan Burelle ( [email protected] ) University of Ottawa https://orcid.org/0000-0001-9379-146X Article Keywords: O-GlcNAcylation, OXPHOS capacity, cellular regulatory mechanism Posted Date: July 19th, 2021 DOI: https://doi.org/10.21203/rs.3.rs-690671/v1 License: This work is licensed under a Creative Commons Attribution 4.0 International License. Read Full License 1 THE INTRA-MITOCHONDRIAL O-GLCNACYLATION SYSTEM ACUTELY 2 REGULATES OXPHOS CAPACITY AND ROS DYNAMICS IN THE HEART. 3 4 Justine Dontaine1, A. Bouali2, F. Daussin3, L. Bultot1, D. Vertommen4, M. Martin5, R. 5 Rathagirishnan2, A. Cuillerier6, S. Horman1, C. Beauloye1,7, L. Gatto5, B. Lauzier8, L. Bertrand1,9*, 6 Y. Burelle2,6* 7 1Pole of cardiovascular research (CARD), Institute of Experimental and Clinical Research (IREC), UCLouvain, 8 Brussels, Belgium 9 2Interdisciplinary School of Health Sciences, Faculty of Health Sciences, University of Ottawa, Ottawa, ON, Canada 10 3Univ. Lille, Univ. Artois, Univ. Littoral Côte d’Opale, ULR 7369 -

Mitochondrial Complex V Deficiency
Mitochondrial complex V deficiency Description Mitochondrial complex V deficiency is a shortage (deficiency) of a protein complex called complex V or a loss of its function. Complex V is found in cell structures called mitochondria, which convert the energy from food into a form that cells can use. Complex V is the last of five mitochondrial complexes that carry out a multistep process called oxidative phosphorylation, through which cells derive much of their energy. Mitochondrial complex V deficiency can cause a wide variety of signs and symptoms affecting many organs and systems of the body, particularly the nervous system and the heart. The disorder can be life-threatening in infancy or early childhood. Affected individuals may have feeding problems, slow growth, low muscle tone (hypotonia), extreme fatigue (lethargy), and developmental delay. They tend to develop elevated levels of lactic acid in the blood (lactic acidosis), which can cause nausea, vomiting, weakness, and rapid breathing. High levels of ammonia in the blood (hyperammonemia) can also occur in affected individuals, and in some cases result in abnormal brain function (encephalopathy) and damage to other organs. Another common feature of mitochondrial complex V deficiency is hypertrophic cardiomyopathy. This condition is characterized by thickening (hypertrophy) of the heart (cardiac) muscle that can lead to heart failure. People with mitochondrial complex V deficiency may also have a characteristic pattern of facial features, including a high forehead, curved eyebrows, outside corners of the eyes that point downward ( downslanting palpebral fissures), a prominent bridge of the nose, low-set ears, thin lips, and a small chin (micrognathia). -

Mitochondrial Structure and Bioenergetics in Normal and Disease Conditions
International Journal of Molecular Sciences Review Mitochondrial Structure and Bioenergetics in Normal and Disease Conditions Margherita Protasoni 1 and Massimo Zeviani 1,2,* 1 Mitochondrial Biology Unit, The MRC and University of Cambridge, Cambridge CB2 0XY, UK; [email protected] 2 Department of Neurosciences, University of Padova, 35128 Padova, Italy * Correspondence: [email protected] Abstract: Mitochondria are ubiquitous intracellular organelles found in almost all eukaryotes and involved in various aspects of cellular life, with a primary role in energy production. The interest in this organelle has grown stronger with the discovery of their link to various pathologies, including cancer, aging and neurodegenerative diseases. Indeed, dysfunctional mitochondria cannot provide the required energy to tissues with a high-energy demand, such as heart, brain and muscles, leading to a large spectrum of clinical phenotypes. Mitochondrial defects are at the origin of a group of clinically heterogeneous pathologies, called mitochondrial diseases, with an incidence of 1 in 5000 live births. Primary mitochondrial diseases are associated with genetic mutations both in nuclear and mitochondrial DNA (mtDNA), affecting genes involved in every aspect of the organelle function. As a consequence, it is difficult to find a common cause for mitochondrial diseases and, subsequently, to offer a precise clinical definition of the pathology. Moreover, the complexity of this condition makes it challenging to identify possible therapies or drug targets. Keywords: ATP production; biogenesis of the respiratory chain; mitochondrial disease; mi-tochondrial electrochemical gradient; mitochondrial potential; mitochondrial proton pumping; mitochondrial respiratory chain; oxidative phosphorylation; respiratory complex; respiratory supercomplex Citation: Protasoni, M.; Zeviani, M.