Vol. 4 2008 Impressum
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Checklist of British and Irish Hymenoptera - Cynipoidea
Biodiversity Data Journal 5: e8049 doi: 10.3897/BDJ.5.e8049 Taxonomic Paper Checklist of British and Irish Hymenoptera - Cynipoidea Mattias Forshage‡, Jeremy Bowdrey§, Gavin R. Broad |, Brian M. Spooner¶, Frank van Veen# ‡ Swedish Museum of Natural History, Stockholm, Sweden § Colchester and Ipswich Museums, Colchester, United Kingdom | The Natural History Museum, London, United Kingdom ¶ Royal Botanic Gardens, Kew, Richmond, United Kingdom # University of Exeter, Penryn, United Kingdom Corresponding author: Gavin R. Broad ([email protected]) Academic editor: Pavel Stoev Received: 05 Feb 2016 | Accepted: 06 Mar 2017 | Published: 09 Mar 2017 Citation: Forshage M, Bowdrey J, Broad G, Spooner B, van Veen F (2017) Checklist of British and Irish Hymenoptera - Cynipoidea. Biodiversity Data Journal 5: e8049. https://doi.org/10.3897/BDJ.5.e8049 Abstract Background The British and Irish checklist of Cynipoidea is revised, considerably updating the last complete checklist published in 1978. Disregarding uncertain identifications, 220 species are now known from Britain and Ireland, comprising 91 Cynipidae (including two established non-natives), 127 Figitidae and two Ibaliidae. New information One replacement name is proposed, Kleidotoma thomsoni Forshage, for the secondary homonym Kleidotoma tetratoma Thomson, 1861 (nec K. tetratoma (Hartig, 1841)). © Forshage M et al. This is an open access article distributed under the terms of the Creative Commons Attribution License (CC BY 4.0), which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited. 2 Forshage M et al Introduction This paper continues the series of updated British and Irish Hymenoptera checklists that started with Broad and Livermore (2014a), Broad and Livermore (2014b), Liston et al. -
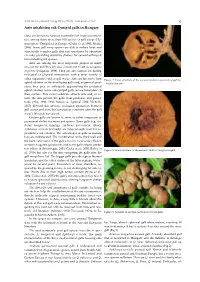
Ants Inhabiting Oak Cynipid Galls in Hungary
North-Western Journal of Zoology 2020, vol.16 (1) - Correspondence: Notes 95 Ants inhabiting oak Cynipid galls in Hungary Oaks are known to harbour extremely rich insect communi- ties, among them more than 100 species of gall wasps (Hy- menoptera: Cynipidae) in Europe (Csóka et al. 2005, Melika 2006). Some gall wasp species are able to induce large and structurally complex galls that can sometimes be abundant on oaks, providing attractive shelters for several arthropod taxa including ant species. Ants are among the most important players in many ecosystems and they are also considered to act as ecosystem engineers (Folgarait, 1998). They are also famous for having ecological or physical interactions with a great variety of other organisms, such as gall wasps. Ants are known to tend Figure 1. Inner structure of the asexual Andricus quercustozae gall in- aphid colonies on the developing galls and, as general pred- habited by ants. ators, they prey on arthropods approaching the protected aphid colonies. Some oak cynipid galls secrete honeydew on their surface. This sweet substrate attracts ants and, in re- turn, the ants protect the galls from predators and parasi- toids (Abe, 1988, 1992; Inouye & Agrawal 2004; Nicholls, 2017). Beyond this obvious ecological interaction between gall wasps and ants, this association continues after the gall wasp’s life cycle has ceased. Certain galls are known to serve as either temporary or permanent shelter for many ant species. Some galls (e.g. An- dricus hungaricus (Hartig), Andricus quercustozae (Bosc), Aphelonyx cerricola (Giraud)) are large enough even for re- productive ant colonies. The advantages of galls as nesting logs are multifaceted. -

Taxonomic Notes and Type Designations of Gall Inducing Cynipid Wasps Described by G.Mayr (Insecta: Hymenoptera: Cynipidae)
ZOBODAT - www.zobodat.at Zoologisch-Botanische Datenbank/Zoological-Botanical Database Digitale Literatur/Digital Literature Zeitschrift/Journal: Annalen des Naturhistorischen Museums in Wien Jahr/Year: 2001 Band/Volume: 103B Autor(en)/Author(s): Bechtold M., Melika George Artikel/Article: Taxonomic notes and type designations of gall inducing cynipid wasps described by G.Mayr (Insecta: Hymenoptera: Cynipidae). 327-339 ©Naturhistorisches Museum Wien, download unter www.biologiezentrum.at Ann. Naturhist. Mus. Wien 103 B 327 - 339 Wien, Dezember 2001 Taxonomic notes and type designations of gall inducing cynipid wasps described by G. Mayr (Insecta: Hymenoptera: Cynipidae) G. Melika & M. Bechtold* Abstract Lectotypes for twelve of Mayr's cynipid gall wasp species (Hymenoptera: Cynipidae: Cynipinae) are desi- gnated. From twenty cynipid gall wasp species, described by Mayr, seven have already been synonymized, and thirteen species are still valid. Andricus insana (WESTWOOD, 1837) syn.n. is a new synonym of Andricus quercustozae (Bosc, 1792). Key words: Cynipidae, gall wasps, Hymenoptera, lectotype designation, Gustav Mayr, new synonymy, taxonomy. Zusammenfassung Lectotypen für zwölf der von Mayr beschriebenen Gallwespenarten (Hymenoptera: Cynipidae: Cynipinae) werden designiert. Mayr hat zwanzig Gallwespenarten beschrieben, davon sind sieben bereits synonymi- siert worden, dreizehn Arten sind noch gültig. Andricus insana (WESTWOOD, 1837) syn.n. ist ein neues Synonym von Andricus quercustozae (Bosc, 1792). Introduction Gustav Mayr, a famous Austrian entomologist, described eleven genera of gall inducing Cynipidae and twenty species from twelve genera (Hymenoptera: Cynipoidea). Seven of them have already been synonymized, while thirteen species are still valid. However, he never designated types for his newly described species. All the specimens are syn- or cotypes and usually these specimens were marked with "Type" or even not so. -

National Oak Gall Wasp Survey
ational Oak Gall Wasp Survey – mapping with parabiologists in Finland Bess Hardwick Table of Contents 1. Introduction ................................................................................................................. 2 1.1. Parabiologists in data collecting ............................................................................. 2 1.2. Oak cynipid gall wasps .......................................................................................... 3 1.3. Motivations and objectives .................................................................................... 4 2. Material and methods ................................................................................................ 5 2.1. The volunteers ........................................................................................................ 5 2.2. Sampling ................................................................................................................. 6 2.3. Processing of samples ............................................................................................ 7 2.4. Data selection ........................................................................................................ 7 2.5. Statistical analyses ................................................................................................. 9 3. Results ....................................................................................................................... 10 3.1. Sampling success ................................................................................................. -

The Population Biology of Oak Gall Wasps (Hymenoptera:Cynipidae)
5 Nov 2001 10:11 AR AR147-21.tex AR147-21.SGM ARv2(2001/05/10) P1: GSR Annu. Rev. Entomol. 2002. 47:633–68 Copyright c 2002 by Annual Reviews. All rights reserved THE POPULATION BIOLOGY OF OAK GALL WASPS (HYMENOPTERA:CYNIPIDAE) Graham N. Stone,1 Karsten Schonrogge,¨ 2 Rachel J. Atkinson,3 David Bellido,4 and Juli Pujade-Villar4 1Institute of Cell, Animal, and Population Biology, University of Edinburgh, The King’s Buildings, West Mains Road, Edinburgh EH9 3JT, United Kingdom; e-mail: [email protected] 2Center of Ecology and Hydrology, CEH Dorset, Winfrith Technology Center, Winfrith Newburgh, Dorchester, Dorset DT2 8ZD, United Kingdom; e-mail: [email protected] 3Center for Conservation Science, Department of Biology, University of Stirling, Stirling FK9 4LA, United Kingdom; e-mail: [email protected] 4Departamento de Biologia Animal, Facultat de Biologia, Universitat de Barcelona, Avenida Diagonal 645, 08028 Barcelona, Spain; e-mail: [email protected] Key Words cyclical parthenogenesis, host alternation, food web, parasitoid, population dynamics ■ Abstract Oak gall wasps (Hymenoptera: Cynipidae, Cynipini) are characterized by possession of complex cyclically parthenogenetic life cycles and the ability to induce a wide diversity of highly complex species- and generation-specific galls on oaks and other Fagaceae. The galls support species-rich, closed communities of inquilines and parasitoids that have become a model system in community ecology. We review recent advances in the ecology of oak cynipids, with particular emphasis on life cycle characteristics and the dynamics of the interactions between host plants, gall wasps, and natural enemies. We assess the importance of gall traits in structuring oak cynipid communities and summarize the evidence for bottom-up and top-down effects across trophic levels. -

Contents Hawthorn Dene, 1, 5-Jul-1924
Northern Naturalists’ Union Field Meeting Reports- 1924-2005 Contents Hawthorn Dene, 1, 5-jul-1924 .............................. 10 Billingham Marsh, 2, 13-jun-1925 ......................... 13 Sweethope Lough, 3, 11-jul-1925 ........................ 18 The Sneap, 4, 12-jun-1926 ................................... 24 Great Ayton, 5, 18-jun-1927 ................................. 28 Gibside, 6, 23-jul-1927 ......................................... 28 Langdon Beck, 7, 9-jun-1928 ............................... 29 Hawthorn Dene, 8, 5-jul-1928 .............................. 33 Frosterley, 9 ......................................................... 38 The Sneap, 10, 1-jun-1929 ................................... 38 Allenheads, 11, 6-july-1929 .................................. 43 Dryderdale, 12, 14-jun-1930 ................................. 46 Blanchland, 13, 12-jul-1930 .................................. 49 Devil's Water, 14, 15-jun-1931 ............................. 52 Egglestone, 15, 11-jul-1931 ................................. 53 Windlestone Park, 16, June? ............................... 55 Edmondbyers, 17, 16-jul-1932 ............................. 57 Stanhope and Frosterley, 18, 5-jun-1932 ............. 58 The Sneap, 19, 15-jul-1933 .................................. 61 Pigdon Banks, 20, 1-jun-1934 .............................. 62 Greatham Marsh, 21, 21-jul-1934 ........................ 64 Blanchland, 22, 15-jun-1935 ................................ 66 Dryderdale, 23, ..................................................... 68 Raby Park, -

Folk Taxonomy, Nomenclature, Medicinal and Other Uses, Folklore, and Nature Conservation Viktor Ulicsni1* , Ingvar Svanberg2 and Zsolt Molnár3
Ulicsni et al. Journal of Ethnobiology and Ethnomedicine (2016) 12:47 DOI 10.1186/s13002-016-0118-7 RESEARCH Open Access Folk knowledge of invertebrates in Central Europe - folk taxonomy, nomenclature, medicinal and other uses, folklore, and nature conservation Viktor Ulicsni1* , Ingvar Svanberg2 and Zsolt Molnár3 Abstract Background: There is scarce information about European folk knowledge of wild invertebrate fauna. We have documented such folk knowledge in three regions, in Romania, Slovakia and Croatia. We provide a list of folk taxa, and discuss folk biological classification and nomenclature, salient features, uses, related proverbs and sayings, and conservation. Methods: We collected data among Hungarian-speaking people practising small-scale, traditional agriculture. We studied “all” invertebrate species (species groups) potentially occurring in the vicinity of the settlements. We used photos, held semi-structured interviews, and conducted picture sorting. Results: We documented 208 invertebrate folk taxa. Many species were known which have, to our knowledge, no economic significance. 36 % of the species were known to at least half of the informants. Knowledge reliability was high, although informants were sometimes prone to exaggeration. 93 % of folk taxa had their own individual names, and 90 % of the taxa were embedded in the folk taxonomy. Twenty four species were of direct use to humans (4 medicinal, 5 consumed, 11 as bait, 2 as playthings). Completely new was the discovery that the honey stomachs of black-coloured carpenter bees (Xylocopa violacea, X. valga)were consumed. 30 taxa were associated with a proverb or used for weather forecasting, or predicting harvests. Conscious ideas about conserving invertebrates only occurred with a few taxa, but informants would generally refrain from harming firebugs (Pyrrhocoris apterus), field crickets (Gryllus campestris) and most butterflies. -

Rozprawy Nr 167
UNIWERSYTET TECHNOLOGICZNO-PRZYRODNICZY IM. JANA I JÊDRZEJA ŒNIADECKICH W BYDGOSZCZY ROZPRAWY NR 167 Danuta Wrzesiñska FOLIOFAGI TWORZ¥CE WYROŒLA NA Quercus robur (LINNAEUS) BYDGOSZCZ – 2013 REDAKTOR NACZELNY prof. dr hab. in¿. Józef Flizikowski REDAKTOR DZIA£OWY prof. dr hab. in¿. Ma³gorzata Zalewska OPINIODAWCY prof. dr hab. Gabriel £abanowski prof. dr hab. Henryk Malinowski OPRACOWANIE REDAKCYJNE I TECHNICZNE mgr Aleksandra Górska, mgr in¿. Tomasz Sza³ajda © Copyright Wydawnictwa Uczelniane Uniwersytetu Technologiczno-Przyrodniczego Bydgoszcz 2013 Utwór w ca³oœci ani we fragmentach nie mo¿e byæ powielany ani rozpowszechniany za pomoc¹ urz¹dzeñ elektronicznych, mechanicznych, kopiuj¹cych, nagrywaj¹cych i innych bez pisemnej zgody posiadacza praw autorskich. ISBN 978-83-61314-79-0 ISSN 0209-0597 Wydawnictwa Uczelniane Uniwersytetu Technologiczno-Przyrodniczego ul. Ks. A. Kordeckiego 20, 85-225 Bydgoszcz, tel. 52 3749482, 3749426 e-mail: [email protected] http://www.wu.utp.edu.pl Wyd. I. Nak³ad 86 egz. Ark. aut. 6,0. Ark. druk. 6,5. Zamówienie nr 10/2013 Oddano do druku i druk ukoñczono w czerwcu 2013 Uczelniany Zak³ad Ma³ej Poligrafii UTP Bydgoszcz, ul. Ks. A. Kordeckiego 20 SPIS TREŚCI 1. WSTĘP I CEL BADAŃ ........................................................................ 5 2. PRZEGLĄD LITERATURY ................................................................ 7 2.1. Fauna tworząca galasy na drzewach liściastych ................................................. 7 2.2. Fauna tworząca galasy na Quercus robur ............................................ -

Community Level Consequences of Adaptive Management Through Climate Matching: Oak Galls As a Model System
Community level consequences of adaptive management through Climate Matching: oak galls as a model system Frazer H. Sinclair Submitted for the degree of Doctor of Philosophy University of Edinburgh 2011 1 Declaration This thesis is submitted to the University of Edinburgh in accordance with the requirements for the degree of Doctor of Philosophy in the College of Science and Engineering. Aspects of the presented work were made possible by collaboration and data sharing with individuals and institutions, details of which are presented below. Chapter 2. The French National Institute for Agricultural Research (INRA) provided various phenotypic and genotypic data from oak provenance trials that are under their management. All presented analyses of these data are my own. Chapter 3. INRA allowed access to their established oak provenance trial at the forest of Petite Charnie in Sarthe, Northwest France. Insect surveys at the trial were conducted by me, and by volunteers under my supervision. All presented analyses of these data are my own. Chapter 4. Insect specimens were collected by me from the oak provenance trial at Petite Charnie with the permission of INRA. Approximately 1/3 of DNA extractions and PCR reactions were conducted by Konrad Lohse, Julja Ernst, and Juan Carlos Ruiz Guajardo. All presented analyses are my own. Chapter 5. Insect specimens were sourced from the Stone laboratory collections at the University of Edinburgh. Unpublished DNA sequence data from 6 parasitoid individuals were provided by Konrad Lohse. All presented analysis of this data is my own. Unless otherwise stated, the remaining work and content of this thesis are entirely my own. -

Torymus Sinensis Against the Chestnut Gall Wasp Dryocosmus Kuriphilus in the Canton Ticino, Switzerland
| January 2011 Evaluating the use of Torymus sinensis against the chestnut gall wasp Dryocosmus kuriphilus in the Canton Ticino, Switzerland Authors Aebi Alexandre, Agroscope ART Schoenenberger Nicola, Tulum SA and Bigler Franz, Agroscope ART Torymus sinensis against the chestnut gall wasp Dryocosmus kuriphilus | January 2011 1 Zürich/Caslano, January 2011 Authors’ affiliation: Alexandre Aebi and Franz Bigler Nicola Schoenenberger Agroscope Reckenholz-Tänikon TULUM SA Research Station ART Via Rompada 40 Biosafety 6987 Caslano Reckenholzstrasse 191 Switzerland 8046 Zürich Tel: +41 91 606 6373 Switzerland Fax: +41 44 606 6376 Tel: +41 44 377 7669 [email protected] Fax: +41 44 377 7201 [email protected] This work was financed by the Swiss Federal Office for the Environment (FOEN) This work was done in collaboration with B. Bellosi and E. Schaltegger (TULUM SA) Cover figure: Empty chestnut gall in Stabio, February 2010 (Picture:TULUM SA) All maps used in figures and appendices (except Fig. 6): ©swisstopo, license number: DV053809.1 Map in figure 6: © Istituto Geografico, De Agostini 1982–1988 ISBN 978-3-905733-20-4 © 2010 ART 2 Torymus sinensis against the chestnut gall wasp Dryocosmus kuriphilus | January 2011 Table of contents Table of contents Abstract 5 1. Introduction 6 2. Mission and methods 7 3. Presence and degree of infestation of Dryocosmus kuriphilus in Switzerland 9 4. Invasion corridors of Dryocosmus kuriphilus towards Switzerland 11 5. Potential economic and ecological damage caused by Dryocosmus kuriphilus in Switzerland 14 6. Release of the parasitoid Torymus sinensis in the Piedmont Region, Italy 17 7. Potential benefits and damage due to the release of Torymus sinensis 18 8. -

Hymenoptera: Cynipidae) in Turkey
EUROPEAN JOURNAL OF ENTOMOLOGYENTOMOLOGY ISSN (online): 1802-8829 Eur. J. Entomol. 116: 141–157, 2019 http://www.eje.cz doi: 10.14411/eje.2019.016 ORIGINAL ARTICLE Tracing imprints of past climatic fl uctuations and heterogeneous topography in Cynips quercusfolii (Hymenoptera: Cynipidae) in Turkey SERDAR DİNÇ and SERAP MUTUN Department of Biology, Faculty of Science and Art, Bolu Abant İzzet Baysal University, Bolu, 14030, Turkey; e-mails: [email protected], [email protected] Key words. Hymenoptera, Cynipidae, Cynips quercusfolii, oak gall wasp, cyt b, ITS2, phylogeography, Pleistocene, Turkey Abstract. Cynips quercusfolii is an oak gall wasp species distributed across the western Palearctic region. In this study, C. quercusfolii adults were used to investigate the possible effects of past climatic fl uctuations and topography on the genetic structure of this species in Turkey. For this, the partial mitochondrial DNA (mtDNA) cytochrome b gene (cyt b) and nuclear DNA (nDNA) ITS2 region of 294 individuals from 38 populations covering the distribution of this species in Turkey were sequenced. The sequences generated 125 mtDNA haplotypes and 30 nDNA alleles. High variation was revealed in Turkish populations of C. quercusfolii (h = 0.7328 and π = 0.0102 for cyt b, and h = 0.5865 and π = 0.0058 for ITS2). Demographic analyses and high haplotype versus low nucleotide diversity indicated that C. quercusfolii populations might have undergone a series of expansions and contractions in the past. Phylogenetic analyses showed that this species is structured geographically between east and west due to a major physical barrier, the Anatolian Diagonal. Furthermore, divergence times of the lineages implied that deep splits oc- curred before the Pleistocene, while intermediate to shallow splits were associated with climatic changes during the Pleistocene. -

Oak Gall Wasps of Ukraine (Hymenoptera: Cynipidae, Cynipini)
Науковий вісник Ужгородського університету Серія Біологія, Випуск 4 4 (201 8 ): 39 – 54 ©. Melika G. , 2018 DOI: 10.24144/1998 - 6475.2018.44. 39 - 54 OAK GALL WASPS OF UKRAINE (HYMENOPTERA: CYNIPIDAE, CYNIPINI) Melika G . Oak gallwasps of Ukraine (Hymenoptera: Cynipidae, Cynipini). – G eorge Melika – Cynipid gallwasps (Hymenoptera: Cynipidae) comprise 1 , 364 species worldwide, predominantly in temperate regions of the Holarctic. The vast majority of recorded species are from the Nearctic and the Western Palaearcti c. The most species - rich tribe is the oak gallwasps (Cynipini) with 158 described species from the Western Palaearctic, which from 116 species are known from Europe. In the present paper we summarise the current knowledge of oak gallwasps (Cynipini) of Ukr aine, and list a total of 79 species. Keywords: a sexual generation, s exual generation, d istribution, l ifecycle, p henology, Quercus. Address: Plant Health Diagnostic National Reference Laboratory, National Food Chain Safety Office, Budaörsi u. 141 - 145, 1118 Budapest, Hungary ; e - mail: [email protected] Дубові горіхотворки України (Hymenoptera: Cynipidae, Cynipini). – Жорж Меліка . – С вітов а Фауна горіхотворок (Hymenoptera: Cynipidae) налічу є 1364 вид и , що поширені здебільшого у помірних регіонах Голарктики. Переважна більшість видів описані з Н еарктики та Західної Палеарктики. Найбільш е видове багатство характерне для триби дубових горіхотворок (Cynipini) , що є самою великою за кількістью видів групою родини з приблизно 1000 відомими видами світо вої фауни з 40 родів. З них 158 видів описан і і з Західної Палеарктики , а для Європи відомі 116 видів. Більшість з них формують гали на дубах (Quercus L. spp.). У даній роботі підсумов ано сучасні відомості про поширення дубових горіхотворок (Cynipini) України , та загалом нав едено 79 видів для її території.