Interaktionen Zwischen Wirten Und Parasitoiden
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-
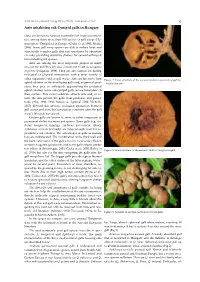
Ants Inhabiting Oak Cynipid Galls in Hungary
North-Western Journal of Zoology 2020, vol.16 (1) - Correspondence: Notes 95 Ants inhabiting oak Cynipid galls in Hungary Oaks are known to harbour extremely rich insect communi- ties, among them more than 100 species of gall wasps (Hy- menoptera: Cynipidae) in Europe (Csóka et al. 2005, Melika 2006). Some gall wasp species are able to induce large and structurally complex galls that can sometimes be abundant on oaks, providing attractive shelters for several arthropod taxa including ant species. Ants are among the most important players in many ecosystems and they are also considered to act as ecosystem engineers (Folgarait, 1998). They are also famous for having ecological or physical interactions with a great variety of other organisms, such as gall wasps. Ants are known to tend Figure 1. Inner structure of the asexual Andricus quercustozae gall in- aphid colonies on the developing galls and, as general pred- habited by ants. ators, they prey on arthropods approaching the protected aphid colonies. Some oak cynipid galls secrete honeydew on their surface. This sweet substrate attracts ants and, in re- turn, the ants protect the galls from predators and parasi- toids (Abe, 1988, 1992; Inouye & Agrawal 2004; Nicholls, 2017). Beyond this obvious ecological interaction between gall wasps and ants, this association continues after the gall wasp’s life cycle has ceased. Certain galls are known to serve as either temporary or permanent shelter for many ant species. Some galls (e.g. An- dricus hungaricus (Hartig), Andricus quercustozae (Bosc), Aphelonyx cerricola (Giraud)) are large enough even for re- productive ant colonies. The advantages of galls as nesting logs are multifaceted. -

The Population Biology of Oak Gall Wasps (Hymenoptera:Cynipidae)
5 Nov 2001 10:11 AR AR147-21.tex AR147-21.SGM ARv2(2001/05/10) P1: GSR Annu. Rev. Entomol. 2002. 47:633–68 Copyright c 2002 by Annual Reviews. All rights reserved THE POPULATION BIOLOGY OF OAK GALL WASPS (HYMENOPTERA:CYNIPIDAE) Graham N. Stone,1 Karsten Schonrogge,¨ 2 Rachel J. Atkinson,3 David Bellido,4 and Juli Pujade-Villar4 1Institute of Cell, Animal, and Population Biology, University of Edinburgh, The King’s Buildings, West Mains Road, Edinburgh EH9 3JT, United Kingdom; e-mail: [email protected] 2Center of Ecology and Hydrology, CEH Dorset, Winfrith Technology Center, Winfrith Newburgh, Dorchester, Dorset DT2 8ZD, United Kingdom; e-mail: [email protected] 3Center for Conservation Science, Department of Biology, University of Stirling, Stirling FK9 4LA, United Kingdom; e-mail: [email protected] 4Departamento de Biologia Animal, Facultat de Biologia, Universitat de Barcelona, Avenida Diagonal 645, 08028 Barcelona, Spain; e-mail: [email protected] Key Words cyclical parthenogenesis, host alternation, food web, parasitoid, population dynamics ■ Abstract Oak gall wasps (Hymenoptera: Cynipidae, Cynipini) are characterized by possession of complex cyclically parthenogenetic life cycles and the ability to induce a wide diversity of highly complex species- and generation-specific galls on oaks and other Fagaceae. The galls support species-rich, closed communities of inquilines and parasitoids that have become a model system in community ecology. We review recent advances in the ecology of oak cynipids, with particular emphasis on life cycle characteristics and the dynamics of the interactions between host plants, gall wasps, and natural enemies. We assess the importance of gall traits in structuring oak cynipid communities and summarize the evidence for bottom-up and top-down effects across trophic levels. -

Contents Hawthorn Dene, 1, 5-Jul-1924
Northern Naturalists’ Union Field Meeting Reports- 1924-2005 Contents Hawthorn Dene, 1, 5-jul-1924 .............................. 10 Billingham Marsh, 2, 13-jun-1925 ......................... 13 Sweethope Lough, 3, 11-jul-1925 ........................ 18 The Sneap, 4, 12-jun-1926 ................................... 24 Great Ayton, 5, 18-jun-1927 ................................. 28 Gibside, 6, 23-jul-1927 ......................................... 28 Langdon Beck, 7, 9-jun-1928 ............................... 29 Hawthorn Dene, 8, 5-jul-1928 .............................. 33 Frosterley, 9 ......................................................... 38 The Sneap, 10, 1-jun-1929 ................................... 38 Allenheads, 11, 6-july-1929 .................................. 43 Dryderdale, 12, 14-jun-1930 ................................. 46 Blanchland, 13, 12-jul-1930 .................................. 49 Devil's Water, 14, 15-jun-1931 ............................. 52 Egglestone, 15, 11-jul-1931 ................................. 53 Windlestone Park, 16, June? ............................... 55 Edmondbyers, 17, 16-jul-1932 ............................. 57 Stanhope and Frosterley, 18, 5-jun-1932 ............. 58 The Sneap, 19, 15-jul-1933 .................................. 61 Pigdon Banks, 20, 1-jun-1934 .............................. 62 Greatham Marsh, 21, 21-jul-1934 ........................ 64 Blanchland, 22, 15-jun-1935 ................................ 66 Dryderdale, 23, ..................................................... 68 Raby Park, -

VII Conference of the European Wildlife Diseases Association VII
VII Conference of the European Wildlife Diseases Association 27thth-30thth September 2006 Aosta Valley, ITALY Contents Welcome 3 Conference programme 5 Abstracts Oral Presentations 13 Poster Presentations 37 Conference Committee 79 Index by Authors 85 List of Participants 1 2 Welcome! On behalf of the Wildlife Diseases Association, the National Reference Centre for Wildlife Diseases (Ce.R.M.A.S.) and the Italian Society of Ecopathology (SIEF) we are happy to welcome you to S.Vincent and the 7th Conference of the European section of the Wildlife Diseases Association. The scientific programme is really varied and ranges from invertebrate to mammals. We have chosen some topics that are of great concern among professional and ordinary people, such as wildlife and emerging diseases, wildlife diseases and conservation, wildlife diseases monitoring and risk of disease transmission between wildlife and domestic animals. Data exchange and discussion are the goal of every scientific meeting. We hope our organization efforts will create a friendly and stimulating environment and allow all of us to increase not only our culture, but also our friendship. The front line of wildlife diseases research in Europe, but also from other continents, is presented in the more than 120, oral or poster, presentations. We can learn from them and increase our ability to preserve both wildlife and public health. We hope you will enjoy the conference and your stay in Italy! Ezio Ferroglio Riccardo Orusa SIEF Ce.R.M.A.S 3 4 Conference Programme 5 6 Conference Programme Wednesday 27th September 2006 14:30-15:30 Registration 15:30-18:00 Opening Ceremony 18:00 Welcome cocktail Thursday 28th September 2006 8:00-9:00 Registration “Wildlife Disease surveillance in Key Note Speaker 9:00-10:00 Europe“. -

Torymus Sinensis Against the Chestnut Gall Wasp Dryocosmus Kuriphilus in the Canton Ticino, Switzerland
| January 2011 Evaluating the use of Torymus sinensis against the chestnut gall wasp Dryocosmus kuriphilus in the Canton Ticino, Switzerland Authors Aebi Alexandre, Agroscope ART Schoenenberger Nicola, Tulum SA and Bigler Franz, Agroscope ART Torymus sinensis against the chestnut gall wasp Dryocosmus kuriphilus | January 2011 1 Zürich/Caslano, January 2011 Authors’ affiliation: Alexandre Aebi and Franz Bigler Nicola Schoenenberger Agroscope Reckenholz-Tänikon TULUM SA Research Station ART Via Rompada 40 Biosafety 6987 Caslano Reckenholzstrasse 191 Switzerland 8046 Zürich Tel: +41 91 606 6373 Switzerland Fax: +41 44 606 6376 Tel: +41 44 377 7669 [email protected] Fax: +41 44 377 7201 [email protected] This work was financed by the Swiss Federal Office for the Environment (FOEN) This work was done in collaboration with B. Bellosi and E. Schaltegger (TULUM SA) Cover figure: Empty chestnut gall in Stabio, February 2010 (Picture:TULUM SA) All maps used in figures and appendices (except Fig. 6): ©swisstopo, license number: DV053809.1 Map in figure 6: © Istituto Geografico, De Agostini 1982–1988 ISBN 978-3-905733-20-4 © 2010 ART 2 Torymus sinensis against the chestnut gall wasp Dryocosmus kuriphilus | January 2011 Table of contents Table of contents Abstract 5 1. Introduction 6 2. Mission and methods 7 3. Presence and degree of infestation of Dryocosmus kuriphilus in Switzerland 9 4. Invasion corridors of Dryocosmus kuriphilus towards Switzerland 11 5. Potential economic and ecological damage caused by Dryocosmus kuriphilus in Switzerland 14 6. Release of the parasitoid Torymus sinensis in the Piedmont Region, Italy 17 7. Potential benefits and damage due to the release of Torymus sinensis 18 8. -

A Revised Annotated Checklist of Louse Flies (Diptera, Hippoboscidae) from Slovakia
A peer-reviewed open-access journal ZooKeys 862: A129–152 revised (2019) annotated checklist of louse flies (Diptera, Hippoboscidae) from Slovakia 129 doi: 10.3897/zookeys.862.25992 RESEARCH ARTICLE http://zookeys.pensoft.net Launched to accelerate biodiversity research A revised annotated checklist of louse flies (Diptera, Hippoboscidae) from Slovakia Jozef Oboňa1, Oldřich Sychra2, Stanislav Greš3, Petr Heřman4, Peter Manko1, Jindřich Roháček5, Anna Šestáková6, Jan Šlapák7, Martin Hromada1,8 1 Laboratory and Museum of Evolutionary Ecology, Department of Ecology, Faculty of Humanities and Na- tural Sciences, University of Presov, 17. novembra 1, SK – 081 16 Prešov, Slovakia 2 Department of Biology and Wildlife Diseases, Faculty of Veterinary Hygiene and Ecology, University of Veterinary and Pharmaceutical Sciences Brno, Palackého tř. 1946/1, CZ – 612 42 Brno, Czech Republic 3 17. novembra 24, SK – 083 01 Sabinov, Slovakia 4 Křivoklát 190, CZ – 270 23, Czech Republic 5 Department of Entomology, Silesian Museum, Tyršova 1, CZ-746 01 Opava, Czech Republic 6 The Western Slovakia Museum, Múzejné námestie 3, SK – 918 09 Trnava, Slovakia 7 Vojtaššákova 592, SK – 027 44 Tvrdošín, Slovakia 8 Faculty of Biological Sciences, University of Zielona Gora, Prof. Z. Szafrana 1, 65–516 Zielona Gora, Poland Corresponding author: Jozef Oboňa ([email protected]) Academic editor: Pierfilippo Cerretti | Received 4 June 2018 | Accepted 22 April 2019 | Published 9 July 2019 http://zoobank.org/00FA6B5D-78EF-4618-93AC-716D1D9CC360 Citation: Oboňa J, Sychra O, Greš S, Heřman P, Manko P, Roháček J, Šestáková A, Šlapák J, Hromada M (2019) A revised annotated checklist of louse flies (Diptera, Hippoboscidae) from Slovakia. ZooKeys 862: 129–152.https://doi. -

The Entomologist's Record and Journal of Variation
. JVASV^iX ^ N^ {/) lSNrNVIN0SHilWS*^S3ldVaan^LIBRARIES SMITHSONIAN INSTITUTION Ni <n - M ^^ <n 5 CO Z ^ ^ 2 ^—^ _j 2 -I RIES SMITHSONIAN INSTITUTION NOIinillSNI NVINOSHilWS S3iyVdan U r- ^ ^ 2 CD 4 A'^iitfwN r: > — w ? _ ISNI NVINOSHilWS SBiyVdan LIBRARIES'SMITHSONIAN INSTITUTION f^ <rt .... CO 2 2 2 s;- W to 2 C/J • 2 CO *^ 2 RIES SMITHSONIAN_INSTITUTlON NOIiniliSNI_NVINOSHilWS S3liiVyan_L; iiSNi"^NViNOSHiiNS S3iyvaan libraries smithsonian'^institution i^ 33 . z I/' ^ ^ (^ RIES SMITHSONIAN INSTITUTION NOIiniliSNI NVINOSHilWS S3lbVHan Li CO — -- — "> — IISNI NVINOSHimS S3IMVHan LIBRARIES SMITHSONIAN INSTITUTION N' 2 -J 2 _j 2 RIES SMITHSONIAN INSTITUTION NOIifllliSNI NVINOSHIIWS SSIMVyail L! MOTITI IT I f\t _NviN0SHiiws'^S3iMvaan libraries'^smithsonian^institution NOlin z \ '^ ^—s^ 5 <^ ^ ^ ^ '^ - /^w\ ^ /^^\ - ^^ ^ /^rf^\ - /^ o ^^^ — x.ii:i2Ji^ o ??'^ — \ii Z ^^^^^""-^ o ^^^^^ -» 2 _J Z -J , ; SMITHSONIAN INSTITUTION NOIXniliSNI NVINOSHillMS $3 I M VH 8 !!_ LI BR = C/> ± O) ^. ? CO I NVINOSHimS S3iaVHan libraries SMITHSONIAN INSTITUTION NOIlf CO ..-. CO 2 Z z . o .3 :/.^ C/)o Z u. ^^^ i to Z CO • z to * z > SMITHS0NIAN_1NSTITUTI0N NOIiniliSNI_NVINOSHimS S3 I d ViJ 8 n_LI B R UJ i"'NViNOSHiiws S3ibvyan libraries smithsonian"^institution Noiir r~ > z r- Z r- 2: . CO . ^ ^ ^ ^ ; SMITHSONIAN INSTITUTION NOIiniliSNI NVINOSHillNS SSiyVMail LI BR CO . •» Z r, <^ 2 z 5 ^^4ii?^^ ^' X^W o ^"^- x life ^<ji; o ^'f;0: i >^ _NVIN0SHiIlMs'^S3iyVdan^LIBRARIEs'^SMITHS0NlAN INSTITUTION NOlif Z \ ^'^ ^-rr-^ 5 CO n CO CO o z > SMITHSONIAN INSTITUTION NOIiniliSNI NVINOSHimS S3 I ^Vd 8 11 LI BR >" _ . z 3 ENTOMOLOGIST'S RECORD AND Journal of Variation Edited by P.A. SOKOLOFF fre s Assistant Editors J.A. -

Nistkästen Als Lebensraum Für Insekten, Besonders Fliegen Und Ihre Schlupfwespen
Vogelwarte 46, 2008: 195 – 205 © DO-G, IfV, MPG 2008 Nistkästen als Lebensraum für Insekten, besonders Fliegen und ihre Schlupfwespen Rudolf Abraham & Ralph S. Peters Abraham R & RS Peters 2008: Nestboxes as habitat for insects, especially for flies and their parasitoids. Vogelwarte 46: 195 – 205. The insect fauna from about 500 nest boxes was investigated after the birds had left the nests. The insects were collected out of the nest material or were captured with an emergence trap. All species found belong to the known guilds: Blood sucking parasites, saprophagous species, predators or parasitoids. The foodweb of the cyclorrhaphous flies and their parasitoids is shown as a part of the choriocoenosis in the nests. 32 species of 10 fly families were found. The bird blow fly Protocalliphora azurea (Calliphoridae) and its parasitoid Nasonia vitripennis (Pteromalidae) are nidicole species. The parasitoid kills about 40% of the blow fly puparia which is an advantage for the birds. A second blow fly P. falcozi was only found in Southern Germany. This species wraps most of the puparia with material of the nest which protects them from parasitism. The unwrapped puparia suffer a similar infestation as P. azurea. Two more parasitoids (Dibrachys cavus and D. lignicola, Pteromalidae) were found in the puparia of two tachinid flies (Triarthria setipennis and Ocytata pallipes) which are parasitoids of the common European earwig (Forficula auricularia, Forficulidae). The food chain earwig → tachinid fly →Dibrachys spp. belongs to another choriocoenosis which describes the fauna of the earwig shelters. It overlaps in the nest box with the choriocoenosis of the nidicole insects. -

Zoologische Mededelingen
ZOOLOGISCHE MEDEDELINGEN UITGEGEVEN DOOR HET RIJKSMUSEUM VAN NATUURLIJKE HISTORIE TE LEIDEN (MINISTERIE VAN CULTUUR, RECREATIE EN MAATSCHAPPELIJK WERK) Deel 53 no. 28 29 juni 1979 A CHARACTER ANALYSIS OF THE SPECIES OF SYNERGUS HARTIG, SECTION II (MAYR, 1872) (HYMENOPTERA, CYNIPIDAE) by A. A. WIEBES - RIJKS Afdeling Systematische Dierkunde der Rijksuniversiteit, Leiden With 83 text-figures ABSTRACT A survey is given of the characters used for the differentiation of the species of Synergus Hartig, classified with section II of Mayr. Special attention is given to the phenology of the species, for each of which the life-cycle is schematized, with differentia- tion in spring- and summer-generation. Two forms, provisionally indicated A and B, could not satisfactorily be identified with any of the known species. Sp. В is a common inquiline of oak-apples; biological observations were made on the larvae. Synergus mutabilis Deitmer, 1924, is synonymized with Synergus albipes Hartig, 1841. The identification of the species of Synergus Hartig, 1840, is notoriously difficult, particularly of those classified in section II (Mayr, 1872). The species of section I, single brooded, that winter in galls as late-stage larvae or pupae and emerge in early summer, are easier to be identified (Eady, 1952). Some of the difficulties with section II may stem from the fact that many species produce two broods in one year, often dissimilar in appearance (Ross, 1951). It should be stated that in all instances the correlations of spring and summer generations were deduced from circumstantial evidence: no specimens were actually reared from one generation to another. Even more confusing than the alternation of broods may be the great variation pre sumably caused by differences in quantity or quality of larval food. -

A Synopsis of Diptera Pupipara of Japan
Pacific Insects 9 (4): 727-760 20 November 1967 A SYNOPSIS OF DIPTERA PUPIPARA OF JAPAN By T. C. Maa2 Abstract. Diptera Pupipara previously recorded from Japan are briefly reviewed. Ap parently 7 or 8 of them have been wrongly or doubtfully included in the list for that country. Insofar as this group of flies is concerned, the Japanese fauna is about as rich as and bears strong similarity to that of entire Europe. Nycteribia oitaensis Miyake 1919 is here reduced to synonym of Penicillidia jenynsii Wwd. 1834, whereas Ornithomya aobatonis Matsum., degraded as a subspecies of O. avicularia Linn. New forms described are O. chloropus extensa, O. candida, Nycteribia allotopa mikado and Brachytarsina kanoi. Illustrated keys and a host-parasite index are provided. Records of a few species from Korea and Ryukyu Is. are incorporated. Thirteen nominal species of Diptera Pupipara have been described as new from Japan and her former territories by Matsumura (1905), Miyake (1919) and Kishida (1932). Their types have never been critically re-examined by any recent workers, their published de scriptions are brief and inadequate and these flies are rare in most Japanese collections. The interpretation of such species is therefore extremely difficult. The following notes are presented with the hope of raising the interests of local collectors and they serve as a continuation of my earlier papers (1962, 1963) to straighten out the synonymy. They are partly based upon available material and partly a guesswork of published descriptions. The entire list contains 34 species (Hippoboscidae, 21; Nycteribiidae, 10; Streblidae, 3). Eight of them (each prefixed by an asterisk in keys and list) are considered to have re sulted from either incorrect or doubtful records. -

Lice, Flies, Mites, and Ticks on Raptors (Accipitriformes, Falconiformes and Strigiformes) in Rescue Centers in Central Italy
Article Lice, Flies, Mites, and Ticks on Raptors (Accipitriformes, Falconiformes and Strigiformes) in Rescue Centers in Central Italy Riccardo Gherardi 1, Claudia D’Agostino 2 and Stefania Perrucci 1,* 1 Department of Veterinary Science, University of Pisa, 56124 Pisa, Italy; [email protected] 2 Department of Food Safety, Nutrition and Veterinary Public Health, Istituto Superiore di Sanità, 00161 Rome, Italy; [email protected] * Correspondence: [email protected] Abstract: This study aims to assess the occurrence of external arthropods on deceased raptors in rescue centers in Tuscany, central Italy. The examined diurnal raptors include 17 common buzzards (Buteo buteo), two European honey buzzards (Pernis apivorus), seven sparrowhawks (Accipiter nisus), six common kestrels (Falco tinnunculus), a western osprey (Pandion haliaetus), and a peregrine falcon (Falco peregrinus). Nocturnal raptors included seven barn owls (Tyto alba), ten tawny owls (Strix aluco), 22 little owls (Athene noctua) and two scops owls (Otus scops). The skin and the feathers of each animal were examined, and arthropods were collected, fixed, and microscopically identified. In 48 out of the 75 examined birds (64%), at least a single arthropod species was found. Identified arthropods included chewing lice (Degeeriella fulva, D. rufa, Colpocephalum turbinatum, C. apivorus, Nosopon lucidum, N. clayae, Craspedorrhyncus platystomus, Laemobothrion tinnunculi, Kurodaia subpachy- gaster, Strigiphilus cursitans), hippoboscid flies (Ornithomya avicularia), chigger and feather mites (Kramerella lunulata, K. lyra, Kramerella sp., Glaucalges attenuatus, Hieracolichus nisi, Hieracolichus sp., Neotrombicula autumnalis) and ticks (Haemaphysalis sp.). Most of the identified mite, fly and tick Citation: Gherardi, R.; D’Agostino, species are the first records in raptors in Italy. -

Biodiversity & Environment
„Moderné vzdelávanie pre vedomostnú spoločnosť/ Projekt je spolufi nancovaný zo zdrojov EÚ“ Biodiversity & Environment Volume 11 Number 2 Prešov 2019 BIODIVERSITY & ENVIRONMENT (Acta Universitatis Prešoviensis, Folia Oecologica) Ročník 11., číslo 2. Prešov 2019 Časopis je jedným z výsledkov realizácie projektu: „Inovácia vzdelávacieho a výskumného procesu ekológie ako jednej z nosných disciplín vedomostnej spoločnosti“, ITMS: 26110230119, podporeného z operačného programu Vzdelávanie, spolufinancovaného zo zdrojov EÚ. Editor: RNDr. Adriana Eliašová, PhD. Recenzenti: RNDr. Mária Balážová, PhD. RNDr. Beáta Baranová, PhD. PaedDr. Jakub Fedorčák, PhD. Mgr. Tomáš Jászay, PhD. doc. RNDr. Ján Kodada, CSc. Prof. PaedDr. Ján Koščo, PhD. Mgr. Barbara Mangová, PhD. Ing. Jozef Oboňa, PhD. doc. RNDr. Ľubomír Panigaj, CSc. Mgr. Ladislav Pekárik, PhD. RNDr. Michal Rendoš, PhD. doc. RNDr. Oldřich Sychra, Ph.D. RNDr. Matej Žiak, PhD. Redakčná rada: Predseda: doc. Mgr. Martin Hromada, PhD. Výkonný redaktor: RNDr. Adriana Eliašová, PhD. Členovia: RNDr. Mária Balážová, PhD. RNDr. Michal Baláž, PhD. RNDr. Alexander Csanády, PhD. RNDr. Lenka Demková, PhD. prof. PaedDr. Ján Koščo, PhD. doc. Mgr. Peter Manko, PhD. doc. Ruslan Maryichuk, CSc. Ing. Milan Novikmec, PhD. Ing. Jozef Oboňa, PhD. Ing. Marek Svitok, PhD. Mgr. Iveta Škodová, PhD. doc. RNDr. Marcel Uhrin, PhD. Adresa redakcie: Biodiversity & Environment Katedra ekológie FHPV PU Ulica 17. novembra č. 1 081 16 Prešov Tel: 051 / 75 70 358 e-mail: [email protected] Vydavateľ: Vydavateľstvo Prešovskej univerzity v Prešove Sídlo vydavateľa: Ulica 17. novembra č. 15, 080 01 Prešov IČO vydavateľa: 17 070 775 Periodicita: 2 čísla ročne Jazyk: slovenský/anglický/český Poradie vydania: 2/2019 Dátum vydania: december 2019 Foto na obálke: Saturnia pavonia (autor Mgr.