A Fitossanidade De Cereais Armazenados Em Angola
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Yellow Fever Outbreak in Angola, 01 September 2016
YELLOW FEVER OUTBREAK WEEKLY SITUATION REPORT, INCIDENT MANAGEMENT TEAM—ANGOLA YELLOW FEVER OUTBREAK IN ANGOLA INCIDENT MANAGEMENT Vol: 8-03 SITUATION REPORT W35, 01 September 2016 I. Key Highlights A total of 2,807,628 (94 %) individuals 6 months and above have been vaccinated in the 22 most recently vaccinated districts as of 01 September 2016, 15 districts out of 22 achieved 90% or more of vaccination coverage. 4 districts achieved between 80-90%. Three districts did not reach 80% coverage and the vaccination campaign was extended there for another one week : Dirico, Namacunde and Sumbe in Currently the IM System is supporting the Ministry of Health in the preparation of the upcoming campaign in 21 districts in 12 provinces. The total population targeted in this new phase is 3,189,392 and requires 3,986,019 doses of vaccines. Is expected the arrival of 1.98 M doses from the last request approved by ICG. The ICG did not communicate yet the date of shipment but is already on process. The preparation of the coverage survey is ongoing. Table 1: National Summary of Yellow Fever Outbreak II. Epidemiological Situation as of 01 September 2016 Yellow Fever Outbreak Summary 26 Aug — 01 Sep 2016, (W35) Reported cases 24 Samples tested 24 Week 35 statistics (26 August to 1 September 2016): Confirmed cases 0 Of 24 suspected cases reported, all of them were tested by the National Total Deaths 1 Laboratory. None of them was positive for yellow fever Total provinces that reported cases 8 One(1) death was reported among the suspected cases during this period. -

Inventário Florestal Nacional, Guia De Campo Para Recolha De Dados
Monitorização e Avaliação de Recursos Florestais Nacionais de Angola Inventário Florestal Nacional Guia de campo para recolha de dados . NFMA Working Paper No 41/P– Rome, Luanda 2009 Monitorização e Avaliação de Recursos Florestais Nacionais As florestas são essenciais para o bem-estar da humanidade. Constitui as fundações para a vida sobre a terra através de funções ecológicas, a regulação do clima e recursos hídricos e servem como habitat para plantas e animais. As florestas também fornecem uma vasta gama de bens essenciais, tais como madeira, comida, forragem, medicamentos e também, oportunidades para lazer, renovação espiritual e outros serviços. Hoje em dia, as florestas sofrem pressões devido ao aumento de procura de produtos e serviços com base na terra, o que resulta frequentemente na degradação ou transformação da floresta em formas insustentáveis de utilização da terra. Quando as florestas são perdidas ou severamente degradadas. A sua capacidade de funcionar como reguladores do ambiente também se perde. O resultado é o aumento de perigo de inundações e erosão, a redução na fertilidade do solo e o desaparecimento de plantas e animais. Como resultado, o fornecimento sustentável de bens e serviços das florestas é posto em perigo. Como resposta do aumento de procura de informações fiáveis sobre os recursos de florestas e árvores tanto ao nível nacional como Internacional l, a FAO iniciou uma actividade para dar apoio à monitorização e avaliação de recursos florestais nationais (MANF). O apoio à MANF inclui uma abordagem harmonizada da MANF, a gestão de informação, sistemas de notificação de dados e o apoio à análise do impacto das políticas no processo nacional de tomada de decisão. -

31 CFR Ch. V (7–1–05 Edition) Pt. 590, App. B
Pt. 590, App. B 31 CFR Ch. V (7–1–05 Edition) (2) Pneumatic tire casings (excluding tractor (C) Nharea and farm implement types), of a kind (2) Communities: specially constructed to be bulletproof or (A) Cassumbe to run when deflated (ECCN 9A018); (B) Chivualo (3) Engines for the propulsion of the vehicles (C) Umpulo enumerated above, specially designed or (D) Ringoma essentially modified for military use (E) Luando (ECCN 9A018); and (F) Sachinemuna (4) Specially designed components and parts (G) Gamba to the foregoing (ECCN 9A018); (H) Dando (f) Pressure refuellers, pressure refueling (I) Calussinga equipment, and equipment specially de- (J) Munhango signed to facilitate operations in con- (K) Lubia fined areas and ground equipment, not (L) Caleie elsewhere specified, developed specially (M) Balo Horizonte for aircraft and helicopters, and specially (b) Cunene Province: designed parts and accessories, n.e.s. (1) Municipalities: (ECCN 9A018); [Reserved] (g) Specifically designed components and (2) Communities: parts for ammunition, except cartridge (A) Cubati-Cachueca cases, powder bags, bullets, jackets, (B) [Reserved] cores, shells, projectiles, boosters, fuses (c) Huambo Province: and components, primers, and other det- (1) Municipalities: onating devices and ammunition belting (A) Bailundo and linking machines (ECCN 0A018); (B) Mungo (h) Nonmilitary shotguns, barrel length 18 (2) Communities: inches or over; and nonmilitary arms, (A) Bimbe discharge type (for example, stun-guns, (B) Hungue-Calulo shock batons, etc.), except arms designed (C) Lungue solely for signal, flare, or saluting use; (D) Luvemba and parts, n.e.s. (ECCNs 0A984 and 0A985); (E) Cambuengo (i) Shotgun shells, and parts (ECCN 0A986); (F) Mundundo (j) Military parachutes (ECCN 9A018); (G) Cacoma (k) Submarine and torpedo nets (ECCN (d) K. -

Conferência Sobre O Cooperativismo O Cooperativismo Como Modelo Empresarial Sustentável E Rentável E O Seu Impacto No Fortalecimento Da Economia Angolana
CONFERÊNCIA SOBRE O COOPERATIVISMO O COOPERATIVISMO COMO MODELO EMPRESARIAL SUSTENTÁVEL E RENTÁVEL E O SEU IMPACTO NO FORTALECIMENTO DA ECONOMIA ANGOLANA COOPERATIVISMO AGROPECUÁRIO E O DESENVOLVIMENTO ECONÓMICO – SOCIAL EM ANGOLA Belarmino Jelembi Director Geral da ADRA [email protected] Feira agropecuária de Cacusso Malanje Luanda, 06.05.2016 INDICE i. O COOPERATIVISMO VS A OPÇÃO DE DESENVOLVIMENTO AGRÍCOLA ii. EXPERIÊNCIAS DE PROMOÇÃO DO COOPERATIVISMO E DESENVOLVIMENTO LOCAL(CACULA E OUTROS) iii. NOTAS FINAIS i. O COOPERATIVISMO VS A OPÇÃO DE DESENVOLVIMENTO AGRÍCOLA O cooperativismo agropecuário não pode ser abordado sem clarificar a opção de desenvolvimento agrícola do país. 1. O modelo dos grandes projectos agroindustriais? 2. O modelo assente na agricultura familiar? Ou 3. Ambos? a) Modelos que, não sendo iguais, coexistem com complementaridades, conflitos e contradições Complementaridades: • Pequenos agricultores assalariados nas grandes fazendas; • Integração de agricultores nas cadeias agroindustriais (aves; suínos; leite; soja) Conflitos: terra; água; recursos públicos Contradições: modelos distintos de agricultura (alimentação); relação com biodiversidade b) Significados distintos: econômico, social, cultural e ambiental c) Modernização com especialização produtiva vs. unidades diversificadas, reprodução familiar e desenvolvimento territorial (papel da produção auto-consumo) d) Cadeias integradas e especialização produtiva vs. agregação de valor e construção de mercados (mercado institucional, compras públicas) -

Greater Plutonio FPSO Arrives Block 31 Offshore Angola in A
SONANGOL ANGOLA | OIL | BUSINESS | CULTURE ISSUE 14 SUMMER 2007 UNIVERSO Universo ISSUE 14 – SUMMER 2007 ON TIME: Sonangol Namibe joins the family ■ ON SITE: Greater Plutonio FPSO arrives Block 31 offshore Angola ■ IN A TIN: Pictures by Kandengues Unidos Luanda Orphans ISSUE 14 SUMMER 2007 INSIDE SONANGOL INSIDE ANGOLA Something Big 30 There is an awesome 30. Troubled Eden grandeur about almost For a region of such distracting everything to do with beauty and easy-going lifestyle, the oil industry: the now, as it rebuilds its future ambitious concepts, the TENTS Uíge has seen more than its fair huge structures, the share of disruptive influences amazing technological achievements – and the almost unimaginable 36. Paradise in sums invested to extract Waiting the sought after gas and liquid. With a new international airport CON In this issue we salute two momentous 36 and world-class hotels under events. The first is the arrival in Angolan construction, Angola’s tourism waters of the world’s biggest FPSO, exclusively minister sees a time when the photographed for Universo soon after it country can be less dependent arrived on Block 18. 8 14 on oil The second is the delivery of the fifth Suezmax crude carrier to join the Sonangol 8. Our Growing Family 42. Child’s Eye View fleet, the Sonangol Namibe, taking its total tonnage to just under 800,000 deadweight As the m/t Sonangol Namibe departs Korea’s The camera obscura was the tonnes. As our special report from Korea Okpo shipyard to begin her travels across the first mechanical means of repro- describes, her crew includes an elite cadre of Sonangol oceans of the world, so begins another chapter ducing a picture of an actual youthful Angolan officers and cadets, products Rua 1° Congresso do MPLA, for Sonangol Shipping scene. -

Angola's Agricultural Economy in Brief'
"~ ANGOLA'S AGRICULTURAL ECONOMY IN BRIEF'. (Foreign Agr,ioultural Eoonomic Report) . USPMFAER-139 / Herbert H. Stein~r. W~shj.ngton, DC~ EC.onom'ic Rese9.rqh Servic:-.e. Sep .. 1977. (NAL Call No. A281 ;9.1Ag8F) 1.0 :; 11111:,8 111111:~ I~ IIB~ w t:: i~l~ ~ ~ 140 0 I\III~ ~"' - . \\\\I~ 1III1 1.4 111111.6 ANGOLA'S AGRICULTURAL ECONOMY IN BRIEF U.S. Department of Agriculture Economic Research Service Foreign Agricultural Economic Report No. 139 NOTe' Names In parentheses are pre·mdependence names. ANGOLA'S AGRICULTURAL ECONOHY TN BRIEF. By Herbert H. Steiner, Foreign Demand and Competition Division, Eco nomic Research Service. Foreign Agricultural Economic Report No. 139. Washington, D.C. 20250 September 1977 \l ABSTRACT A short summary of the history, and a description of the physiography, climate, soils and vegetation, people, and economy of I Angola are followed by a report on the agri cultural sector as it existed just before independence in November 1975. Coffee was then the principal crop; corn and cassava were the staple foods. Other important crops were cotton! sisal, bananas, ~eans, and potatoes. Petroleum was the principal export, followed by coffee, diamonds, iron ore, fishmeal, cotton, and sisal. Keywords: Angola; Africa; Agricultural pro duction; Agricultural trade. ,) ! . : PREFAce Angola became independent on November 11, 1975. A devastating civil war accompanied the transition. The war and the exodus of most of the employees of the colonial Government interrupted the collection of statistics on production and trade. Because of the paucity of reliable data during and after the transi tion, this study is essentially a description of Angolan agriculture as it existed before independence. -

Culturas Intercalares E Agricultura Familiar Em Angola
UNIVERSIDADE TÉCNICA DE LISBOA INSTITUTO SUPERIOR DE AGRONOMIA “CULTURAS INTERCALARES E AGRICULTURA FAMILIAR EM ANGOLA. CASO: MANDIOCA/CAJANUS; MANDIOCA/LEUCAENA” Tese apresentada neste Instituto para obtenção do grau de doutor em Engenharia Agronómica Pascoal António Muondo Orientador: Doutor Catedrático Raul Xisto Bruno de Sousa Co‐Orientador: Doutor Associado Augusto Manuel Gomes Correia Presidente – Reitor da Universidade Técnica de Lisboa Vogais – Doutor Raul Filipe Xisto Bruno de Sousa, Professor catedrático aposentado Instituto Superior de Agronomia da Universidade Técnica de Lisboa; Doutora Maria Ermelinda Vaz Lourenço, Professora catedrática Universidade de Évora; Doutor Pedro Jorge Cravo Aguiar Pinto, Professor catedrático Instituto Superior de Agronomia da Universidade Técnica de Lisboa; Doutor José Pedro Domingos, Professor associado Universidade Agostinho Neto, Angola; Doutor Augusto Manuel Nogueira Gomes Correia, Professor associado Instituto Superior de Agronomia da Universidade Técnica de Lisboa. LISBOA 2013 À memória dos meus queridos pais e irmão de quem tenho tantas saudades. AGRADECIMENTOS O presente trabalho não teria sido possível sem a ajuda, empenho, abnegação e entusiasmo de muitas pessoas. Embora correndo o risco de omissão, quero deixar aqui expressos os meus agradecimentos: - Ao Senhor Professor Catedrático Raul Filipe Xisto Bruno de Sousa do Instituto Superior de Agronomia, pela orientação sábia deste trabalho, mas também pela completa disponibilidade, entusiasmo, amizade, minimização de risco, exigência e -
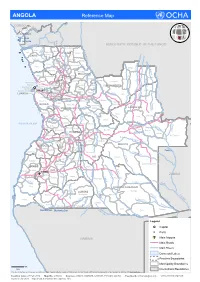
ANGOLA Reference Map
ANGOLA Reference Map CONGO L Belize ua ng Buco Zau o CABINDA Landana Lac Nieba u l Lac Vundu i Cabinda w Congo K DEMOCRATIC REPUBLIC OF THE CONGO o z Maquela do Zombo o p Noqui e Kuimba C Soyo M Mbanza UÍGE Kimbele u -Kongo a n ZAIRE e Damba g g o id Tomboco br Buengas M Milunga I n Songo k a Bembe i C p Mucaba s Sanza Pombo a i a u L Nzeto c u a i L l Chitato b Uige Bungo e h o e d C m Ambuila g e Puri Massango b Negage o MALANGE L Ambriz Kangola o u Nambuangongo b a n Kambulo Kitexe C Ambaca m Marimba g a Kuilo Lukapa h u Kuango i Kalandula C Dande Bolongongo Kaungula e u Sambizanga Dembos Kiculungo Kunda- m Maianga Rangel b Cacuaco Bula-Atumba Banga Kahombo ia-Baze LUNDA NORTE e Kilamba Kiaxi o o Cazenga eng Samba d Ingombota B Ngonguembo Kiuaba n Pango- -Caju a Saurimo Barra Do Cuanza LuanCda u u Golungo-Alto -Nzoji Viana a Kela L Samba Aluquem Lukala Lul o LUANDA nz o Lubalo a Kazengo Kakuso m i Kambambe Malanje h Icolo e Bengo Mukari c a KWANZA-NORTE Xa-Muteba u Kissama Kangandala L Kapenda- L Libolo u BENGO Mussende Kamulemba e L m onga Kambundi- ando b KWANZA-SUL Lu Katembo LUNDA SUL e Kilenda Lukembo Porto Amboim C Kakolo u Amboim Kibala t Mukonda Cu a Dala Luau v t o o Ebo Kirima Konda Ca s Z ATLANTIC OCEAN Waco Kungo Andulo ai Nharea Kamanongue C a Seles hif m um b Sumbe Bailundo Mungo ag e Leua a z Kassongue Kuemba Kameia i C u HUAMBO Kunhinga Luena vo Luakano Lobito Bocoio Londuimbali Katabola Alto Zambeze Moxico Balombo Kachiungo Lun bela gue-B Catum Ekunha Chinguar Kuito Kamakupa ungo a Benguela Chinjenje z Huambo n MOXICO -

Suma Rio Presidente Da Repubuca
Ter~a-feira, 25 de Fevereiro de 2014 I Serie-N.0 38 ORGAO OFICIAL DA REPUBLICA DE ANGOLA Pre~o deste numero- Kz: 430,00 Toda a correspondencia, quer oficial, quer ASSINATURA 0 pre90 de cada linha publicada nos Diarios relativa a anfulcio e assinaturas do «Diario Ano da Republica !.' e 2.' serie e de Kz: 75.00 e para da Republica», deve ser dirigida a Imprensa As tres series ................... Kz: 470 615.00 a 3.' serie Kz: 95.00, acrescido do respectivo Nacional • E.P., em Luanda, Rua Henrique de A!.' serie ................... Kz: 277 900.00 imposto do selo, dependendo a publica9ao da Carvalho n. 0 2, Cidade Alta, Caixa Postal 1306, www.imprensanacional.gov.ao • End. teleg.: A 2.' serie .... Kz: 145 500.00 3.'seriededep6sitoprevioaefectuarnatesouraria «Imprensa». A 3.' serie ... Kz: 115 470.00 da Imprensa Nacional - E. P. ARTIGO 2. 0 SUMA RIO (Revoga~ao) Presidente da Republica E revogada toda a legisla~ao que contrarie o disposto no presente Diploma. De creto Presidencial n. 0 46/14: 0 Aprova o Programa deAc9ao Nacional de Combate a Desertifica9ao. - ARTIGO 3. Revoga toda a legisla9ao que contrarie o disposto no presente Diploma. (Ditvidas e omissoes) As duvidas e omissoes resultantes eta inte1:preta~a o e apli Ministerio da Agricultura ca~ao do presente Decreto Presidencial sao resolvidas pelo Despacho n. 0 433/14: Presidente da Republica. Exonera Filomena Tavares de Almeida da Costa do cargo de Chefe de ARTIGO 4. 0 Sec9~0 de Tesoura1ia do Fundo de Desenvolviment.o do Cafe de Angola. (Entrada em vigor) Despacho n. -

Angola Livelihood Zone Report
ANGOLA Livelihood Zones and Descriptions November 2013 ANGOLA Livelihood Zones and Descriptions November 2013 TABLE OF CONTENTS Acknowledgements…………………………………………………………………………................……….…........……...3 Acronyms and Abbreviations……….………………………………………………………………......…………………....4 Introduction………….…………………………………………………………………………………………......………..5 Livelihood Zoning and Description Methodology……..……………………....………………………......…….…………..5 Livelihoods in Rural Angola….………........………………………………………………………….......……....…………..7 Recent Events Affecting Food Security and Livelihoods………………………...………………………..…….....………..9 Coastal Fishing Horticulture and Non-Farm Income Zone (Livelihood Zone 01)…………….………..…....…………...10 Transitional Banana and Pineapple Farming Zone (Livelihood Zone 02)……….……………………….….....…………..14 Southern Livestock Millet and Sorghum Zone (Livelihood Zone 03)………….………………………….....……..……..17 Sub Humid Livestock and Maize (Livelihood Zone 04)…………………………………...………………………..……..20 Mid-Eastern Cassava and Forest (Livelihood Zone 05)………………..……………………………………….……..…..23 Central Highlands Potato and Vegetable (Livelihood Zone 06)..……………………………………………….………..26 Central Hihghlands Maize and Beans (Livelihood Zone 07)..………..…………………………………………….……..29 Transitional Lowland Maize Cassava and Beans (Livelihood Zone 08)......……………………...………………………..32 Tropical Forest Cassava Banana and Coffee (Livelihood Zone 09)……......……………………………………………..35 Savannah Forest and Market Orientated Cassava (Livelihood Zone 10)…….....………………………………………..38 Savannah Forest and Subsistence Cassava -

Como Exportar Angola
Como Exportar Angola entre Ministério das Relações Exteriores Departamento de Promoção Comercial e Investimentos Divisão de Inteligência Comercial Como Exportar 1 Angola Sumário INTRODUÇÃO ........................................................2 3. Documentação e formalidades ............................ 157 MAPA .....................................................................3 4. Regimes especiais ............................................. 160 DADOS BÁSICOS ....................................................4 VI - ESTRUTURA DE COMERCIALIZAÇÃO ............171 I – ASPECTOS GERAIS ...........................................6 1. Canais de distribuição........................................ 171 1. Geografia.............................................................6 2. Promoção de vendas ......................................... 176 2. População, centros urbanos e nível de vida ...............9 3. Práticas comerciais ........................................... 179 3. Transportes e comunicações ................................. 13 4. Organização política e administrativa ..................... 28 VII - RECOMENDAÇÕES ÀS EMPRESAS BRASILEI- 5. Organizações e acordos internacionais ................... 33 RAS ................................................................... 187 II – ECONOMIA, MOEDA E FINANÇAS...................40 ANEXOS .............................................................189 1. Conjuntura econômica ........................................ 40 I - Endereços ...................................................... -

Dotação Orçamental Por Orgão
Exercício : 2013 REPÚBLICA DE ANGOLA Emissão : 13/12/2012 MINISTÉRIO DAS FINANÇAS Página : 132 DOTAÇÃO ORÇAMENTAL POR ORGÃO Órgão: Assembleia Nacional RECEITA POR NATUREZA ECONÓMICA Natureza Valor % Total Geral: 120.000.000,00 100,00% Receitas Correntes 120.000.000,00 100,00% Receita De Serviços 120.000.000,00 100,00% Receita De Serviços Diversos 120.000.000,00 100,00% DESPESAS POR NATUREZA ECONÓMICA Natureza Valor % Total Geral: 30.391.650.794,00 100,00% 3 - Despesas Correntes 24.537.739.268,00 80,74% 3.1 - Despesas Com O Pessoal 12.848.012.895,00 42,27% 3.1.1 - Despesas Com O Pessoal Civil 12.848.012.895,00 42,27% 3.2 - Contribuições Do Empregador 282.895.626,00 0,93% 3.2.1 - Contribuições Do Empreg.P/A Segurança Social 282.895.626,00 0,93% 3.3 - Despesas Em Bens E Serviços 11.399.872.347,00 37,51% 3.3.1 - Bens 809.372.089,00 2,66% 3.3.2 - Serviços 10.590.500.258,00 34,85% 3.5 - Subsidios E Transferencias Correntes 6.958.400,00 0,02% 3.5.2 - Transferencias Correntes 6.958.400,00 0,02% 4 - Despesas De Capital 5.853.911.526,00 19,26% 4.1 - Investimentos 5.853.911.526,00 19,26% 4.1.1 - Aquisição De Bens De Capital Fixo 5.598.911.526,00 18,42% 4.1.4 - Compra De Activos Intangíveis 255.000.000,00 0,84% DESPESAS POR FUNÇÃO Função Valor % Total Geral: 30.391.650.794,00 100,00% 1 - Serviços Públicos Gerais 30.391.650.794,00 100,00% 1.0.2.0.0 - Órgãos Executivos 30.391.650.794,00 100,00% DESPESAS POR PROGRAMA Programa Valor % Total Geral: 30.391.650.794,00 100,00% Actividades Permanentes 30.391.650.794,00 100,00% DESPESAS DE FUNCIONAMENTO Projecto