05 RCHN Valencia.Indd
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

The Chocó-Darién Conservation Corridor
July 4, 2011 The Chocó-Darién Conservation Corridor A Project Design Note for Validation to Climate, Community, and Biodiversity (CCB) Standards (2nd Edition). CCB Project Design Document – July 4, 2011 Executive Summary Colombia is home to over 10% of the world’s plant and animal species despite covering just 0.7% of the planet’s surface, and has more registered species of birds and amphibians than any other country in the world. Along Colombia’s northwest border with Panama lies the Darién region, one of the most diverse ecosystems of the American tropics, a recognized biodiversity hotspot, and home to two UNESCO Natural World Heritage sites. The spectacular rainforests of the Darien shelter populations of endangered species such as the jaguar, spider monkey, wild dog, and peregrine falcon, as well as numerous rare species that exist nowhere else on the planet. The Darién is also home to a diverse group of Afro-Colombian, indigenous, and mestizo communities who depend on these natural resources. On August 1, 2005, the Council of Afro-Colombian Communities of the Tolo River Basin (COCOMASUR) was awarded collective land title to over 13,465 hectares of rainforest in the Serranía del Darién in the municipality of Acandí, Chocó in recognition of their traditional lifestyles and longstanding presence in the region. If they are to preserve the forests and their traditional way of life, these communities must overcome considerable challenges. During 2001- 2010 alone, over 10% of the natural forest cover of the surrounding region was converted to pasture for cattle ranching or cleared to support unsustainable agricultural practices. -

(GISD) 2021. Species Profile Rattus Rattus. Available From
FULL ACCOUNT FOR: Rattus rattus Rattus rattus System: Terrestrial Kingdom Phylum Class Order Family Animalia Chordata Mammalia Rodentia Muridae Common name Hausratte (German), European house rat (English), bush rat (English), blue rat (English), ship rat (English), roof rat (English), black rat (English) Synonym Mus rattus , Linnaeus, 1758 Mus alexandrinus , Geoffroy, 1803 Musculus frugivorus , Rafinesque, 1814 Mus novaezelandiae , Buller, 1870 Similar species Rattus norvegicus Summary A native of the Indian sub-continent, the ship rat (Rattus rattus) has now spread throughout the world. It is widespread in forest and woodlands as well as being able to live in and around buildings. It will feed on and damage almost any edible thing. The ship rat is most frequently identified with catastrophic declines of birds on islands. It is very agile and often frequents tree tops searching for food and nesting there in bunches of leaves and twigs. view this species on IUCN Red List Species Description A slender rat with large hairless ears, the ship rat (Rattus rattus) may be grey-brown on the back with either a similarly coloured or creamish-white belly, or it may be black all over. The uniformly- coloured tail is always longer than the head and body length combined. Its body weight is usually between 120 and 160 g but it can exceed 200 g. The work of Yosida (1980) and his co-workers has shown that there are two forms of R. rattus that differ in chromosome number. The more widespread Oceanic form has 38 chromosomes and is the ship rat of Europe, the Mediterranean region, America, Australia and New Zealand. -
Supporting Files
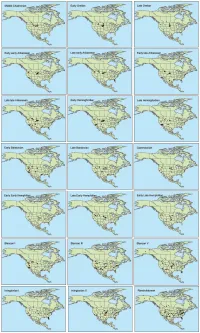
Table S1. Summary of Special Emissions Report Scenarios (SERs) to which we fit climate models for extant mammalian species. Mean Annual Temperature Standard Scenario year (˚C) Deviation Standard Error Present 4.447 15.850 0.057 B1_low 2050s 5.941 15.540 0.056 B1 2050s 6.926 15.420 0.056 A1b 2050s 7.602 15.336 0.056 A2 2050s 8.674 15.163 0.055 A1b 2080s 7.390 15.444 0.056 A2 2080s 9.196 15.198 0.055 A2_top 2080s 11.225 14.721 0.053 Table S2. List of mammalian taxa included and excluded from the species distribution models. -

The Neotropical Region Sensu the Areas of Endemism of Terrestrial Mammals
Australian Systematic Botany, 2017, 30, 470–484 ©CSIRO 2017 doi:10.1071/SB16053_AC Supplementary material The Neotropical region sensu the areas of endemism of terrestrial mammals Elkin Alexi Noguera-UrbanoA,B,C,D and Tania EscalanteB APosgrado en Ciencias Biológicas, Unidad de Posgrado, Edificio A primer piso, Circuito de Posgrados, Ciudad Universitaria, Universidad Nacional Autónoma de México (UNAM), 04510 Mexico City, Mexico. BGrupo de Investigación en Biogeografía de la Conservación, Departamento de Biología Evolutiva, Facultad de Ciencias, Universidad Nacional Autónoma de México (UNAM), 04510 Mexico City, Mexico. CGrupo de Investigación de Ecología Evolutiva, Departamento de Biología, Universidad de Nariño, Ciudadela Universitaria Torobajo, 1175-1176 Nariño, Colombia. DCorresponding author. Email: [email protected] Page 1 of 18 Australian Systematic Botany, 2017, 30, 470–484 ©CSIRO 2017 doi:10.1071/SB16053_AC Table S1. List of taxa processed Number Taxon Number Taxon 1 Abrawayaomys ruschii 55 Akodon montensis 2 Abrocoma 56 Akodon mystax 3 Abrocoma bennettii 57 Akodon neocenus 4 Abrocoma boliviensis 58 Akodon oenos 5 Abrocoma budini 59 Akodon orophilus 6 Abrocoma cinerea 60 Akodon paranaensis 7 Abrocoma famatina 61 Akodon pervalens 8 Abrocoma shistacea 62 Akodon philipmyersi 9 Abrocoma uspallata 63 Akodon reigi 10 Abrocoma vaccarum 64 Akodon sanctipaulensis 11 Abrocomidae 65 Akodon serrensis 12 Abrothrix 66 Akodon siberiae 13 Abrothrix andinus 67 Akodon simulator 14 Abrothrix hershkovitzi 68 Akodon spegazzinii 15 Abrothrix illuteus -

Lista Actualizada Y Comentada De Los Mamíferos De Venezuela
Memoria de la Fundación La Salle de Ciencias Naturales 2012 (“2010”) 173-174: 173-238 Lista actualizada y comentada de los mamíferos de Venezuela Javier Sánchez H. y Daniel Lew Resumen. Se presenta una lista actualizada de los mamíferos de Venezuela que incluye 390 especies –agrupadas en 14 órdenes, 47 familias y 184 géneros–, 30 de ellas (7,7%) endémicas para el país. Se señalan cambios relevantes posteriores a la última actualización de los mamíferos del mundo en cuanto al conocimiento de la taxonomía y distribución de las especies venezolanas, sobre la base de detalladas consideraciones taxonómicas que justifican los cambios propuestos. Se hace un recuento histórico de la mastozoología en Venezuela con el reconocimiento de los aportes más relevantes. Se incluye un análisis de la tasa de descripción de los taxones presentes en Venezuela (no necesariamente con localidades típicas en el país), revelando un incremento promedio de 9,7 especies por década en los últimos 110 años. Se analiza la representatividad de la mastofauna de Venezuela respecto a las diferentes jerarquias taxonómicas conocidas para el mundo encontrando, entre otras cosas, que el 7,2% de todas las especies descritas a nivel global han sido registradas en el país (7,7% si se consideran solo los 14 órdenes presentes en Venezuela). Se compara la riqueza de este grupo en Venezuela respecto a los países del norte de Suramérica (Ecuador, Colombia, Guyana, Guayana Francesa y Surinam). Palabras Clave. Mammalia. Riqueza. Taxonomía. Distribución. Venezuela. Updated list of Venezuelan mammals Abstract. We show an updated list of Venezuelan mammals including 390 species, grouped in 14 orders, 47 families and 184 genera; 30 species (7,7%) are endemic to the country. -

New Rodents (Cricetidae) from the Neogene of Curacßao and Bonaire, Dutch Antilles
[Palaeontology, 2013, pp. 1–14] NEW RODENTS (CRICETIDAE) FROM THE NEOGENE OF CURACßAO AND BONAIRE, DUTCH ANTILLES 1,2 3 by JELLE S. ZIJLSTRA *, DONALD A. MCFARLANE , LARS W. VAN DEN HOEK OSTENDE2 and JOYCE LUNDBERG4 1914 Rich Avenue #3, Mountain View, CA 94040, USA; e-mail: [email protected] 2Department of Geology, Naturalis Biodiversity Center, PO Box 9517, Leiden, RA 2300, the Netherlands; e-mail: [email protected] 3W. M. Keck Center, The Claremont Colleges, 925 North Mills Avenue, Claremont, CA 91711-5916, USA; e-mail: [email protected] 4Department of Geography and Environmental Studies, Carleton University, Ottawa, ON KIS 5B6, Canada; e-mail: [email protected] *Corresponding author Typescript received 4 June 2012; accepted in revised form 11 November 2013 Abstract: Cordimus, a new genus of cricetid rodent, is described from Bonaire on the basis of Holocene owl pellet described from Neogene deposits on the islands of Curacßao material that consists of dentaries and postcranial material and Bonaire, Dutch Antilles. The genus is characterized by only. This species is presumed to be extinct, but focused sur- strongly cuspidate molars, the presence of mesolophs in most veys are needed to confirm this hypothesis. Cordimus debu- upper molars and the absence of mesolophids in lower molars. isonjei sp. nov. and Cordimus raton sp. nov. are described from Similarities with the early cricetid Copemys from the Miocene deposits on Tafelberg Santa Barbara in Curacßao. Although the of North America coupled with apparent derived characters age of these deposits is not known, they are most likely of late shared with the subfamily Sigmodontinae suggest that Cordi- Pliocene or early Pleistocene age. -

Redalyc.RIQUEZA, ENDEMISMO Y CONSERVACIÓN DE LOS
Mastozoología Neotropical ISSN: 0327-9383 [email protected] Sociedad Argentina para el Estudio de los Mamíferos Argentina Solari, Sergio; Muñoz-Saba, Yaneth; Rodríguez-Mahecha, José V.; Defler, Thomas R.; Ramírez- Chaves, Héctor E.; Trujillo, Fernando RIQUEZA, ENDEMISMO Y CONSERVACIÓN DE LOS MAMÍFEROS DE COLOMBIA Mastozoología Neotropical, vol. 20, núm. 2, julio-diciembre, 2013, pp. 301-365 Sociedad Argentina para el Estudio de los Mamíferos Tucumán, Argentina Disponible en: http://www.redalyc.org/articulo.oa?id=45729294008 Cómo citar el artículo Número completo Sistema de Información Científica Más información del artículo Red de Revistas Científicas de América Latina, el Caribe, España y Portugal Página de la revista en redalyc.org Proyecto académico sin fines de lucro, desarrollado bajo la iniciativa de acceso abierto Mastozoología Neotropical, 20(2):301-365, Mendoza, 2013 Copyright ©SAREM, 2013 Versión impresa ISSN 0327-9383 http://www.sarem.org.ar Versión on-line ISSN 1666-0536 Artículo RIQUEZA, ENDEMISMO Y CONSERVACIÓN DE LOS MAMÍFEROS DE COLOMBIA Sergio Solari1, Yaneth Muñoz-Saba2, José V. Rodríguez-Mahecha3, Thomas R. Defler4, Héctor E. Ramírez-Chaves5 y Fernando Trujillo6 1 Instituto de Biología, Grupo Mastozoología & Colección Teriológica, Universidad de Antioquia, Medellín, Colombia. [Correspondencia: <[email protected]>]. 2 Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Bogotá D.C., Colombia. 3 Director Científico, Conservación Internacional Colombia, Bogotá D.C., Colombia. 4 Departamento de Biología, Universidad Nacional de Colombia, Bogotá, D.C., Colombia. 5 School of Biological Sciences, University of Queensland, Queensland, Australia. 6 Director Científico, Fundación Omacha, Bogotá D.C., Colombia. RESUMEN. Se actualiza la diversidad de especies de mamíferos de Colombia con base en una nueva revisión de especímenes en las mayores colecciones del país y el extranjero y la compilación de cambios taxonómicos recientes que involucran especies presentes en el país. -

Invasive Rats on Tropical Islands: Their Population Biology and Impacts on Native Species
Global Ecology and Conservation 3 (2015) 607–627 Contents lists available at ScienceDirect Global Ecology and Conservation journal homepage: www.elsevier.com/locate/gecco Review paper Invasive rats on tropical islands: Their population biology and impacts on native species a,b, b Grant A. Harper ⇤, Nancy Bunbury a Biodiversity Restoration Specialists, PO Box 58, St Arnaud, New Zealand b Seychelles Islands Foundation, Mont Fleuri, PO Box 853, Victoria, Mahé, Seychelles article info abstract Article history: The three most invasive rat species, black or ship rat Rattus rattus, brown or Norway rats, Received 4 December 2014 R. norvegicus and Pacific rat, R. exulans have been incrementally introduced to islands as Received in revised form 20 February 2015 humans have explored the world’s oceans. They have caused serious deleterious effects Accepted 20 February 2015 through predation and competition, and extinction of many species on tropical islands, Available online 26 February 2015 many of which are biodiversity hotspots. All three rat species are found in virtually all habitat types, including mangrove and arid shrub land. Black rats tend to dominate the Keywords: literature but despite this the population biology of invasive rats, particularly Norway rats, Rattus Ship rats is poorly researched on tropical islands. Pacific rats can often exceed population densities 1 1 Pacific rats of well over 100 rats ha− and black rats can attain densities of 119 rats ha− , which is Norway rats much higher than recorded on most temperate islands. High densities are possibly due Diet to high recruitment of young although the data to support this are limited. -

Diversidad Taxonómica, Funcional Y Filogenética De Mamíferos En Colombia
DIVERSIDAD TAXONÓMICA, FUNCIONAL Y FILOGENÉTICA DE MAMÍFEROS EN COLOMBIA Ramón Esteban Granados Peña Universidad Nacional de Colombia Facultad de Ciencias Agropecuarias, Departamento de Ciencias Forestales Medellín, Colombia 2013 II DIVERSIDAD TAXONÓMICA, FUNCIONAL Y FILOGENÉTICA DE MAMÍFEROS EN COLOMBIA DIVERSIDAD TAXONÓMICA, FUNCIONAL Y FILOGENÉTICA DE MAMÍFEROS EN COLOMBIA Ramón Esteban Granados Peña Trabajo de investigación presentado como requisito parcial para optar al título de: Magister en Bosques y Conservación Ambiental Director: Doctor en Ciencias (c), José F. González Maya Codirector: Doctor en Ciencias, Néstor Mancera Rodríguez Línea de Investigación: Biología de la Conservación Grupo de Investigación: ECOFAUNA Universidad Nacional de Colombia Facultad de Ciencias Agropecuarias, Departamento de Ciencias Forestales Medellín, Colombia 2013 Agradecimientos Agradecemos a la Universidad Nacional de Colombia, Sede Medellín, The Sierra to Sea Institute, ProCAT Colombia y The Mikelberg Family Foundation por su apoyo y financiación durante todo el proceso de este trabajo. A los aportes y colaboraciones realizadas por Andres Arias Alzate y Gustavo Manjarres G., Gustavo Manjarres Pinzón. Contenido IV Resumen Este documento presenta una análisis de la diversidad funcional de mamíferos a dos escalas, la primera correspondiente al Departamento del Magdalena y la segunda a nivel nacional, con el propósito de cuantificar la diversidad de mamíferos desde un enfoque multidimensional, donde no sólo se tiene en cuenta la medida clásica de la -

A Global-Scale Evaluation of Mammalian Exposure and Vulnerability to Anthropogenic Climate Change
A Global-Scale Evaluation of Mammalian Exposure and Vulnerability to Anthropogenic Climate Change Tanya L. Graham A Thesis in The Department of Geography, Planning and Environment Presented in Partial Fulfillment of the Requirements for the Degree of Master of Science (Geography, Urban and Environmental Studies) at Concordia University Montreal, Quebec, Canada March 2018 © Tanya L. Graham, 2018 Abstract A Global-Scale Evaluation of Mammalian Exposure and Vulnerability to Anthropogenic Climate Change Tanya L. Graham There is considerable evidence demonstrating that anthropogenic climate change is impacting species living in the wild. The vulnerability of a given species to such change may be understood as a combination of the magnitude of climate change to which the species is exposed, the sensitivity of the species to changes in climate, and the capacity of the species to adapt to climatic change. I used species distributions and estimates of expected changes in local temperatures per teratonne of carbon emissions to assess the exposure of terrestrial mammal species to human-induced climate change. I evaluated species vulnerability to climate change by combining expected local temperature changes with species conservation status, using the latter as a proxy for species sensitivity and adaptive capacity to climate change. I also performed a global-scale analysis to identify hotspots of mammalian vulnerability to climate change using expected temperature changes, species richness and average species threat level for each km2 across the globe. The average expected change in local annual average temperature for terrestrial mammal species is 1.85 oC/TtC. Highest temperature changes are expected for species living in high northern latitudes, while smaller changes are expected for species living in tropical locations. -

Maestri Et Al Suppl
Journal of Biogeography SUPPORTING INFORMATION Geographical variation of body size in sigmodontine rodents depends on both environment and phylogenetic composition of communities Renan Maestri, André Luís Luza, Lurdiana Dayse de Barros, Sandra Maria Hartz, Augusto Ferrari, Thales Renato Ochotorena de Freitas, Leandro D. S. Duarte Appendix S1 Body mass (in grams) for each of the 245 sigmodontine species (Rodentia, Sigmodontinae) used in the study, plus the place of each species within tribes (see Appendix S2). Species Mass (grams) Tribe Abrawayaomys ruschii 63.00 Clade A Abrothrix illuteus 47.80 Clade B Abrothrix lanosus 32.50 Clade B Abrothrix longipilis 37.60 Clade B Abrothrix sanborni 24.70 Clade B Aepeomys lugens 37.00 Thomasomyini Akodon aerosus 60.00 Akodontini Akodon affinis 24.90 Akodontini Akodon albiventer 21.80 Akodontini Akodon azarae 25.00 Akodontini Neomicroxus bogotensis 13.00 Clade A Akodon boliviensis 27.50 Akodontini Akodon budini 26.90 Akodontini Akodon cursor 39.90 Akodontini Akodon dayi 32.50 Akodontini Akodon dolores 50.50 Akodontini Akodon fumeus 22.70 Akodontini Akodon iniscatus 28.70 Akodontini Akodon juninensis 39.00 Akodontini Akodon kofordi 29.50 Akodontini Akodon latebricola 39.00 Akodontini Akodon mimus 24.00 Akodontini Akodon molinae 33.00 Akodontini Akodon mollis 30.40 Akodontini Akodon montensis 44.10 Akodontini Akodon neocenus 42.40 Akodontini Akodon orophilus 39.00 Akodontini Akodon paranaensis 32.40 Akodontini Akodon reigi 30.10 Akodontini Akodon sanctipaulensis 27.10 Akodontini Akodon serrensis 28.30 -

Rodentia, Cricetidae, Sigmodontinae) from Brazil Gustavo B
UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL RELAÇÕES FILOGENÉTICAS ENTRE AS ESPÉCIES DE ROEDORES SUL- AMERICANOS DA TRIBO ORYZOMYINI ANALISADAS PELOS GENES CITOCROMO b E IRBP GUSTAVO BORBA DE MIRANDA Tese submetida ao Programa de Pós- Graduação em Genética e Biologia Molecular da UFRGS como requisito parcial para a obtenção do grau de Doutor em Ciências Orientadora: Drª Margarete Suñé Mattevi Porto Alegre Junho/2007 Este trabalho foi desenvolvido no Deptº de Genética da Universidade Federal do Rio Grande do Sul e financiado pelos seguintes órgãos: CNPq, G7/FINEP, FAPERGS e OEA. i AGRADECIMENTOS À Professora Drª Margarete Suñé Mattevi pela orientação, dedicação, confiança e, acima de tudo, amizade. Aos Drs. Luiz Flamarion B. de Oliveira, Alfredo Langguth, Andréa Nunes e José L. P. Cordeiro por parte da amostra utilizada neste trabalho. À Professora Drª Sidia M. Callegari-Jacques pelo auxílio nos artigos e, principalmente, nas questões estatísticas deste trabalho. À minha esposa Jaqueline, por sua paciência, companheirismo, amor e auxílio em todas as etapas deste trabalho. A todos os meus familiares, representados pelos meus pais Wilson e Salomé, por todo o apoio e carinho. Aos Drs. Marcelo Weksler e Valéria Muschner por importantes informações técnicas. Aos meus colegas da sala 107, do laboratório de Biodiversidade Animal e da Pós-Graduação: Aline Moraes, Ana Letícia, Ângela Mascali, Bianca Carvalho, Cristina Freygang, Francine Marques, Gustavo Borges, Gustavo Trainini, Hugo Bock, Martin Montes, Mônica Fontan, Rafael Dihl, Taiana Haag, Teresa Freire e Vanessa Mengue pela amizade e trocas de idéias. Ao Luciano Silva e Clênio Machado pelo companheirismo e discussões futebolísticas durante a “Hora do Café”.