The Neotropical Region Sensu the Areas of Endemism of Terrestrial Mammals
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Sinopsis De Los Mamíferos Silvestres Del Estado De Guanajuato, México, Y Comentarios Sobre Su Conservación Óscar Sánchez 369
La Portada Fotografía tomada en la comida de celebración posterior a la firma del Acta Constitutiva de la Asociación Mexicana de Mastozoología Asociación Civil (AMMAC). La primera mesa directiva de la AMMAC estuvo constituida por Juan Pablo Gallo como presidente, Daniel Navarro como vicepresidente, Rodrigo Medellín como secretario ejecutivo y María Canela como tesorera. La foto fue tomada en casa de Juan Pablo Gallo, que junto con la de Rodrigo Medellín fueron las que hospedaron la mayor cantidad de reuniones preparatorias para la Asociación. De pie empezando por la izquierda: Daniel Navarro, Rosario Manzanos, María Canela, Silvia Manzanilla, Esther Romo, Livia León, Alondra Castro. Sentados desde la izquierda: Federico Romero, Héctor Arita, Rodrigo Medellín, Hiram Barrios, Víctor Sánchez Cordero, Juan Pablo Gallo y Álvaro Miranda (foto tomada por Agustín Gallo Reynoso). Nuestro logo “Ozomatli” El nombre de “Ozomatli” proviene del náhuatl se refiere al símbolo astrológico del mono en el calendario azteca, así como al dios de la danza y del fuego. Se relaciona con la alegría, la danza, el canto, las habilidades. Al signo decimoprimero en la cosmogonía mexica. “Ozomatli” es una representación pictórica de los mono arañas (Ateles geoffroyi). La especie de primate de más amplia distribución en México. “Es habitante de los bosques, sobre todo de los que están por donde sale el sol en Anáhuac. Tiene el dorso pequeño, es barrigudo y su cola, que a veces se enrosca, es larga. Sus manos y sus pies parecen de hombre; también sus uñas. Los Ozomatin gritan y silban y hacen visajes a la gente. Arrojan piedras y palos. -

A Matter of Weight: Critical Comments on the Basic Data Analysed by Maestri Et Al
DOI: 10.1111/jbi.13098 CORRESPONDENCE A matter of weight: Critical comments on the basic data analysed by Maestri et al. (2016) in Journal of Biogeography, 43, 1192–1202 Abstract Maestri, Luza, et al. (2016), although we believe that an exploration Recently, Maestri, Luza, et al. (2016) assessed the effect of ecology of the quality of the original data informs both. Ultimately, we sub- and phylogeny on body size variation in communities of South mit that the matrix of body size and the phylogeny used by these American Sigmodontinae rodents. Regrettably, a cursory analysis of authors were plagued with major inaccuracies. the data and the phylogeny used to address this question indicates The matrix of body sizes used by Maestri, Luza, et al. (2016, p. that both are plagued with inaccuracies. We urge “big data” users to 1194) was obtained from two secondary or tertiary sources: give due diligence at compiling data in order to avoid developing Rodrıguez, Olalla-Tarraga, and Hawkins (2008) and Bonvicino, Oli- hypotheses based on insufficient or misleading basic information. veira, and D’Andrea (2008). The former study derived cricetid mass data from Smith et al. (2003), an ambitious project focused on the compilation of “body mass information for all mammals on Earth” We are living a great time in evolutionary biology, where the combi- where the basic data were derived from “primary and secondary lit- nation of the increased power of systematics, coupled with the use erature ... Whenever possible, we used an average of male and of ever more inclusive datasets allows—heretofore impossible— female body mass, which was in turn averaged over multiple locali- questions in ecology and evolution to be addressed. -

Advances in Cytogenetics of Brazilian Rodents: Cytotaxonomy, Chromosome Evolution and New Karyotypic Data
COMPARATIVE A peer-reviewed open-access journal CompCytogenAdvances 11(4): 833–892 in cytogenetics (2017) of Brazilian rodents: cytotaxonomy, chromosome evolution... 833 doi: 10.3897/CompCytogen.v11i4.19925 RESEARCH ARTICLE Cytogenetics http://compcytogen.pensoft.net International Journal of Plant & Animal Cytogenetics, Karyosystematics, and Molecular Systematics Advances in cytogenetics of Brazilian rodents: cytotaxonomy, chromosome evolution and new karyotypic data Camilla Bruno Di-Nizo1, Karina Rodrigues da Silva Banci1, Yukie Sato-Kuwabara2, Maria José de J. Silva1 1 Laboratório de Ecologia e Evolução, Instituto Butantan, Avenida Vital Brazil, 1500, CEP 05503-900, São Paulo, SP, Brazil 2 Departamento de Genética e Biologia Evolutiva, Instituto de Biociências, Universidade de São Paulo, Rua do Matão 277, CEP 05508-900, São Paulo, SP, Brazil Corresponding author: Maria José de J. Silva ([email protected]) Academic editor: A. Barabanov | Received 1 August 2017 | Accepted 23 October 2017 | Published 21 December 2017 http://zoobank.org/203690A5-3F53-4C78-A64F-C2EB2A34A67C Citation: Di-Nizo CB, Banci KRS, Sato-Kuwabara Y, Silva MJJ (2017) Advances in cytogenetics of Brazilian rodents: cytotaxonomy, chromosome evolution and new karyotypic data. Comparative Cytogenetics 11(4): 833–892. https://doi. org/10.3897/CompCytogen.v11i4.19925 Abstract Rodents constitute one of the most diversified mammalian orders. Due to the morphological similarity in many of the groups, their taxonomy is controversial. Karyotype information proved to be an important tool for distinguishing some species because some of them are species-specific. Additionally, rodents can be an excellent model for chromosome evolution studies since many rearrangements have been described in this group.This work brings a review of cytogenetic data of Brazilian rodents, with information about diploid and fundamental numbers, polymorphisms, and geographical distribution. -

The Pattern of Color Change in Small Mammal
Sandoval Salinas et al. BMC Res Notes (2018) 11:424 https://doi.org/10.1186/s13104-018-3544-x BMC Research Notes RESEARCH NOTE Open Access The pattern of color change in small mammal museum specimens: is it independent of storage histories given museum‑specifc conditions? María Leonor Sandoval Salinas1,2*, José D. Sandoval1,3, Elisa M. Colombo1,3 and Rubén M. Barquez2 Abstract Objective: Determination of color and evaluating its variation form the basis for a broad range of research questions. For studies on taxonomy, systematics, etc., resorting to mammal specimens in museum collections has a number of advantages over using feld specimens. However, if museum specimens are to be for studying color, they should accurately represent the color of live animals, or we should understand how they difer. Basically, this study addresses this question: How does coat color vary when dealing with specimens of Akodon budini (Budin’s grass mouse, Thomas 1918), stored in one museum collection for diferent periods of time? Results: We measured color values through a spectroradiometer and a difuse illumination cabin and used the refectance values in the form of CIELab tri-stimulus values, considering CIE standard illuminant A. We observed that there is a relationship between specimen storage antiquity and pelage color and it seems that it is general for at least a number of small mammals and this could indicate a universal phenomenon across several mammal species and across several storage conditions. Our results, as others, emphasize the importance of considering storage time, among other circumstances, in research studies using mammal skins and where color is of importance. -

Lista Revisada De Los Mamíferos De Argentina
Mastozoología Neotropical, en prensa, Mendoza, 2018 Copyright ©SAREM, 2018 http://www.sarem.org.ar Versión on-line ISSN 1666-0536 http://www.sbmz.com.br Artículo LISTA REVISADA DE LOS MAMÍFEROS DE ARGENTINA Pablo Teta1, 5, Agustín M. Abba2, 5, Guillermo H. Cassini1, 3, 5, David A. Flores4 ,5, Carlos A. Galliari2, 5, Sergio O. Lucero1, 5 y Mariano Ramírez1, 5 1 División Mastozoología, Museo Argentino de Ciencias Naturales “Bernardino Rivadavia”, Buenos Aires, Argentina. [Correspondencia: Pablo Teta <[email protected]>] 2 Centro de Estudios Parasitológicos y de Vectores (CEPAVE, CONICET-UNLP), La Plata, Argentina. 3 Departamento de Ciencias Básicas, Universidad Nacional de Luján, Luján, Buenos Aires, Argentina. 4 Instituto de Vertebrados, Unidad Ejecutora Lillo (CONICET- Fundación Miguel Lillo), Tucumán, Argentina. 5 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina. RESUMEN. Se presenta una lista revisada de los mamíferos de Argentina, incorporando los cambios taxonómi- cos recientes y los nuevos registros para el país producidos desde la publicación de un listado previo en 2006. Se registraron 409 especies nativas, correspondientes a 181 géneros, 46 familias y 12 órdenes, más 23 especies introducidas con poblaciones silvestres. ABSTRACT. Revised checklist of mammals from Argentina. We present a revised checklist of the mammals of Argentina, incorporating recent taxonomical changes and new records of mammals for the country produced since the publication of a previous list in 2006. We recordered 409 native species, corresponding to 181 genera, 46 families and 12 orders, plus 23 introduced taxa with wild populations. Palabras clave: América del Sur. Lista de especies. Mammalia. Taxonomía. Key words. Checklist. Mammalia. -
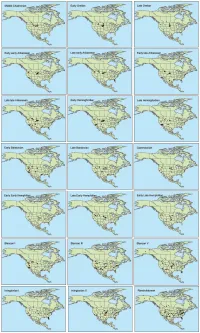
Supporting Files
Table S1. Summary of Special Emissions Report Scenarios (SERs) to which we fit climate models for extant mammalian species. Mean Annual Temperature Standard Scenario year (˚C) Deviation Standard Error Present 4.447 15.850 0.057 B1_low 2050s 5.941 15.540 0.056 B1 2050s 6.926 15.420 0.056 A1b 2050s 7.602 15.336 0.056 A2 2050s 8.674 15.163 0.055 A1b 2080s 7.390 15.444 0.056 A2 2080s 9.196 15.198 0.055 A2_top 2080s 11.225 14.721 0.053 Table S2. List of mammalian taxa included and excluded from the species distribution models. -

Parasitizing Akodon Montensis (Rodentia: Cricetidae) in the Southern Region of Brazil Revista Brasileira De Parasitologia Veterinária, Vol
Revista Brasileira de Parasitologia Veterinária ISSN: 0103-846X [email protected] Colégio Brasileiro de Parasitologia Veterinária Brasil Trevisan Gressler, Lucas; da Silva Krawczak, Felipe; Knoff, Marcelo; Gonzalez Monteiro, Silvia; Bahia Labruna, Marcelo; de Campos Binder, Lina; Sobotyk de Oliveira, Caroline; Notarnicola, Juliana Litomosoides silvai (Nematoda: Onchocercidae) parasitizing Akodon montensis (Rodentia: Cricetidae) in the southern region of Brazil Revista Brasileira de Parasitologia Veterinária, vol. 26, núm. 4, octubre, 2017, pp. 433- 438 Colégio Brasileiro de Parasitologia Veterinária Jaboticabal, Brasil Available in: http://www.redalyc.org/articulo.oa?id=397853594005 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Original Article Braz. J. Vet. Parasitol., Jaboticabal, v. 26, n. 4, p. 433-438, oct.-dec. 2017 ISSN 0103-846X (Print) / ISSN 1984-2961 (Electronic) Doi: http://dx.doi.org/10.1590/S1984-29612017060 Litomosoides silvai (Nematoda: Onchocercidae) parasitizing Akodon montensis (Rodentia: Cricetidae) in the southern region of Brazil Litomosoides silvai (Nematoda: Onchocercidae) parasitando Akodon montensis (Rodentia: Cricetidae) na região Sul do Brasil Lucas Trevisan Gressler1; Felipe da Silva Krawczak2,3; Marcelo Knoff4; Silvia Gonzalez Monteiro1*; Marcelo Bahia Labruna2; -

Honoring the Life and Legacy of Oliver P. Pearson
PATTERNS OF SMALL MAMMAL SPECIES RICHNESS IN MEDITERRANEAN AND TEMPERATE CHILE PATRONES EN LA RIQUEZA DE ESPECIES DE PEQUEÑOS MAMÍFEROS EN LAS REGIONES MEDITERRÁNEA Y TEMPLADA DE CHILE Hernán L. Cofré, Horacio Samaniego, and Pablo A. Marquet ABSTRACT While it is widely accepted that species richness and rarity are non‑randomly distributed across time, space, and taxa, it is by no means evident which are the factors affecting the distribution paerns of both aributes. In this study we analyze richness and rarity paerns of small mammals (rodents and marsupials) in Mediterranean and Temperate Chile. We test for the effect of environmental factors that may explain richness and endemism variability aer accounting for spatial autocorrelation. We also analyze the relationship between species traits and correlates of rarity (density and range size) aer accounting for phylogenetic relatedness. Our results show that energy input and to a lesser degree glaciations may explain richness paern of small mammals from forest habitats in Chile, whereas glaciations and topographic heterogeneity are associated with endemicity paerns. Both factors may explain the high richness found at 37° S and the low values at the southernmost tip of the continent. When phylogenetic relatedness was accounted for, the number of vegetation types was the only ecological trait significantly associated with density and latitudinal range. Our results reinforce the importance of energy availability and productivity in determining paerns in biodiversity. Key words: Chile, diversity, mammals, Mantel test, rarity, macroecology, phylogenetic effects RESUMEN Si bien la idea de que la riqueza y la rareza específica tienen una distribución no aleatoria con relación al tiempo, el espacio, y la taxonomía, no es para nada evidente cuáles son los factores que afectan los patrones de distribución de aquellos dos atributos. -

Redalyc.Objective Measurement of Akodon Budini Dorsal Coloration
Anais da Academia Brasileira de Ciências ISSN: 0001-3765 [email protected] Academia Brasileira de Ciências Brasil SANDOVAL SALINAS, MARÍA L.; SANDOVAL, JOSÉ D.; COLOMBO, ELISA M. Objective measurement of Akodon budini dorsal coloration: methodological concerns Anais da Academia Brasileira de Ciências, vol. 88, núm. 1, 2016, pp. 489-502 Academia Brasileira de Ciências Rio de Janeiro, Brasil Available in: http://www.redalyc.org/articulo.oa?id=32746362006 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Anais da Academia Brasileira de Ciências (2016) 88(1 Suppl.): 489-502 (Annals of the Brazilian Academy of Sciences) Printed version ISSN 0001-3765 / Online version ISSN 1678-2690 http://dx.doi.org/10.1590/0001-3765201620150004 www.scielo.br/aabc Objective measurement of Akodon budini dorsal coloration: methodological concerns MARÍA L. SANDOVAL SALINAS1,2, JOSÉ D. SANDOVAL1,3 and ELISA M. COLOMBO1,3 1Instituto de Investigación en Luz, Ambiente y Visión/ILAV, Universidad Nacional de Tucumán/UNT-Consejo Nacional de Investigaciones Científi cas y Técnicas/CONICET, Av. Independencia, 1800, PC4000, Tucumán, Argentina 2Programa de Investigaciones de Biodiversidad Argentina/PIDBA, Facultad de Ciencias Naturales e Instituto Miguel Lillo, UNT, Miguel Lillo 205, PC4000, Tucumán, Argentina 3Departamento de Luminotecnia, Luz y Visión/DLLyV, Facultad de Ciencias Exactas y Tecnología, UNT, Av. Independencia, 1800, PC4000, Tucumán, Argentina Manuscript received on January 8, 2015; accepted for publication on March 13, 2015 ABSTRACT The role of color in taxonomic and systematic studies of several taxa is central. -

Sistemática Molecular De La Tribu Abrotrichini (Rodentia: Cricetidae)
Universidad de la República Facultad de Ciencias Sistemática molecular de la tribu Abrotrichini (Rodentia: Cricetidae) Informe de Pasantía Licenciatura en Ciencias Biológicas Profundización en Genética y Evolución Autor: Daiana Mir Orientador: Dr. Enrique P. Lessa Noviembre, 2010 Agradecimientos A Enrique P. Lessa por darme la oportunidad de realizar ésta pasantía y sobretodo porque no importando sus coordenadas geográficas, sus respuestas a mis dudas evolutivas siempre llegaron de una manera sorprendentemente rápida y amena. A mis compañeros del laboratorio,Carolina Abud la cual me brindó su ayuda desde mi primer día de laboratorio hasta hoy, Alejandro “Passer” D’Anatro muchas veces un amparo vespertino,Sabrina Riverón mas que nada por su amistad, Cecilia Da Silva por sus valiosos aportes y su elegancia de persona, Ivanna H. Tommasco (un referente) por sus imprescindibles correcciones a éste informe y su alegría contagiosa y muy especialmente a Matias Feijoo, por su aporte diario a éste trabajo, por su estímulo y fuente de confianza, por ser brújula y pilar...no hay palabras Mati, gracias. A mis amigos, por su aliento y amistad. En particular a Laura, por sus aportes a éste trabajo, pero mas que nada porque siempre me tuvo fe. A mi familia, por su eterno apoyo, paciencia y respaldo a mi carrera y a mi vida. En especial a mi madre, que me legó la pasión por el estudio y una fuerza movilizadora de montañas y miedos, sin la cual nunca hubiera llegado a ésta meta. Hay gente que estuvo durante todo el proceso, y hay otra que estuvo en etapas concretas del mismo. -

Patrones De Distribución De Micromamíferos En Gradientes Altitudinales Del Noroeste Argentino
Revista Mexicana de Biodiversidad 85: 472-490, 2014 472 Ferro y Barquez.- Gradientes de altitud y micromamíferosDOI: 10.7550/rmb.38029 en Argentina Patrones de distribución de micromamíferos en gradientes altitudinales del noroeste Argentino Distributional patterns of small mammals along elevational gradients in northwestern Argentina Ignacio Ferro1, 2 y Rubén M. Barquez1 1Programa de Investigaciones de Biodiversidad Argentina, Facultad de Ciencias Naturales e Instituto Miguel Lillo, Consejo Nacional de Investigaciones Científicas y Técnicas, Universidad Nacional de Tucumán. Miguel Lillo 255, 4000, San Miguel de Tucumán, Argentina. 2Departamento de Biología Evolutiva, Facultad de Ciencias, Universidad Nacional Autónoma de México. Apartado postal 70-399, 04510 México, D. F., México. [email protected] Resumen. Se describe la variación altitudinal de riqueza, recambio y composición de especies de micromamíferos mediante muestreos a lo largo de 4 transectos que van desde selvas a 500 m hasta los desiertos altoandinos a 4 000 m en el noroeste argentino. En general, la riqueza de micromamíferos decrece con la altitud, principalmente como consecuencia de la alta diversidad de murciélagos en las tierras bajas. En cambio, los micromamíferos terrestres mostraron un claro patrón curvilíneo de riqueza con un pico en altitudes intermedias, cerca de la línea superior de bosques a 2 700 m. Los valores máximos de los índices de recambio de especies se localizaron en el extremo superior del gradiente a 3 500 m. La composición de las comunidades de micromamíferos en cada transecto altitudinal individual fue concordante con el esquema fitogeográfico, encontrándose especies características de las selvas montanas, los bosques montanos y las estepas altoandinas. El análisis de los 4 transectos altitudinales juntos reveló que la altitud es la principal fuente de variación en la composición de especies. -

Richness, Endemism and Conservation of Sigmodontine Rodents in Argentina
Mastozoología Neotropical, 26(1):99-116, Mendoza, 2019 Copyright ©SAREM, 2019 Versión on-line ISSN 1666-0536 http://www.sarem.org.ar https://doi.org/10.31687/saremMN.19.26.1.0.17 http://www.sbmz.com.br Artículo RICHNESS, ENDEMISM AND CONSERVATION OF SIGMODONTINE RODENTS IN ARGENTINA Anahí Formoso1 and Pablo Teta2 1 Centro para el Estudio de Sistemas Marinos (CESIMAR-CENPAT-CONICET). Puerto Madryn, Chubut, Argentina. 2 División Mastozoología, Museo Argentino de Ciencias Naturales “Bernardino Rivadavia” Buenos Aires, Argentina. [Correspondence: Pablo Teta <[email protected]>] ABSTRACT. Sigmodontine rodents, with 86 genera and ~430 living species, constitute one of the most successful radiations of Neotropical mammals. In this contribution, we studied the distributional ranges of 108 sigmodontine species in Argentina. Our objectives were (i) to establish geographical patterns of species richness and endemism, and (ii) to evaluate the regional conservation status of these taxa. We constructed a minimum convex polygon for each species, using information from literature and biological collections. Individual maps were superimposed on a map of Argentina divided into cells of 25 km on each side. For each cell, we calculated the species rich- ness, which varied between 1 and 21 species, and its degree of endemism, which fluctuated between 0.001 and 3.28. There were 30 species of sigmodontine rodents distributed almost exclusively in Argentina, most of them restricted to forested areas (Southern Andean Yungas) or to arid and semiarid environments (High and Low Monte and Patagonian Steppe). Areas with high species richness and endemism scores corresponded grossly with the Southern Andean Yungas, the Humid Chaco plus the Paraná flooded savannas, the Alto Parana Atlantic forests plus the Araucaria moist forests, the High Monte and the ecotone between the Patagonian steppe and the Valdivian temperate forests.