Sinopsis De Los Mamíferos Silvestres Del Estado De Guanajuato, México, Y Comentarios Sobre Su Conservación Óscar Sánchez 369
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Redalyc.Mamíferos No Voladores De Guanajuato, México: Revisión
Acta Universitaria ISSN: 0188-6266 [email protected] Universidad de Guanajuato México Sánchez, Óscar; Magaña-Cota, Gloria; Téllez-Girón, Guadalupe; López-Forment, William; Urbano Vidales, Guillermina Mamíferos no voladores de Guanajuato, México: revisión histórica y lista taxonómica actualizada Acta Universitaria, vol. 24, núm. 1, enero-febrero, 2014, pp. 3-37 Universidad de Guanajuato Guanajuato, México Disponible en: http://www.redalyc.org/articulo.oa?id=41630112001 Cómo citar el artículo Número completo Sistema de Información Científica Más información del artículo Red de Revistas Científicas de América Latina, el Caribe, España y Portugal Página de la revista en redalyc.org Proyecto académico sin fines de lucro, desarrollado bajo la iniciativa de acceso abierto Universidad de Guanajuato Mamíferos no voladores de Guanajuato, México: revisión histórica y lista taxonómica actualizada Non-volant mammals of Guanajuato, Mexico: historic review and updated taxonomic list Óscar Sánchez*, Gloria Magaña-Cota**, Guadalupe Téllez-Girón*, William López-Forment***, Guillermina Urbano Vidales**** RESUMEN Se hace una revisión de los mamíferos no voladores del estado de Guanajuato, desarrolla- da principalmente con una perspectiva histórica y de actualización taxonómica, con base en publicaciones especializadas. Se revisó literatura científica desde el siglo XIX hasta el 2012. Asimismo, se consideró información sobre diversos ejemplares de museos, tanto nacionales como del extranjero, lo que permitió una visión de conjunto de las especies. Con la información reunida se elaboró un breve diagnóstico del estado del conocimiento de los mamíferos no voladores de Guanajuato y se identificaron necesidades de estudio adicional. Se provee una lista actualizada de las especies de mamíferos no voladores del estado, que hasta el momento cuenta con 62 especies. -

Special Publications Museum of Texas Tech University Number 63 18 September 2014
Special Publications Museum of Texas Tech University Number 63 18 September 2014 List of Recent Land Mammals of Mexico, 2014 José Ramírez-Pulido, Noé González-Ruiz, Alfred L. Gardner, and Joaquín Arroyo-Cabrales.0 Front cover: Image of the cover of Nova Plantarvm, Animalivm et Mineralivm Mexicanorvm Historia, by Francisci Hernández et al. (1651), which included the first list of the mammals found in Mexico. Cover image courtesy of the John Carter Brown Library at Brown University. SPECIAL PUBLICATIONS Museum of Texas Tech University Number 63 List of Recent Land Mammals of Mexico, 2014 JOSÉ RAMÍREZ-PULIDO, NOÉ GONZÁLEZ-RUIZ, ALFRED L. GARDNER, AND JOAQUÍN ARROYO-CABRALES Layout and Design: Lisa Bradley Cover Design: Image courtesy of the John Carter Brown Library at Brown University Production Editor: Lisa Bradley Copyright 2014, Museum of Texas Tech University This publication is available free of charge in PDF format from the website of the Natural Sciences Research Laboratory, Museum of Texas Tech University (nsrl.ttu.edu). The authors and the Museum of Texas Tech University hereby grant permission to interested parties to download or print this publication for personal or educational (not for profit) use. Re-publication of any part of this paper in other works is not permitted without prior written permission of the Museum of Texas Tech University. This book was set in Times New Roman and printed on acid-free paper that meets the guidelines for per- manence and durability of the Committee on Production Guidelines for Book Longevity of the Council on Library Resources. Printed: 18 September 2014 Library of Congress Cataloging-in-Publication Data Special Publications of the Museum of Texas Tech University, Number 63 Series Editor: Robert J. -

Advances in Cytogenetics of Brazilian Rodents: Cytotaxonomy, Chromosome Evolution and New Karyotypic Data
COMPARATIVE A peer-reviewed open-access journal CompCytogenAdvances 11(4): 833–892 in cytogenetics (2017) of Brazilian rodents: cytotaxonomy, chromosome evolution... 833 doi: 10.3897/CompCytogen.v11i4.19925 RESEARCH ARTICLE Cytogenetics http://compcytogen.pensoft.net International Journal of Plant & Animal Cytogenetics, Karyosystematics, and Molecular Systematics Advances in cytogenetics of Brazilian rodents: cytotaxonomy, chromosome evolution and new karyotypic data Camilla Bruno Di-Nizo1, Karina Rodrigues da Silva Banci1, Yukie Sato-Kuwabara2, Maria José de J. Silva1 1 Laboratório de Ecologia e Evolução, Instituto Butantan, Avenida Vital Brazil, 1500, CEP 05503-900, São Paulo, SP, Brazil 2 Departamento de Genética e Biologia Evolutiva, Instituto de Biociências, Universidade de São Paulo, Rua do Matão 277, CEP 05508-900, São Paulo, SP, Brazil Corresponding author: Maria José de J. Silva ([email protected]) Academic editor: A. Barabanov | Received 1 August 2017 | Accepted 23 October 2017 | Published 21 December 2017 http://zoobank.org/203690A5-3F53-4C78-A64F-C2EB2A34A67C Citation: Di-Nizo CB, Banci KRS, Sato-Kuwabara Y, Silva MJJ (2017) Advances in cytogenetics of Brazilian rodents: cytotaxonomy, chromosome evolution and new karyotypic data. Comparative Cytogenetics 11(4): 833–892. https://doi. org/10.3897/CompCytogen.v11i4.19925 Abstract Rodents constitute one of the most diversified mammalian orders. Due to the morphological similarity in many of the groups, their taxonomy is controversial. Karyotype information proved to be an important tool for distinguishing some species because some of them are species-specific. Additionally, rodents can be an excellent model for chromosome evolution studies since many rearrangements have been described in this group.This work brings a review of cytogenetic data of Brazilian rodents, with information about diploid and fundamental numbers, polymorphisms, and geographical distribution. -

The Neotropical Region Sensu the Areas of Endemism of Terrestrial Mammals
Australian Systematic Botany, 2017, 30, 470–484 ©CSIRO 2017 doi:10.1071/SB16053_AC Supplementary material The Neotropical region sensu the areas of endemism of terrestrial mammals Elkin Alexi Noguera-UrbanoA,B,C,D and Tania EscalanteB APosgrado en Ciencias Biológicas, Unidad de Posgrado, Edificio A primer piso, Circuito de Posgrados, Ciudad Universitaria, Universidad Nacional Autónoma de México (UNAM), 04510 Mexico City, Mexico. BGrupo de Investigación en Biogeografía de la Conservación, Departamento de Biología Evolutiva, Facultad de Ciencias, Universidad Nacional Autónoma de México (UNAM), 04510 Mexico City, Mexico. CGrupo de Investigación de Ecología Evolutiva, Departamento de Biología, Universidad de Nariño, Ciudadela Universitaria Torobajo, 1175-1176 Nariño, Colombia. DCorresponding author. Email: [email protected] Page 1 of 18 Australian Systematic Botany, 2017, 30, 470–484 ©CSIRO 2017 doi:10.1071/SB16053_AC Table S1. List of taxa processed Number Taxon Number Taxon 1 Abrawayaomys ruschii 55 Akodon montensis 2 Abrocoma 56 Akodon mystax 3 Abrocoma bennettii 57 Akodon neocenus 4 Abrocoma boliviensis 58 Akodon oenos 5 Abrocoma budini 59 Akodon orophilus 6 Abrocoma cinerea 60 Akodon paranaensis 7 Abrocoma famatina 61 Akodon pervalens 8 Abrocoma shistacea 62 Akodon philipmyersi 9 Abrocoma uspallata 63 Akodon reigi 10 Abrocoma vaccarum 64 Akodon sanctipaulensis 11 Abrocomidae 65 Akodon serrensis 12 Abrothrix 66 Akodon siberiae 13 Abrothrix andinus 67 Akodon simulator 14 Abrothrix hershkovitzi 68 Akodon spegazzinii 15 Abrothrix illuteus -
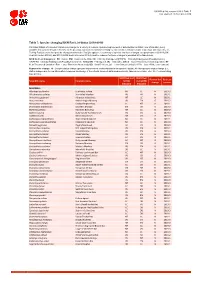
Table 7: Species Changing IUCN Red List Status (2018-2019)
IUCN Red List version 2019-3: Table 7 Last Updated: 10 December 2019 Table 7: Species changing IUCN Red List Status (2018-2019) Published listings of a species' status may change for a variety of reasons (genuine improvement or deterioration in status; new information being available that was not known at the time of the previous assessment; taxonomic changes; corrections to mistakes made in previous assessments, etc. To help Red List users interpret the changes between the Red List updates, a summary of species that have changed category between 2018 (IUCN Red List version 2018-2) and 2019 (IUCN Red List version 2019-3) and the reasons for these changes is provided in the table below. IUCN Red List Categories: EX - Extinct, EW - Extinct in the Wild, CR - Critically Endangered [CR(PE) - Critically Endangered (Possibly Extinct), CR(PEW) - Critically Endangered (Possibly Extinct in the Wild)], EN - Endangered, VU - Vulnerable, LR/cd - Lower Risk/conservation dependent, NT - Near Threatened (includes LR/nt - Lower Risk/near threatened), DD - Data Deficient, LC - Least Concern (includes LR/lc - Lower Risk, least concern). Reasons for change: G - Genuine status change (genuine improvement or deterioration in the species' status); N - Non-genuine status change (i.e., status changes due to new information, improved knowledge of the criteria, incorrect data used previously, taxonomic revision, etc.); E - Previous listing was an Error. IUCN Red List IUCN Red Reason for Red List Scientific name Common name (2018) List (2019) change version Category -

A New Species of Molinema (Nematoda: Onchocercidae) in Bolivian Rodents and Emended Description of Litomosoides Esslingeri Bain, Petit, and Diagne, 1989
University of Nebraska - Lincoln DigitalCommons@University of Nebraska - Lincoln Faculty Publications from the Harold W. Manter Laboratory of Parasitology Parasitology, Harold W. Manter Laboratory of 2012 A New Species of Molinema (Nematoda: Onchocercidae) in Bolivian Rodents and Emended Description of Litomosoides esslingeri Bain, Petit, and Diagne, 1989 Juliana Notarnicola CEPAVE, [email protected] F. Agustin Jimenez Ruiz Southern Illinois University Carbondale, [email protected] Scott Lyell Gardner University of Nebraska - Lincoln, [email protected] Follow this and additional works at: https://digitalcommons.unl.edu/parasitologyfacpubs Part of the Other Animal Sciences Commons, Parasitology Commons, and the Zoology Commons Notarnicola, Juliana; Jimenez Ruiz, F. Agustin; and Gardner, Scott Lyell, "A New Species of Molinema (Nematoda: Onchocercidae) in Bolivian Rodents and Emended Description of Litomosoides esslingeri Bain, Petit, and Diagne, 1989" (2012). Faculty Publications from the Harold W. Manter Laboratory of Parasitology. 752. https://digitalcommons.unl.edu/parasitologyfacpubs/752 This Article is brought to you for free and open access by the Parasitology, Harold W. Manter Laboratory of at DigitalCommons@University of Nebraska - Lincoln. It has been accepted for inclusion in Faculty Publications from the Harold W. Manter Laboratory of Parasitology by an authorized administrator of DigitalCommons@University of Nebraska - Lincoln. J. Parasitol., 98(6), 2012, pp. 1200–1208 Ó American Society of Parasitologists 2012 A NEW SPECIES OF MOLINEMA (NEMATODA: ONCHOCERCIDAE) IN BOLIVIAN RODENTS AND EMENDED DESCRIPTION OF LITOMOSOIDES ESSLINGERI BAIN, PETIT, AND DIAGNE, 1989 Juliana Notarnicola, F. Agust´ın Jimenez´ *, and Scott L. Gardner† Centro de Estudios Parasitologicos´ y de Vectores –CEPAVE –CCT La Plata- CONICET, Calle 2 # 584 (1900) La Plata, Argentina. -

Richness, Endemism and Conservation of Sigmodontine Rodents in Argentina
Mastozoología Neotropical, 26(1):99-116, Mendoza, 2019 Copyright ©SAREM, 2019 Versión on-line ISSN 1666-0536 http://www.sarem.org.ar https://doi.org/10.31687/saremMN.19.26.1.0.17 http://www.sbmz.com.br Artículo RICHNESS, ENDEMISM AND CONSERVATION OF SIGMODONTINE RODENTS IN ARGENTINA Anahí Formoso1 and Pablo Teta2 1 Centro para el Estudio de Sistemas Marinos (CESIMAR-CENPAT-CONICET). Puerto Madryn, Chubut, Argentina. 2 División Mastozoología, Museo Argentino de Ciencias Naturales “Bernardino Rivadavia” Buenos Aires, Argentina. [Correspondence: Pablo Teta <[email protected]>] ABSTRACT. Sigmodontine rodents, with 86 genera and ~430 living species, constitute one of the most successful radiations of Neotropical mammals. In this contribution, we studied the distributional ranges of 108 sigmodontine species in Argentina. Our objectives were (i) to establish geographical patterns of species richness and endemism, and (ii) to evaluate the regional conservation status of these taxa. We constructed a minimum convex polygon for each species, using information from literature and biological collections. Individual maps were superimposed on a map of Argentina divided into cells of 25 km on each side. For each cell, we calculated the species rich- ness, which varied between 1 and 21 species, and its degree of endemism, which fluctuated between 0.001 and 3.28. There were 30 species of sigmodontine rodents distributed almost exclusively in Argentina, most of them restricted to forested areas (Southern Andean Yungas) or to arid and semiarid environments (High and Low Monte and Patagonian Steppe). Areas with high species richness and endemism scores corresponded grossly with the Southern Andean Yungas, the Humid Chaco plus the Paraná flooded savannas, the Alto Parana Atlantic forests plus the Araucaria moist forests, the High Monte and the ecotone between the Patagonian steppe and the Valdivian temperate forests. -

Description of a New Species Physaloptera Goytaca N. Sp
Parasitology Research https://doi.org/10.1007/s00436-018-5964-x ORIGINAL PAPER Description of a new species Physaloptera goytaca n. sp. (Nematoda, Physalopteridae) from Cerradomys goytaca Tavares, Pessôa & Gonçalves, 2011 (Rodentia, Cricetidae) from Brazil Nicole Brand Ederli1 & Samira Salim Mello Gallo2 & Luana Castro Oliveira2 & Francisco Carlos Rodrigues de Oliveira2 Received: 7 May 2018 /Accepted: 7 June 2018 # Springer-Verlag GmbH Germany, part of Springer Nature 2018 Abstract Nematodes of the genus Physaloptera are common in rodents, including in species of the Family Cricetidae. There is no report of nematodes parasitizing Cerradomys goytaca, so this is the first one. For this study, 16 rodents were captured in the city of Quissamã, in the northern of Rio de Janeiro State. The rodents were necropsied, and the digestive tracts were analyzed under a stereomicroscope for the presence of parasites. The nematodes were fixed in hot AFA, clarified in Amann’s lactophenol, mounted on slides with coverslip, and observed under an optical microscope. Part of the nematodes was fixed in Karnovisk solution for scanning electron microscopy. Nematodes presented evident sexual dimorphism. Oral openings had two semicircular pseudolabia, with an external lateral tooth and an internal lateral tripartite tooth on each pseudolabium. Males had a ventral spiral curved posterior ends with the presence of a caudal alae with 21 papillae with four pairs of pedunculated papillae arranged laterally, three pre-cloacal sessile papillae arranged rectilinearly and five pairs of post-cloacal sessile papillae. There was also a pair of phasmids located between the fourth and fifth pairs of post-cloacal papillae as well as two spicules that were sub-equal in size but of distinct shapes. -

Diversidad Y Endemismo De Los Mamíferos Del Perú
Rev. peru. biol. 16(1): 005- 032 (Agosto 2009) © Facultad de Ciencias Biológicas UNMSM DiversidadVersión de los Online mamíferos ISSN 1727-9933 del Perú Diversidad y endemismo de los mamíferos del Perú Diversity and endemism of Peruvian mammals Víctor Pacheco1, 2, Richard Cadenillas1, Edith Salas1, Carlos Tello1 y Horacio Zeballos3 1 Museo de Historia Natural, Uni- versidad Nacional Mayor de San Resumen Marcos, Apartado 14-0434, Lima- 14, Perú. Email Víctor Pacheco: Se presenta una lista comentada de los mamíferos terrestres, acuáticos y marinos nativos de Perú, incluy- [email protected] endo sus nombres comunes, la distribución por ecorregiones y los estados de amenaza según la legislación 2 Facultad de Ciencias Biológicas, nacional vigente y algunos organismos internacionales. Se documenta 508 especies nativas, en 13 órdenes, Universidad Nacional Mayor de 50 familias y 218 géneros; resultando el Perú como el tercer país con la mayor diversidad de especies en el San Marcos. Nuevo Mundo después de Brasil y México, así como quinto en el mundo. Esta diversidad incluye a 40 didelfi- 3 Centro de Estudios y Promoción del Desarrollo, DESCO, Málaga morfos, 2 paucituberculados, 1 sirenio, 6 cingulados, 7 pilosos, 39 primates, 162 roedores, 1 lagomorfo, 2 Grenet 678, Umacollo, Arequipa. soricomorfos, 165 quirópteros, 34 carnívoros, 2 perisodáctilos y 47 cetartiodáctilos. Los roedores y murciélagos (327 especies) representan casi las dos terceras partes de la diversidad (64%). Cinco géneros y 65 especies (12,8%) son endémicos para Perú, siendo la mayoría de ellos roedores (45 especies, 69,2%). La mayoría de especies endémicas se encuentra restringida a las Yungas de la vertiente oriental de los Andes (39 especies, 60%) seguida de lejos por la Selva Baja (14 especies, 21,5%). -

Álvarez, T., S. T. Álvarez-Castañeda, Y M. González Escamilla. 1997
4 Alvarez, Alvarez-Castañeda y González-Escamilla Indice 5 6 Alvarez, Alvarez-Castañeda y González-Escamilla INDICE Introducción ......................................................................................................................7 Relación de especies descritas y localidades típicas ......................................................11 Orden Didelphiomorphia.........................................................................................11 Familia Didelphidae ........................................................................................11 Familia Marmosidae........................................................................................11 Orden Insectivora ....................................................................................................12 Familia Soricidae.............................................................................................12 Familia Talpidae..............................................................................................14 Orden Chiroptera .....................................................................................................14 Familia Emballonuridae..................................................................................14 Familia Noctilionidae......................................................................................15 Familia Mormoopidae.....................................................................................15 Familia Phyllostomidae...................................................................................15 -

Assemblages of Bird and Mammal Communities in Two Major Ecological Units of the Andean Highland Plateau of Southern Peru
Ecología Aplicada, 6(1,2), 2007 Presentado: 05/07/2007 ISSN 1726-2216 Aceptado: 08/12/2007 Depósito legal 2002-5474 © Departamento Académico de Biología, Universidad Nacional Agraria La Molina, Lima – Perú. ASSEMBLAGES OF BIRD AND MAMMAL COMMUNITIES IN TWO MAJOR ECOLOGICAL UNITS OF THE ANDEAN HIGHLAND PLATEAU OF SOUTHERN PERU ESTRUCTURA DE LAS COMUNIDADES DE AVES Y MAMÍFEROS EN DOS UNIDADES ECOLÓGICAS DE LOS ANDES DEL SUR DEL PERÚ Oswaldo Ramirez1, Margarita Arana1, Enrique Bazán1, Angel Ramirez2 y Asunción Cano2 Abstract Grasslands in the Andean highlands plateau of southern Peru have been considered as a single and homogeneous dry habitat also known as Puna. However, in some regions, a highest rainfall regimen is found, and the name of wet puna has begun to be used by some authors. Since no studies have been carrying out specifically to test if dry and wet puna are different ecological units, we chose two representative localities of each one of these habitat to evaluate assemblages of bird and mammal communities and their continuity or independence between these apparently similar habitats. Our results suggest that wet puna has different mammal diversity than dry puna, and a heterogeneous bird community with species that have been previously reported exclusively in paramo or exclusively in puna. In spite of the apparent uniform flora in the Andean highlands of South Peru, data suggest that rainfall regimens produce a mosaic of habitats that will be determining ecological barriers for terrestrial mammals, in particular for small mammals. Key words: Andean grasslands, Andean plateau, Cuzco, Oriental Cordillera, paramo, puna, Puno. Resumen Los Pajonales de los Andes del sur del Perú, también conocidos como Puna, son considerados como hábitats homogéneos y secos. -

Padrão De Variação Intra E Intergenérica Na Estrutura Proteica Do Citocromo B Em Oito Gêneros De Oryzomyini (Rodentia)
UNIVERDADE FEDERAL DO ESPÍRITO SANTO CENTRO DE CIÊNCIAS HUMANAS E NATURAIS PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS Padrão de variação intra e intergenérica na estrutura proteica do Citocromo b em oito gêneros de Oryzomyini (Rodentia) Eduardo Loyola Muhl Vitória, ES Fevereiro, 2017 UNIVERDADE FEDERAL DO ESPÍRITO SANTO CENTRO DE CIÊNCIAS HUMANAS E NATURAIS PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS Padrão de variação intra e intergenérica na estrutura proteica do Citocromo b em oito gêneros de Oryzomyini (Rodentia) Eduardo Loyola Muhl Orientadora: Valéria Fagundes Dissertação submetida ao Programa de Pós-Graduação em Ciências Biológicas (Biologia Animal) da Universidade Federal do Espírito Santo como requisito parcial para a obtrenção do grau de Mestre em Biologia Animal Vitória, ES Fevereiro, 2017 AGRADECIMENTOS Expresso meus sinceros agradecimentos a todos que ajudaram na conclusão desta jornada. Agradeço a Profª. Drª. Valéria Fagundes, que me abriu as portas do Laboratório de Genética Animal ainda na gradução me acolhendo novamente como aluno de mestrado. Sua postura, amizade, companherismo e conselhos vem me mostrando ao longo desses anos como me tornar um profissional melhor, e acima de tudo, uma pessoa melhor, estando sempre presente nos momentos de maiores dificuldades em minha carreira. Muito obrigado. Ao Prof. Dr. Arlan da Silva Gonçalves (IFES/Vila Velha), que compartilhou seu vasto conhecimento em metodologias de modelagem proteica, que foram cruciais para a realização do presente estudo. Ao Prof. Dr. Rinaldo Wander Montalvao (PUC/RS) por ter me recebido em seu laboratório e me auxiliado em diferentes análises e discussões dos dados, contribuindo em muito para a finalização deste trabalho.