Fracasso Carlamagioni D.Pdf
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Late-Acting Self-Incompatible System, Preferential Allogamy and Delayed Selfing in The
bioRxiv preprint doi: https://doi.org/10.1101/2021.07.15.452457; this version posted July 15, 2021. The copyright holder for this preprint (which was not certified by peer review) is the author/funder. All rights reserved. No reuse allowed without permission. 1 Late-acting self-incompatible system, preferential allogamy and delayed selfing in the 2 heterostylous invasive populations of Ludwigia grandiflora subsp. hexapetala 3 4 Luis O. PORTILLO LEMUS1, Marilyne HARANG1, Michel BOZEC1, Jacques HAURY1, Solenn 5 STOECKEL2, Dominique BARLOY1 6 Short title: Mixed mating system in a European invasive Ludwigia 7 1 ESE, Ecology and Ecosystem Health, Institut Agro, INRAE, 35042, Rennes, France 8 2 IGEPP, INRAE, Institut Agro, Univ Rennes, 35653, Le Rheu, France 9 Corresponding author: [email protected] 10 Orcid number: 11 Luis O. PORTILLO LEMUS: 0000-0003-2123-4714 12 Jacques HAURY: 0000-0002-8628-8265 13 Solenn STOECKEL: 0000-0001-6064-5941 14 Dominique BARLOY: 0000-0001-5810-4871 15 16 17 Abstract 18 Mating system influences local population genetic structure, effective size, offspring 19 fitness and functional variation. Determining the respective importance of self- and cross- 20 fertilization in hermaphroditic flowering plants is thus important to understand their ecology 21 and evolution. The worldwide invasive species, Ludwigia grandiflora subsp. hexapetala (Lgh) 22 presents two floral morphs: one self-compatible short-styled morph (S-morph) and one self- bioRxiv preprint doi: https://doi.org/10.1101/2021.07.15.452457; this version posted July 15, 2021. The copyright holder for this preprint (which was not certified by peer review) is the author/funder. -

V1 Appendix H Biological Resources (PDF)
Appendix H Biological Resources Data H1 Botanical Survey Report 2015–2017 H2 Animal Species Observed within the Study Area for the Squaw-Alpine Base to Base Gondola Project H3 California Natural Diversity Database Results H4 USDA Forest Service Sensitive Animal Species by Forest H5 USFWS IPaC Resource List H1 Botanical Survey Report 2015–2017 ´ Í SCIENTIFIC & REGULATORY SERVICES, INC. Squaw Valley - Alpine Meadows Interconnect Project Botanical Survey Report 2015-2017 Prepared by: EcoSynthesis Scientific & Regulatory Services, Inc. Prepared for: Ascent Environmental Date: December 18, 2017 16173 Lancaster Place, Truckee, CA 96161 • Telephone: 530.412.1601 • E-mail: [email protected] EcoSynthesis scientific & regulatory services, inc. Table of Contents 1 Summary ............................................................................................................................................... 1 1.1 Site and Survey Details ...................................................................................................................................... 1 1.2 Summary of Results ............................................................................................................................................ 1 2 Introduction ......................................................................................................................................... 2 2.1 Site Location and Setting ................................................................................................................................. -
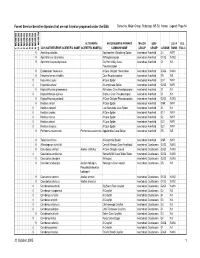
Sensitive Species That Are Not Listed Or Proposed Under the ESA Sorted By: Major Group, Subgroup, NS Sci
Forest Service Sensitive Species that are not listed or proposed under the ESA Sorted by: Major Group, Subgroup, NS Sci. Name; Legend: Page 94 REGION 10 REGION 1 REGION 2 REGION 3 REGION 4 REGION 5 REGION 6 REGION 8 REGION 9 ALTERNATE NATURESERVE PRIMARY MAJOR SUB- U.S. N U.S. 2005 NATURESERVE SCIENTIFIC NAME SCIENTIFIC NAME(S) COMMON NAME GROUP GROUP G RANK RANK ESA C 9 Anahita punctulata Southeastern Wandering Spider Invertebrate Arachnid G4 NNR 9 Apochthonius indianensis A Pseudoscorpion Invertebrate Arachnid G1G2 N1N2 9 Apochthonius paucispinosus Dry Fork Valley Cave Invertebrate Arachnid G1 N1 Pseudoscorpion 9 Erebomaster flavescens A Cave Obligate Harvestman Invertebrate Arachnid G3G4 N3N4 9 Hesperochernes mirabilis Cave Psuedoscorpion Invertebrate Arachnid G5 N5 8 Hypochilus coylei A Cave Spider Invertebrate Arachnid G3? NNR 8 Hypochilus sheari A Lampshade Spider Invertebrate Arachnid G2G3 NNR 9 Kleptochthonius griseomanus An Indiana Cave Pseudoscorpion Invertebrate Arachnid G1 N1 8 Kleptochthonius orpheus Orpheus Cave Pseudoscorpion Invertebrate Arachnid G1 N1 9 Kleptochthonius packardi A Cave Obligate Pseudoscorpion Invertebrate Arachnid G2G3 N2N3 9 Nesticus carteri A Cave Spider Invertebrate Arachnid GNR NNR 8 Nesticus cooperi Lost Nantahala Cave Spider Invertebrate Arachnid G1 N1 8 Nesticus crosbyi A Cave Spider Invertebrate Arachnid G1? NNR 8 Nesticus mimus A Cave Spider Invertebrate Arachnid G2 NNR 8 Nesticus sheari A Cave Spider Invertebrate Arachnid G2? NNR 8 Nesticus silvanus A Cave Spider Invertebrate Arachnid G2? NNR -

ICBEMP Analysis of Vascular Plants
APPENDIX 1 Range Maps for Species of Concern APPENDIX 2 List of Species Conservation Reports APPENDIX 3 Rare Species Habitat Group Analysis APPENDIX 4 Rare Plant Communities APPENDIX 5 Plants of Cultural Importance APPENDIX 6 Research, Development, and Applications Database APPENDIX 7 Checklist of the Vascular Flora of the Interior Columbia River Basin 122 APPENDIX 1 Range Maps for Species of Conservation Concern These range maps were compiled from data from State Heritage Programs in Oregon, Washington, Idaho, Montana, Wyoming, Utah, and Nevada. This information represents what was known at the end of the 1994 field season. These maps may not represent the most recent information on distribution and range for these taxa but it does illustrate geographic distribution across the assessment area. For many of these species, this is the first time information has been compiled on this scale. For the continued viability of many of these taxa, it is imperative that we begin to manage for them across their range and across administrative boundaries. Of the 173 taxa analyzed, there are maps for 153 taxa. For those taxa that were not tracked by heritage programs, we were not able to generate range maps. (Antmnnrin aromatica) ( ,a-’(,. .e-~pi~] i----j \ T--- d-,/‘-- L-J?.,: . ey SAP?E%. %!?:,KnC,$ESS -,,-a-c--- --y-- I -&zII~ County Boundaries w1. ~~~~ State Boundaries <ii&-----\ \m;qw,er Columbia River Basin .---__ ,$ 4 i- +--pa ‘,,, ;[- ;-J-k, Assessment Area 1 /./ .*#a , --% C-p ,, , Suecies Locations ‘V 7 ‘\ I, !. / :L __---_- r--j -.---.- Columbia River Basin s-5: ts I, ,e: I’ 7 j ;\ ‘-3 “. -
Southwest Idaho's Flora Goes Global: The
Vol. 37 No. 2 June 2015 Newsletter of the Idaho Native Plant Society Promoting Interest in Idaho’s Native Flora Southwest Idaho’s Flora Goes Global: The SWITCH Digitization Project By Alexa DiNicola, SRP Botanical Database Supervisor Every discipline needs its primary how to access and use them. Even scientists sources. Journalists interview the people actu- had trouble getting the right data from the right ally involved in events, and transcribe the re- places. Fortunately, the digital revolution has sults; geologists examine actual rock forma- changed all that: herbaria all over the world tions, and catalogue small pieces for later have started digitizing their collections, creat- study; and botanists study the living plants ing searchable databases full of high- themselves, and record them for later in the resolution photographs and specimen data. form of herbarium specimens. Each specimen Once a herbarium puts its database online, is a plant (or several smaller ones, or part of a anyone, anywhere, can dive into its wealth of large one), pressed flat, dried, and mounted botanical information: all it takes is a browser on paper. That may not sound like much, but a and an Internet connection. sizeable herbarium may have tens of thou- In southwest Idaho, the drive to digitize sands, even millions of specimens – and in the took the form of a project called SWITCH aggregate, they’re powerful. Botanists use (SouthWest Idaho: The Comprehensive Her- them to identify plants, get DNA samples, and barium). It began in 2011, with the goal of reconstruct whole vanished ecosystems. bringing its region’s best collections to the They’re also useful to ecologists, zoologists, Internet and the wider world; four years and anthropologists, archaeologists, geologists, over 160,000 specimens later, it will finish this materials scientists… and anyone who’s ever July. -

Wildflower Hot Spots of the Eastern Sierra Welcome to the Eastern Sierra…
Wildflower Hot Spots of the Eastern Sierra Welcome to the Eastern Sierra… THE EASTERN SIERRA truly is a land of superlatives: Elevations you will visit using this guide range from the oldest living trees on the planet (bristlecone pines); 3,300 feet (1,005 meters) at Fossil Falls to 10,200 feet the highest peak in the contiguous United States (Mt. (3,100 meters) at the Mosquito Flat trailhead in Rock Whitney); the youngest mountain range in North Creek. Many of the peaks around you soar to more than America (Mono Craters); one of the oldest lakes in 13,000 feet, and a side trip into Death Valley will plunge North America (Mono Lake). All of these and more are you down to below sea level at Badwater. within an easy day’s drive of each other. The spectacular landscapes of this area draw a worldwide audience, and with good reason. The elevation range combined with the diverse geologic environment results in a wide variety of vegetation communities. Three major biotic provinces—the Mojave Geology field classes often visit the area for the Desert, Great Basin, and Sierra Nevada—all converge in relatively easy access to a wide variety of geologic this area. Dozens of plant communities and thousands formations and rock types. Volcanic craters, basalt flows, of plant species occur here, many of them unique to layers of ash and pumice, carbonate formations, and the Eastern Sierra. This guide is an introduction to the granite peaks, walls, and spires all can be seen here. botanical gems to be encountered here. -

Unitedstatesdepartment
UNITED STATES DEPARTMENT OF AGRICULTURE FOREST SERVICE TAHOE NATIONAL FOREST BIOLOGICAL EVALUATION – BIOLOGICAL ASSESSMENT OF BOTANICAL SPECIES Squaw Valley | Alpine Meadows Base-to-Base Gondola Project April 27, 2018 Prepared by: _________________________________ Date: ________________ Tammie Beyerl, Botanist, Ascent Environmental Reviewed by: _________________________________ Date: ________________ Susan Urie, Tahoe National Forest Zone Botanist SUMMARY OF EFFECTS Botanists conducted literature review, database searches, and review of Forest Service species lists to identify potentially occurring species, conducted protocol-level botanical surveys and habitat assessment, and evaluated the potential for the project alternatives to affect threatened, endangered, and sensitive plant. A No Impacts determination was made for seven species because they were determined to be absent from the study area. Eight other species were also not found in the study area; however, these species are difficult to find because they seldom produce sporophytes, the above-ground parts that allow these species to be identified, and they are all very small and easy to miss even when they do produce above-ground parts. Because absence of Bolander’s candle moss, upswept moonwort, scalloped moonwort, common moonwort, Mingan moonwort, western goblin, Bandow’s bog moss, and Santa Lucia dwarf-rush could not be confirmed, the project could affect a minimal amount of potential habitat for these Forest Service sensitive plant species. Table i summarizes effect determinations for the Squaw-Valley | Alpine Meadows Base-to-Base Gondola Project alternatives on Candidate and Sensitive Species for the Tahoe National Forest that were determined to have potential to occur in the study area as presented in Section 5, Effects of the Proposed Project. -

Vascular Flora of the Upper Rock Creek Watershed, Eastern Sierra Nevada, California Joy D
Aliso: A Journal of Systematic and Evolutionary Botany Volume 36 | Issue 2 Article 2 2019 Vascular Flora of the Upper Rock Creek Watershed, Eastern Sierra Nevada, California Joy D. England Rancho Santa Ana Botanic Garden, Claremont, CA Follow this and additional works at: https://scholarship.claremont.edu/aliso Part of the Botany Commons Recommended Citation England, Joy D. (2019) "Vascular Flora of the Upper Rock Creek Watershed, Eastern Sierra Nevada, California," Aliso: A Journal of Systematic and Evolutionary Botany: Vol. 36: Iss. 2, Article 2. Available at: https://scholarship.claremont.edu/aliso/vol36/iss2/2 Aliso, 36(2), pp. 47–81 ISSN: 0065-6275 (print), 2327-2929 (online) VASCULAR FLORA OF THE UPPER ROCK CREEK WATERSHED, EASTERN SIERRA NEVADA, CALIFORNIA Joy D. England Rancho Santa Ana Botanic Garden and Claremont Graduate University, 1500 N. College Avenue, Claremont, California 91711 ([email protected]) abstract The upper Rock Creek watershed is located on the east slope of the Sierra Nevada in Inyo and Mono counties. It is ca. 36.5 square miles (94.5 square km) in area and varies in elevation from 7360 to 13,750 ft (2243 to 4191 m). Quaternary glacial erosion and deposition produced striking landscape features, including alpine fellfields and numerous small lakes. Previous floristic inventories in Rock Creek recorded acombined 396 minimum-rank taxa (species, subspecies, varieties, named hybrids) but were restricted to Little Lakes Valley and the surrounding high areas. An updated, annotated checklist of vascular plants is presented, based on preexisting specimens and new collections. I conducted intensive fieldwork from 2012 through 2016, resulting in 1506 collections (including two collections from a brief 2018 visit). -

Instituto Tecnológico De Costa Rica Escuela De Biología
View metadata, citation and similar papers at core.ac.uk brought to you by CORE provided by Repositorio Institucional del Instituto Tecnologico de Costa Rica Instituto Tecnológico de Costa Rica Escuela de Biología NovaFlora Inc. Compatibilidad sexual en cruces intraespecíficos e interespecíficos de Penstemon Informe para optar por el título de Ingeniería en Biotecnología con el grado académico de Bachiller. Agustín Víquez Zamora Cartago Junio, 2010 COMPATIBILIDAD SEXUAL EN CRUCES INTRAESPECÍFICOS E INTERESPECÍFICOS DEL GÉNERO PENSTEMON Agustín Víquez Zamora* RESUMEN La industria moderna de plantas ornamentales se describe como un negocio sofisticado, de alta inversión, que se ha llegado a posicionar como un bien de gran valor económico en el comercio mundial, desarrollándose bajo un escenario dinámico y sumamente competitivo. El presente estudio tuvo como objetivo general determinar la compatibilidad sexual de cruces intra- e inter-específicos en el género ornamental Penstemon. Se estudió la cronología del desarrollo floral en 3 especies de Penstemon, a partir de donde se construyó una guía visual para relacionar la apariencia y el tamaño de la flor con su estado de desarrollo. También se registró la cronología de dehiscencia del polen en las mismas 3 especies. Se realizaron un total de 4 cruces recíprocos, 4 cruces no recíprocos y 2 auto-polinizaciones entre 6 cultivares de 3 especies de Penstemon. Se encontró alto éxito unilateral en 3 cruces recíprocos, alto éxito bilateral en un cruce recíproco, bajo éxito en un cruce no recíproco y alto éxito en una auto- polinización, definiéndose éxito como el crecimiento frutal tras la polinización. Al término de este estudio, fue posible la colecta de las semillas de un fruto maduro, y se llegó a la conclusión de que se trataba de semillas inviables. -

Revised Classification of the Onagraceae
Chylismia brevipes subsp. brevipes [Illustration by Alice Tangerini, based on Beatley 7918 (US) and colored in Adobe PhotoShop CS using images from CalPhoto (J. Andre, image 01040887; C. Cloud-Hughes, images 07040686 and 07040690)]. SYSTEMATIC BOTANY MONOGRAPHS VOLUME 83 Revised Classification of the Onagraceae Warren L. Wagner Peter C. Hoch Peter H. Raven THE AMERICAN SOCIETY OF PLANT TAXONOMISTS 17 September 2007 SYSTEMATIC BOTANY MONOGRAPHS ISSN 0737-8211 Copyright © 2007 The American Society of Plant Taxonomists All rights reserved ISBN 0-912861-83-5 ISBN 978-0-912861-83-8 Printed in the United States of America Editor CHRISTIANE ANDERSON University of Michigan Herbarium 3600 Varsity Drive Ann Arbor, Michigan 48108-2287 Editorial Committee BRUCE G. BALDWIN JOHN V. F REUDENSTEIN University of California, Berkeley The Ohio State University LYNN BOHS DAVID M. JOHNSON University of Utah Ohio Wesleyan University DAVID E. BOUFFORD DONALD H. LES Harvard University University of Connecticut GREGORY K. BROWN THOMAS A. RANKER University of Wyoming University of Colorado REVISED CLASSIFICATION OF THE ONAGRACEAE Warren L. Wagner Department of Botany, MRC 166 Smithsonian Institution, P. O. Box 37012 Washington, DC 20013-7012 Peter C. Hoch Peter H. Raven Missouri Botanical Garden P. O. Box 299 St. Louis, Missouri 63166-0299 ABSTRACT. Recent molecular phylogenetic analyses in the plant family Onagraceae support the need for revisions in the family classification. In this paper we briefly survey the history of generic and suprageneric clas- sification in Onagraceae, summarize our knowledge of the morphological and molecular variation in the family in a phylogenetic context, and propose a revised classification that reflects that phylogeny. -

Vascular Plant Species List Documentation for Sequoia and Kings Canyon National Parks
VASCULAR PLANT SPECIES LIST DOCUMENTATION FOR SEQUOIA AND KINGS CANYON NATIONAL PARKS Cooperative agreement between California State University, Fresno and the National Park Service through the Great Basin Cooperative Ecosystem Studies Unit Alice Eastwood 1907, copywrite California Academy of Sciences Prepared by Jennifer Akin Dr. Ruth Kern, Assistant Professor Plant Ecology Sylvia Haultain, Plant Ecologist, Sequoia and Kings Canyon National Parks March 10, 2005 Cooperative Agreement # H8R07010001 Task Agreement # J8R07030007 ACKNOWLEDGEMENTS This project would not have been so fruitful without the aid of park botanists, Cheryl Barlett and Kristen Kaczynski. They provided much needed technical support in locating, documenting and verifying several hundred specimens in local and regional herbaria. They climbed many ladders, walked many hallways and were always ready to search for more specimens. Their dedication and drive has truly been monumental in documenting and enhancing the flora of Sequoia and Kings Canyon National Parks. We would also like to thank Sequoia and Kings Canyon National Park Curator Ward Eldredge for answering numerous questions regarding the park’s history and the park herbarium, and Sierra Nevada Network staff—Data Manager Rose Cook whose expertise and guidance in database formatting made the transition to NPSpecies effortless and Network Coordinator Linda Mutch whose support made this entire project an enormous success. Vascular Plant Species List Documentation For Sequoia and Kings Canyon National Parks Table of -

Correlates and Consequences of Repeated Nectar Evolution in the Ancestrally
UNIVERSITY OF CALGARY Correlates and Consequences of Repeated Nectar Evolution in the Ancestrally Rewardless Orchid Genus Disa by Nina Hobbhahn A THESIS SUBMITTED TO THE FACULTY OF GRADUATE STUDIES IN PARTIAL FULFILMENT OF THE REQUIREMENTS FOR THE DEGREE OF DOCTOR OF PHILOSOPHY DEPARTMENT OF BIOLOGICAL SCIENCES CALGARY, ALBERTA JANUARY, 2012 © NINA HOBBHAHN 2012 Library and Archives Bibliothèque et Canada Archives Canada Published Heritage Direction du Branch Patrimoine de l'édition 395 Wellington Street 395, rue Wellington Ottawa ON K1A 0N4 Ottawa ON K1A 0N4 Canada Canada Your file Votre référence ISBN: 978-0-494-83529-6 Our file Notre référence ISBN: 978-0-494-83529-6 NOTICE: AVIS: The author has granted a non- L'auteur a accordé une licence non exclusive exclusive license allowing Library and permettant à la Bibliothèque et Archives Archives Canada to reproduce, Canada de reproduire, publier, archiver, publish, archive, preserve, conserve, sauvegarder, conserver, transmettre au public communicate to the public by par télécommunication ou par l'Internet, prêter, telecommunication or on the Internet, distribuer et vendre des thèses partout dans le loan, distrbute and sell theses monde, à des fins commerciales ou autres, sur worldwide, for commercial or non- support microforme, papier, électronique et/ou commercial purposes, in microform, autres formats. paper, electronic and/or any other formats. The author retains copyright L'auteur conserve la propriété du droit d'auteur ownership and moral rights in this et des droits moraux qui protege cette thèse. Ni thesis. Neither the thesis nor la thèse ni des extraits substantiels de celle-ci substantial extracts from it may be ne doivent être imprimés ou autrement printed or otherwise reproduced reproduits sans son autorisation.