L'oreillard Roux (Plecotus Auritus)
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Conservation and Management of Eastern Big-Eared Bats a Symposium
Conservation and Management of Eastern Big-eared Bats A Symposium y Edited b Susan C. Loeb, Michael J. Lacki, and Darren A. Miller U.S. Department of Agriculture Forest Service Southern Research Station General Technical Report SRS-145 DISCLAIMER The use of trade or firm names in this publication is for reader information and does not imply endorsement by the U.S. Department of Agriculture of any product or service. Papers published in these proceedings were submitted by authors in electronic media. Some editing was done to ensure a consistent format. Authors are responsible for content and accuracy of their individual papers and the quality of illustrative materials. Cover photos: Large photo: Craig W. Stihler; small left photo: Joseph S. Johnson; small middle photo: Craig W. Stihler; small right photo: Matthew J. Clement. December 2011 Southern Research Station 200 W.T. Weaver Blvd. Asheville, NC 28804 Conservation and Management of Eastern Big-eared Bats: A Symposium Athens, Georgia March 9–10, 2010 Edited by: Susan C. Loeb U.S Department of Agriculture Forest Service Southern Research Station Michael J. Lacki University of Kentucky Darren A. Miller Weyerhaeuser NR Company Sponsored by: Forest Service Bat Conservation International National Council for Air and Stream Improvement (NCASI) Warnell School of Forestry and Natural Resources Offield Family Foundation ContEntS Preface . v Conservation and Management of Eastern Big-Eared Bats: An Introduction . 1 Susan C. Loeb, Michael J. Lacki, and Darren A. Miller Distribution and Status of Eastern Big-eared Bats (Corynorhinus Spp .) . 13 Mylea L. Bayless, Mary Kay Clark, Richard C. Stark, Barbara S. -
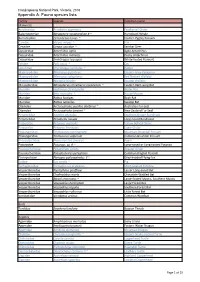
Report-VIC-Croajingolong National Park-Appendix A
Croajingolong National Park, Victoria, 2016 Appendix A: Fauna species lists Family Species Common name Mammals Acrobatidae Acrobates pygmaeus Feathertail Glider Balaenopteriae Megaptera novaeangliae # ~ Humpback Whale Burramyidae Cercartetus nanus ~ Eastern Pygmy Possum Canidae Vulpes vulpes ^ Fox Cervidae Cervus unicolor ^ Sambar Deer Dasyuridae Antechinus agilis Agile Antechinus Dasyuridae Antechinus mimetes Dusky Antechinus Dasyuridae Sminthopsis leucopus White-footed Dunnart Felidae Felis catus ^ Cat Leporidae Oryctolagus cuniculus ^ Rabbit Macropodidae Macropus giganteus Eastern Grey Kangaroo Macropodidae Macropus rufogriseus Red Necked Wallaby Macropodidae Wallabia bicolor Swamp Wallaby Miniopteridae Miniopterus schreibersii oceanensis ~ Eastern Bent-wing Bat Muridae Hydromys chrysogaster Water Rat Muridae Mus musculus ^ House Mouse Muridae Rattus fuscipes Bush Rat Muridae Rattus lutreolus Swamp Rat Otariidae Arctocephalus pusillus doriferus ~ Australian Fur-seal Otariidae Arctocephalus forsteri ~ New Zealand Fur Seal Peramelidae Isoodon obesulus Southern Brown Bandicoot Peramelidae Perameles nasuta Long-nosed Bandicoot Petauridae Petaurus australis Yellow Bellied Glider Petauridae Petaurus breviceps Sugar Glider Phalangeridae Trichosurus cunninghami Mountain Brushtail Possum Phalangeridae Trichosurus vulpecula Common Brushtail Possum Phascolarctidae Phascolarctos cinereus Koala Potoroidae Potorous sp. # ~ Long-nosed or Long-footed Potoroo Pseudocheiridae Petauroides volans Greater Glider Pseudocheiridae Pseudocheirus peregrinus -

Lepidoptera: Tortricidae: Tortricinae) and Evolutionary Correlates of Novel Secondary Sexual Structures
Zootaxa 3729 (1): 001–062 ISSN 1175-5326 (print edition) www.mapress.com/zootaxa/ Monograph ZOOTAXA Copyright © 2013 Magnolia Press ISSN 1175-5334 (online edition) http://dx.doi.org/10.11646/zootaxa.3729.1.1 http://zoobank.org/urn:lsid:zoobank.org:pub:CA0C1355-FF3E-4C67-8F48-544B2166AF2A ZOOTAXA 3729 Phylogeny of the tribe Archipini (Lepidoptera: Tortricidae: Tortricinae) and evolutionary correlates of novel secondary sexual structures JASON J. DOMBROSKIE1,2,3 & FELIX A. H. SPERLING2 1Cornell University, Comstock Hall, Department of Entomology, Ithaca, NY, USA, 14853-2601. E-mail: [email protected] 2Department of Biological Sciences, University of Alberta, Edmonton, Canada, T6G 2E9 3Corresponding author Magnolia Press Auckland, New Zealand Accepted by J. Brown: 2 Sept. 2013; published: 25 Oct. 2013 Licensed under a Creative Commons Attribution License http://creativecommons.org/licenses/by/3.0 JASON J. DOMBROSKIE & FELIX A. H. SPERLING Phylogeny of the tribe Archipini (Lepidoptera: Tortricidae: Tortricinae) and evolutionary correlates of novel secondary sexual structures (Zootaxa 3729) 62 pp.; 30 cm. 25 Oct. 2013 ISBN 978-1-77557-288-6 (paperback) ISBN 978-1-77557-289-3 (Online edition) FIRST PUBLISHED IN 2013 BY Magnolia Press P.O. Box 41-383 Auckland 1346 New Zealand e-mail: [email protected] http://www.mapress.com/zootaxa/ © 2013 Magnolia Press 2 · Zootaxa 3729 (1) © 2013 Magnolia Press DOMBROSKIE & SPERLING Table of contents Abstract . 3 Material and methods . 6 Results . 18 Discussion . 23 Conclusions . 33 Acknowledgements . 33 Literature cited . 34 APPENDIX 1. 38 APPENDIX 2. 44 Additional References for Appendices 1 & 2 . 49 APPENDIX 3. 51 APPENDIX 4. 52 APPENDIX 5. -

Naujan Lake National Park Site Assessment Profile
NAUJAN LAKE NATIONAL PARK SITE ASSESSMENT AND PROFILE UPDATING Ireneo L. Lit, Jr., Sheryl A. Yap, Phillip A. Alviola, Bonifacio V. Labatos, Marian P. de Leon, Edwino S. Fernando, Nathaniel C. Bantayan, Elsa P. Santos and Ivy Amor F. Lambio This publication has been made possible with funding support from Malampaya Joint Ventures Partners, Department of Environment and Natural Resources, Provincial Government of Oriental Mindoro and Provincial Government of Occidental Mindoro. i Copyright: © Mindoro Biodiversity Conservation Foundation Inc. All rights reserved: Reproduction of this publication for resale or other commercial purposes, in any form or by any means, is prohibited without the express written permission from the publisher. Recommended Citation: Lit Jr, I.L. Yap, S.A. Alviola, P.A. Labatos, B.V. de Leon, M.P. Fernando, S.P. Bantayan, N.C. Santos, E.P. Lambio, I.A.F. (2011). Naujan Lake National Park Site Assessment and Profile Updating. Muntinlupa City. Mindoro Biodiversity Conservation Foundation Inc. ISBN 978-621-8010-04-8 Published by: Mindoro Biodiversity Conservation Foundation Inc. Manila Office 22F Asian Star Building, ASEAN Drive Filinvest Corporate City, Alabang, Muntilupa City, 1780 Philippines Telephone: +63 2 8502188 Fax: +63 2 8099447 E-mail: [email protected] Website: www.mbcfi.org.ph Provincial Office Gozar Street, Barangay Camilmil, Calapan City, Oriental Mindoro, 5200 Philippines Telephone/Fax: +63 43 2882326 ii NAUJAN LAKE NATIONAL PARK SITE ASSESSMENT AND PROFILE UPDATING TEAM Project Leader Ireneo L. Lit, Jr., Ph.D. Floral survey team Study Leader Edwino S. Fernando, Ph.D. Ivy Amor F. Lambio, M.Sc. Field Technician(s) Dennis E. -

Original Article: Impact of Forest Fire on Soil Insect Diversity in Sal Forest, Doon Valley, Uttarakhand
International Journal of Technical Research and Applications e-ISSN: 2320-8163, www.ijtra.com Volume 4, Issue 1 (January-February, 2016), PP. 44-49 ORIGINAL ARTICLE: IMPACT OF FOREST FIRE ON SOIL INSECT DIVERSITY IN SAL FOREST, DOON VALLEY, UTTARAKHAND. Madhu Bist1, Dr Sudhir Singh2, Dr H B Vasistha3 1Research Scholar 1Dept of Forest Ecology and Environment Division 2Head of Department (Scientist F), Forest Entomology Division 3HOD (Scientist F),Dept of Forest Ecology and Environment Division 1,2,3Forest Research Institute, Dehradun-248195 (Uttarakhand) India [email protected] [email protected] [email protected] Abstract— The Himalayan forests particularly, Forest Survey of India carried out vulnerability analysis which was based on the frequency of forest fire occurrences Garhwal Himalayas being the youngest mountain ranges are the throughout the country and estimated a total of 8,645 forest most vulnerable stretches of the world susceptible to forest fires. fire incidence during 2004-2005; 20,567 during 2005-2006; Soils are alive with biological organisms which respond directly 16,779 during 2006-2007; 17,264 during 2007-2008; 26,180 to variations in the environment and modify environment during 2008-2009; 30,892 during 2009-2010 and 13,898 physically and chemically. Biological properties of soil are most incidence during 2010-2011 respectively in the country and sensitive to soil heating, with fatal temperatures for most living 143 forest fire incidence during 2004-2005; 165 during 2005- 0 organisms occurring below 100 C. In recent years extended 2006; 222 during 2006-2007; 717 during 2007-2008; 631 droughts and the demand for conversion of forest to other land during 2008-2009; 855 during 2009-2010 and 85 fire uses has resulted in significant increase in wildfire size, frequency incidence during 2010-2011 in Uttarakhand also [2]. -

Bfn -Skripten 599, 2021
Gert Rosenthal, Angelika Meschede, Ewald Langer, Jens Sachteleben, Vincent Aljes, Julia Schenkenberger, Nils Stanik, Thomas van Elsen und Caroline Wandke „WildnisArten“ BfN-Skripten 599 2021 „WildnisArten“ Bedeutung von Prozessschutz- bzw. Wildnisgebieten für gefährdete Lebensgemein- schaften und Arten sowie für „Verantwortungsarten“ Abschlussbericht des gleichnamigen F+E-Vorhabens (FKZ: 3515 85 0200) Gert Rosenthal Angelika Meschede Ewald Langer Jens Sachteleben Vincent Aljes Julia Schenkenberger Nils Stanik Thomas van Elsen Caroline Wanke Titelbild: Der Alpensteinbock (Capra ibex) benötigt große, ungestörte Räume in Hochlagen. (Foto: pixabay.com) Adressen der Autorinnen und der Autoren: Prof. Dr. Gert Rosenthal Universität Kassel Dr. Thomas van Elsen Fachgebiet Landschafts- und Vegetationsökologie Vincent Aljes Gottschalkstr. 26 a, 34127 Kassel Nils Stanik E-Mail: [email protected] Julia Schenkenberger Dr. Angelika Meschede PAN Planungsbüro für angewandten Naturschutz GmbH Dr. Jens Sachteleben Rosenkavalierplatz 8, 81925 München E-Mail: [email protected] Prof. Dr. Ewald Langer Universität Kassel Caroline Wanke Fachgebiet Ökologie Heinrich-Plett-Straße 40, 34132 Kassel E-Mail: [email protected] Fachbetreuung im BfN: Dr. Peter Finck Fachgebiet II 2.3 „Nationales Naturerbe, dynamische Systeme und Klimawandel“ Abschlussbericht des Forschungs- und Entwicklungsvorhabens „Bedeutung von Prozessschutz- bzw. Wild- nisgebieten für gefährdete Lebensgemeinschaften und Arten sowie für ’Verantwortungsarten‘“, gefördert vom Bundesamt für Naturschutz mit Mitteln des Bundesministeriums für Umwelt, Naturschutz und nukleare Sicherheit (FKZ 3515 85 0200). Diese Veröffentlichung wird aufgenommen in die Literaturdatenbank „DNL-online“ (www.dnl-online.de). BfN-Skripten sind nicht im Buchhandel erhältlich. Eine pdf-Version dieser Ausgabe kann unter http:// www.bfn.de/skripten.html heruntergeladen werden. Institutioneller Herausgeber: Bundesamt für Naturschutz Konstantinstr. -

Diagnoses and Remarks on the Genera of Tortricidae (Lepidoptera)
Acta zoologica cracoviensia, 58(2): 195-252, Kraków, 31 December, 2015 Ó Institute of Systematics and Evolution of Animals, Pol. Acad. Sci., Kraków doi:10.3409/azc.58_2.195 DiagnosesandremarksonthegeneraofTortricidae (Lepidoptera). Part3.Archipini JózefRAZOWSKI Received:15July2015.Accepted:21December2015.Availableonline:31December2015. RAZOWSKI J. 2015. Diagnoses and remarks on the genera of Tortricidae (Lepidoptera). Part3.Archipini. Actazool.cracov., 58(2): 195-252. Abstract. Comparative diagnoses, redescriptions, and remarks are presented on the genera of the tribe Archipini. Original references, type species, synonyms, numbers of known species, and zoogeographic regions are provided. Merophyas COMMON, 1964, is synoni- mizedwith Clepsis GUENÉE,1845. Keywords:Lepidoptera,Tortricidae,Archipini,genera,comparativediagnoses. Józef RAZOWSKI, Insitute of the Systematics and Evolution of Animals, Polish Academy * ofSciences, S³awkowska17, 31-016Kraków,Poland. E-mail:[email protected] I.INTRODUCTION The number of genera of Tortricidae has increased dramatically over last 50 years; by 2007 there were over 1630 described genera, including synonyms. Many of the older de- scriptions are scattered throughout the literature, and because there are few larger synthetic treatments of the tortricids for most major biogeographic regions, this large number of taxa complicates considerably the work of taxonomists on the faunas of poorly known regions of the planet. In addition, characters that define many of the genera are not clearly articu- lated. The distribution of many genera is still insufficiently known, and this shortcoming frequently results in unexpected findings, e.g., the discovery of Afrotropical genera in the Neotropics. These types of discoveries may cause confusion for specialists that focus on thefaunaofasinglegeographicregion. The literature abounds with re-descriptions and diagnoses of tortricid genera, but many are rather short, frequently lacking comparisons with similar or related taxa. -

Morfologické Aspekty Loveckých Strategií Netopýrů Západního Palearktu
Univerzita Hradec Králové Přírodovědecká fakulta Katedra biologie Morfologické aspekty loveckých strategií netopýrů západního Palearktu DIPLOMOVÁ PRÁCE Autor: Veronika Karmáčková Studijní program: N1501 Biologie Studijní obor: Systematická biologie a ekologie Vedoucí práce: RNDr. Michal Andreas Ph.D. odborný konzultant: Doc. RNDr. Petr Benda Ph.D. Hradec Králové 2017 Prohlášení: Prohlašuji, že jsem diplomovou práci vypracovala samostatně a že jsem v seznamu použité literatury uvedla všechny prameny, z kterých jsem vycházela. V Hradci Králové dne: Podpis: Poděkování: V první řadě bych ráda poděkovala mému vedoucímu práce RNDr. Michalu Andreasovi Ph.D. za poskytnutí cenných rad, připomínek a za trpělivost při psaní této diplomové práce. Dále děkuji Doc. RNDr. Petru Bendovi Ph.D. za rady, poskytnuté informace a také za ochotu a umožnění přístupu do depozitáře, kde se materiál nacházel. V neposlední řadě bych chtěla poděkovat mé rodině, která mě po celou dobu studia velmi podporovala. Anotace: KARMÁČKOVÁ, V. Morfologické aspekty loveckých strategií netopýrů západního Palearktu. Hradec Králové, 2017. Diplomová práce na Přírodovědecké fakultě Univerzity Hradec Králové. Vedoucí diplomové práce Michal Andreas. 156 s. Klíčová slova: Netopýři, morfologie křídel, lovecké strategie, rozdíly mezi pohlavími, geografické rozdíly. Předložená diplomová práce se zabývá morfologií křídel netopýrů. Byl zpracován obsáhlý materiál. Změřeno bylo 2605 kusů reprezentujících 75 druhů či poddruhů netopýrů vyskytujících se v západním Palearktu. U každého jedince bylo naměřeno 14 zadaných tělesných parametrů, které byly dále zpracovány. Součástí práce je literární rešerše, která podává celkový přehled o dostupných informacích týkajících se ekologie studovaných druhů netopýrům, protože morfologie křídel a ekologické preference druhů, společně s echolokací, jsou úzce provázány. Výsledky měření byly rozsáhle analyzovány a byly z nich vypočteny další charakteristiky (plošné zatížení křídel, poměr délky a šířky křídla apod.). -

Biology and Management of Pest Diabrotica Species in South America
insects Review Biology and Management of Pest Diabrotica Species in South America Guillermo Cabrera Walsh 1,* , Crébio J. Ávila 2, Nora Cabrera 3, Dori E. Nava 4, Alexandre de Sene Pinto 5 and Donald C. Weber 6 1 ARS-SABCL/FuEDEI (Foundation for the Study of Invasive Species), Hurlingham B1686EFA, Argentina 2 EMBRAPA Agropecuaria Oeste, Dourados, Mato Grosso de Sul Caixa-postal 449, Brazil; [email protected] 3 Facultad de Ciencias Naturales y Museo, Universidad Nacional de La Plata, La Plata B1900FWA, Argentina; [email protected] 4 EMBRAPA Clima Temperado, Pelotas, Rio Grande do Sul Caixa-Postal 403, Brazil; [email protected] 5 Centro Universitario Moura Lacerda, Ribeirão Preto, São Paulo 14076-510, Brazil; [email protected] 6 USDA-ARS Invasive Insect Biocontrol & Behavior Laboratory, Baltimore Avenue, Beltsville, MD 10300, USA; [email protected] * Correspondence: [email protected]; Tel.: +54-11-4452-4838 Received: 27 May 2020; Accepted: 4 July 2020; Published: 8 July 2020 Abstract: The genus Diabrotica has over 400 described species, the majority of them neotropical. However, only three species of neotropical Diabrotica are considered agricultural pests: D. speciosa, D. balteata, and D. viridula. D. speciosa and D. balteata are polyphagous both as adults and during the larval stage. D. viridula are stenophagous during the larval stage, feeding essentially on maize roots, and polyphagous as adults. The larvae of the three species are pests on maize, but D. speciosa larvae also feed on potatoes and peanuts, while D. balteata larvae feed on beans and peanuts. None of these species express a winter/dry season egg diapause, displaying instead several continuous, latitude-mediated generations per year. -

Effects of Urbanization on Arthropod Communities in Carolina
EFFECTS OF URBANIZATION ON ARTHROPOD COMMUNITIES IN CAROLINA WREN (THRYOTHORUS LUDOVICIANUS) NESTS: A COMPARATIVE STUDY BETWEEN URBAN & RURAL HABITATS IN WALKER COUNTY, TEXAS _____________ A Thesis Presented to The Faculty of the Department of Biological Sciences Sam Houston State University _____________ In Partial Fulfillment of the Requirements for the Degree of Master of Science _____________ by Faith N Byrd December, 2019 EFFECTS OF URBANIZATION ON ARTHROPOD COMMUNITIES IN CAROLINA WREN (THRYOTHORUS LUDOVICIANUS) NESTS: A COMPARATIVE STUDY BETWEEN URBAN & RURAL HABITATS IN WALKER COUNTY, TEXAS by Faith N Byrd ______________ APPROVED: Diane L.H. Neudorf, PhD Thesis Director Sibyl R. Bucheli, PhD Committee Member Tamara J. Cook, PhD Committee Member Autumn J. Smith-Herron, PhD Committee Member John B. Pascarella, PhD Dean, College of Science and Engineering Technology DEDICATION To my grandfather, who taught me the value of learning. iii ABSTRACT Byrd, Faith N, Effects of urbanization on arthropod communities in Carolina Wren (Thryothorus ludovicianus) nests: A comparative study between urban & rural habitats in Walker county, Texas. Master of Science (Biology), December, 2019, Sam Houston State University, Huntsville, Texas. As urban sprawl increases, the need for better understanding of anthropogenic effects on songbirds also increases. Humans continue to alter natural environments by introducing non-native plant species and disturbing ecosystems with houses and maintained yards. These alterations have been shown in past studies to not only alter animal behaviors, but to affect what animals are present in a given space. This is particularly concerning given recent studies showing a dramatic decline in arthropod populations globally. I evaluated the relationship between plant communities, human dwellings and arthropod communities found in the nests of a cavity-nesting songbird species, the Carolina Wren (Thryothorus ludovicianus) to establish if species richness of arthropods in microhabitats has been affected by human influence. -

Micromechanical Properties of Consecutive Layers in Specialized
2576 The Journal of Experimental Biology 211, 2576-2583 Published by The Company of Biologists 2008 doi:10.1242/jeb.020164 Micromechanical properties of consecutive layers in specialized insect cuticle: the gula of Pachnoda marginata (Coleoptera, Scarabaeidae) and the infrared sensilla of Melanophila acuminata (Coleoptera, Buprestidae) Martin Müller1, Maciej Olek2, Michael Giersig2 and Helmut Schmitz1,* 1Institute for Zoology, University of Bonn, Poppelsdorfer Schloss, D-53115 Bonn, Germany and 2Forschungszentrum caesar, Ludwig-Erhardt-Allee 2, D-53175 Bonn, Germany *Author for correspondence ([email protected]) Accepted 10 June 2008 SUMMARY Insect cuticle is a highly adaptive material that fulfils a wide spectrum of different functions. Cuticle does not only build the exoskeleton with diverse moveable parts but is also an important component of a stunning variety of mechanosensory receptors. Therefore, the mechanical properties of these specialized cuticular systems are of crucial importance. We studied the different cuticular layers of the head part (gula) of the head-to-neck ball articulation of Pachnoda marginata and of the photomechanic infrared (IR) sensilla of Melanophila acuminata on the basis of cross sections. In our study, we combined histological methods (i.e. detection of the different types of cuticle by specific staining) with measurements of hardness (H) and reduced elastic modulus (Er) by nanoindentation technique. In the gula of Pachnoda we found an unusual aberrance from the well-known layering. Between the epi- and exocuticle, two meso- and one endocuticular layers are deposited which are softer and more elastic than the underlying exo- and mesocuticular layers. The hardest of all examined materials is the cuticle of the exocuticular shell of the internal sphere of the Melanophila IR sensillum with H=0.53GPa whereas the inner mesocuticular core of the sensillum represents the most elastic and softest layer with values of H=0.29GPa and Er=4.8GPa. -

Aquatic-To-Terrestrial Contaminant Flux in the Scioto River Basin, Ohio, USA
Aquatic-to-terrestrial contaminant flux in the Scioto River basin, Ohio, USA THESIS Presented in Partial Fulfillment of the Requirements for the Degree Master of Science in the Graduate School of The Ohio State University By Jeremy M. Alberts Graduate Program in Environment and Natural Resources The Ohio State University 2012 Committee: Dr. Mažeika S.P. Sullivan, Advisor Dr. Amanda D. Rodewald Dr. Stanley D. Gehrt Copyrighted by Jeremy M. Alberts 2012 Abstract Aquatic emergent insects provide important prey subsidies to riparian consumers. These aquatic-to-terrestrial feeding relationships provide a pathway through which aquatic contaminants are “reterrestrialized” into riparian food webs. However, influences of land use and land cover (LULC) on the magnitude of aquatic-to-terrestrial contaminant transfers remain largely unexplored. To that end, I investigated aquatic-to-terrestrial contaminant fluxes at 11 study reaches in the Olentangy and Scioto Rivers (OH, USA), representing urban, agricultural, and mixed land uses. At nine study reaches, I collected benthic sediment, aquatic emergent insects, ants (Formica subsericea), spiders of the family Tetragnathidae, riparian vegetation, and periphyton. At eight of these reaches, as well as additional four reaches where I erected nest-boxes, I sampled riparian swallows including: bank (Riparia riparia), northern rough-winged (Stelgidopteryx serripennis), tree (Tachycineta bicolor), and cliff (Petrochelidon pyrrhonota) swallows. Subsequently, all biological samples were analyzed for δ13C and δ15N. Sediment, ants, spiders, and swallows were tested for a suite of toxic elements including arsenic (As), selenium (Se), lead (Pb), and mercury (Hg). Two-source (δ13C and δ15N) mixing models indicated that Tetragnathidae were highly reliant on aquatic insects ( ̅= 76.9%, SD = 8.9%), whereas ant dependence was ii less but with greater variability ( ̅ = 27.8%, SD = 25.1%).