Orihuela Toledo.Pdf
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

ABSTRACT HONEYCUTT, JAMIE LYNN. (Née
ABSTRACT HONEYCUTT, JAMIE LYNN. (née MANKIEWICZ) Environmental and Endocrine Regulators of Stress Effects in Teleost Fishes (Under the direction of Dr. Russell J. Borski). The adaptive stress response is mediated by the endocrine stress axis whereby catecholamines and glucocorticoids promote production of energy substrates essential for re-establishing homeostasis. Here we utilize two teleost fish models to examine two overarching research goals: 1) the role catecholamines, cortisol, and glucose might play in regulating leptin (LepA), an important hormone controlling energy homeostasis in the Mozambique tilapia (Oreochromis mossambicus), and 2) the impact of environmental stressors, namely temperature, on nursery habitat sex ratios and sex determination in southern flounder (Paralichthys lethostigma), a species that exhibits both genetic and environmental sex determination. Leptin is a cytokine critical for regulating energy expenditure in vertebrates, yet it is unclear how the hormone interacts with the endocrine stress axis, particularly in fishes. We evaluated the actions of epinephrine, cortisol, and glucose in regulating leptin in the liver, the primary site of hormone production in the tilapia. Both cortisol and epinephrine stimulate LepA secretion from hepatocytes. While epinephrine had no effect on mRNA, cortisol suppresses lepa mRNA levels. Epinephrine stimulates both leptin synthesis and secretion in vivo. Leptin is directly sensitive to glucose as hepatic synthesis and secretion declines as ambient glucose levels rise. By contrast, glucose injection increases lepa mRNA levels by 14-fold, indicating that there are likely other systemic factors regulated by glucose that may enhance lepa mRNA. These data show that tilapia LepA is negatively regulated by rises in extracellular glucose at the level of the hepatocyte but stimulated by hyperglycemia in vivo. -

Movement Patterns of Chilean Flounder (Paralichthys Adspersus) Inside Tongoy Bay (Central Northern Chile): Observations Using Passive Acoustic Telemetry
Vol. 8(12), pp. 126-139, December 2016 DOI: 10.5897/IJFA2016.0546 Article Number: E2D42DD61769 International Journal of Fisheries and ISSN 2006-9839 Copyright ©2016 Aquaculture Author(s) retain the copyright of this article http://www.academicjournals.org/IJFA Full Length Research Paper Movement patterns of Chilean flounder (Paralichthys adspersus) inside Tongoy Bay (central northern Chile): Observations using passive acoustic telemetry Pablo M. Rojas División de Investigación en Acuicultura, Instituto de Fomento Pesquero P. O. Box 665, Puerto Montt, Chile. Received 22 February, 2016; Accepted 1 September, 2016 The movement patterns of juvenile and adult Chilean flounder (P. adpersus) were investigated inside Tongoy Bay using ultrasound signal acoustic receivers from June 2012 to March, 2013. Flounder landings in Tongoy Bay and Puerto Aldea from December 2011 to March 2013 were examined. Multiple regression analysis indicated that the Catch per Unit of Effort of Chilean flounder was significantly and negatively related to temperature and depth. Analyses of site- and time-specific length-frequency distributions indicated movement of Chilean flounder on the time scale of weeks, which was likely due to emigration of fish >30 cm in total length. A mark-recapture study was performed. Visible elastomer paint was used to tag 7,510 Chilean flounder. A total of 12 Chilean flounder individuals of different lengths were tagged with an ultrasound transmission device to monitor their movement inside Tongoy Bay. Adults flounder showed increased activity inside Tongoy Bay during the study period, likely due of the differences in length among the released individuals. Although differences were detected in the area occupied by juvenile and adult flounders in Tongoy Bay, it was also noticed that the smaller sized individuals exhibited changes in behavior after implanting the transmitters that resulted in impaired capacity to move freely. -
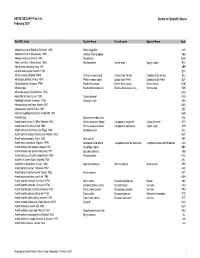
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste -

Universidad Nacional Mayor De San Marcos Universidad Del Perú
Universidad Nacional Mayor de San Marcos Universidad del Perú. Decana de América Facultad de Ciencias Biológicas Escuela Profesional de Genética y Biotecnología Descripción de cambios transcripcionales durante estadios tempranos del desarrollo del lenguado Paralichthys adspersus TESIS Para optar el Título Profesional de Biólogo Genetista Biotecnólogo AUTOR Eduardo Fabio APARI COSSIO ASESOR Mg. Giovanna Elizabeth SOTIL CAYCHO Lima, Perú 2019 Reconocimiento - No Comercial - Compartir Igual - Sin restricciones adicionales https://creativecommons.org/licenses/by-nc-sa/4.0/ Usted puede distribuir, remezclar, retocar, y crear a partir del documento original de modo no comercial, siempre y cuando se dé crédito al autor del documento y se licencien las nuevas creaciones bajo las mismas condiciones. No se permite aplicar términos legales o medidas tecnológicas que restrinjan legalmente a otros a hacer cualquier cosa que permita esta licencia. Referencia bibliográfica Apari, E. (2019). Descripción de cambios transcripcionales durante estadios tempranos del desarrollo del lenguado Paralichthys adspersus. Tesis para optar el título profesional de Biólogo Genetista Biotecnólogo. Escuela Profesional de Genética y Biotecnología, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos, Lima, Perú. DEDICATORIA A mis padres por todo el apoyo, comprensión y amor que me dieron en todos los años, gracias por estar conmigo siempre y por confiar en mí. A Dios por haberme dado la fuerza que siempre necesité y por ayudarme cada vez que las situaciones se ponían difícil, gracias padre celestial. AGRADECIMIENTOS A mi asesora Mg. Giovanna Elizabeth Sotil Caycho por la gran oportunidad, por su apoyo y por su confianza. Agradezco por cada consejo y por cada experiencia contada, ya que estás han ayudado a mi formación profesional. -

Redalyc.Broodstock Management of the Fine Flounder Paralichthys
Latin American Journal of Aquatic Research E-ISSN: 0718-560X [email protected] Pontificia Universidad Católica de Valparaíso Chile Carrera, Lili; Cota, Noemí; Montes, Melissa; Mateo, Enrique; Sierralta, Verónica; Castro, Teresa; Perea, Angel; Santos, Cristian; Catcoparco, Christian; Espinoza, Carlos Broodstock management of the fine flounder Paralichthys adspersus (Steindachner, 1867) using recirculating aquaculture systems Latin American Journal of Aquatic Research, vol. 41, núm. 1, 2013, pp. 89-98 Pontificia Universidad Católica de Valparaíso Valparaiso, Chile Available in: http://www.redalyc.org/articulo.oa?id=175025740015 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Lat. Am. J. Aquat. Res., 41(1): 89-98, 2013 Broodstock management of the fine flounder using RAS 89 DOI: 103856/vol41-issue1-fulltext-7 Research Article Broodstock management of the fine flounder Paralichthys adspersus (Steindachner, 1867) using recirculating aquaculture systems Lili Carrera1, Noemí Cota2, Melissa Montes2, Enrique Mateo3, Verónica Sierralta3 Teresa Castro3, Angel Perea4, Cristian Santos1, Christian Catcoparco2& Carlos Espinoza2 1Laboratorio de Cultivos Marinos, Instituto del Mar del Perú Esquina Gamarra y General Valle s/n, Chucuito, Callao, Perú 2Proyecto FINCyT, Instituto del Mar del Perú, Esquina Gamarra y General Valle s/n Chucuito, Callao, Perú 3Laboratorio de Patología Acuática, Instituto del Mar del Perú Esquina Gamarra y General Valle s/n, Chucuito, Callao, Perú 4Laboratorio de Biología Reproductiva, Instituto del Mar del Perú Esquina Gamarra y General Valle s/n, Chucuito, Callao, Perú ABSTRACT. -

Redalyc.Larval Development of the Southern Flounder Thysanopsetta
Revista de Biología Marina y Oceanografía ISSN: 0717-3326 [email protected] Universidad de Valparaíso Chile Cortez, Cristian; Balbontín, Fernando; Landaeta, Mauricio F. Larval development of the southern flounder Thysanopsetta naresi from Chilean Patagonia Revista de Biología Marina y Oceanografía, vol. 50, núm. 1, abril, 2015, pp. 13-23 Universidad de Valparaíso Viña del Mar, Chile Available in: http://www.redalyc.org/articulo.oa?id=47936981002 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Revista de Biología Marina y Oceanografía Vol. 50, Nº1: 13-23, abril 2015 ARTICLE Larval development of the southern flounder Thysanopsetta naresi from Chilean Patagonia Desarrollo larval del lenguado austral Thysanopsetta naresi de la Patagonia chilena Cristian Cortez 1, Fernando Balbontín 1 and Mauricio F. Landaeta 2 1Laboratorio de Ictiología, Facultad de Ciencias del Mar y de Recursos Naturales, Universidad de Valparaíso, Avenida Borgoño 16344, Reñaca, Viña del Mar, Chile. [email protected] 2Laboratorio de Ictioplancton (LABITI), Facultad de Ciencias del Mar y de Recursos Naturales, Universidad de Valparaíso, Avenida B orgoño 16344, Reñaca, Viña del Mar, Chile Resumen .- Se describe por primera vez el desarrollo larval del lenguado austral Thysanopsetta naresi , utilizando material proveniente de muestras obtenidas en cruceros oceanográficos realizados en los fiordos del sur de Chile. Las larvas abarcaron un rango de 2,8 a 22,4 mm de longitud corporal (LC). Un atributo que resalta en las larvas es la fuerte pigmentación, que se desarrolla temprano en preflexión y que se acentúa sobre casi todo el cuerpo, con excepción del extremo caudal. -

Redalyc.Characterization of the Intestinal Microbiota of Wild-Caught
Latin American Journal of Aquatic Research E-ISSN: 0718-560X [email protected] Pontificia Universidad Católica de Valparaíso Chile Salas-Leiva, Joan; Opazo, Rafael; Remond, Camille; Uribe, Eduardo; Velez, Antonio; Romero, Jaime Characterization of the intestinal microbiota of wild-caught and farmed fine flounder (Paralichthys adspersus) Latin American Journal of Aquatic Research, vol. 45, núm. 2, mayo, 2017, pp. 370-378 Pontificia Universidad Católica de Valparaíso Valparaíso, Chile Available in: http://www.redalyc.org/articulo.oa?id=175051041012 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Lat. Am. J. Aquat. Res., 45(2): 370-378, 2017 Intestinal microbiota of fine flounder 370 1 DOI: 10.3856/vol45-issue2-fulltext-12 Research Article Characterization of the intestinal microbiota of wild-caught and farmed fine flounder (Paralichthys adspersus) Joan Salas-Leiva1,2, Rafael Opazo1,5, Camille Remond1, Eduardo Uribe3,5 Antonio Velez4 & Jaime Romero1,5 1Laboratorio de Biotecnología de los Alimentos, Instituto de Nutrición y Tecnología de los Alimentos, Universidad de Chile, Santiago, Chile 2Doctorado en Acuicultura, Programa Cooperativo Universidad Católica del Norte Pontificia Universidad Católica de Valparaíso, Universidad de Chile 3Departamento de Acuicultura, Universidad Católica del Norte, Coquimbo, Chile 4Fundación Chile, Cultivos Marinos Tongoy, Coquimbo, Chile 5Aquapacífico, Coquimbo, Chile Corresponding author: Jaime Romero ([email protected]) ABSTRACT. A comparative analysis of the cultivable intestinal microbiota of farmed (AF) and wild-caught (WF) Paralichthys adspersus was performed. The 16S rRNA gene was used for taxa identification, and the ITS region for strain differentiation. -

Marine Finfish Species Diversification: Current Situation and Prospects in Mediterranean Aquaculture
Marine Finfish Species Diversification: Current Situation and Prospects in Mediterranean Aquaculture Abellán E., Basurco B. in Abellán E. (ed.), Basurco B. (ed.). Marine Finfish Species Diversification: Current Situation and Prospects in Mediterranean Aquaculture Zaragoza : CIHEAM Options Méditerranéennes : Série B. Etudes et Recherches; n. 24 1999 pages 1-139 Article available on line / Article disponible en ligne à l’adresse : -------------------------------------------------------------------------------------------------------------------------------------------------------------------------- http://om.ciheam.org/article.php?IDPDF=99600183 -------------------------------------------------------------------------------------------------------------------------------------------------------------------------- To cite this article / Pour citer cet article -------------------------------------------------------------------------------------------------------------------------------------------------------------------------- Abellán E., Basurco B. Marine Finfish Species Diversification: Current Situation and Prospects in Mediterranean Aquaculture. In : Abellán E. (ed.), Basurco B. (ed.). Marine Finfish Species Diversification: Current Situation and Prospects in Mediterranean Aquaculture. Zaragoza : CIHEAM, 1999. p. 1-139 (Options Méditerranéennes : Série B. Etudes et Recherches; n. 24) -------------------------------------------------------------------------------------------------------------------------------------------------------------------------- -

AGUIRRE Arturo These Finale Corrigee
THÈSE / UNIVERSITÉ DE BRETAGNE OCCIDENTALE présentée par sous le sceau de l’Université Bretagne Loire Arturo Aguirre-Velarde pour obtenir le titre de DOCTEUR DE L’UNIVERSITÉ DE BRETAGNE OCCIDENTALE Préparée à l'Institut Universitaire Mention : Biologie Marine Européen de la Mer, Laboratoire de École Doctorale des Sciences de la Mer Sciences de l'environnement – Thèse soutenue le 15 décembre 2016 La bioénergétique du pétoncle devant le jury composé de : péruvien (Argopecten Miguel Avendaño Professeur, Université d’Antofagasta (Chili) / Rapporteur purpuratus) dans un contexte Laurent BARILLÉ environnemental limitant Professeur, Université de Nantes / Rapporteur en oxygène. Jocelyne FERRARYS Directrice de recherche, IRD UMR ENTROPIE / Examinatrice Frédéric JEAN Professeur, UBO, CNRS, LEMAR - IUEM / Directeur de thèse Gérard THOUZEAU Directeur de recherche, CNRS, LEMAR - IUEM / Directeur de thèse Jonathan FLY SAINTE MARIE Maître de Conférences, UBO, LEMAR - IUEM / Directeur de thèse UNIVERSITÉ DE BRETAGNE OCCIDENTALE -BREST École doctorale des Science de la Mer - IUEM Thèse de Doctorat de l’UNIVERSITÉ DE BRETAGNE OCCIDENTALE Spécialité : Océanologie biologique La bioénergétique du pétoncle péruvien (Argopecten purpuratus) dans un contexte environnemental limitant en oxygène par Arturo Aguirre Velarde Composition du Jury Miguel AVENDAÑO Professeur, Université d’Antofagasta (Chili) Rapporteur Laurent BARILLÉ Professeur, Université de Nantes, MMS Rapporteur Jocelyne FERRARIS Directrice de recherche, IRD, UMR ENTROPIE Examinatrice Frédéric JEAN Maitre de Conférences, UBO, CNRS, LEMAR-IUEM Directeur de thèse Gérard THOUZEAU Directeur de recherche, CNRS, LEMAR-IUEM Directeur de thèse Jonathan FLYE-SAINTE-MARIE Maitre de Conférences, UBO, LEMAR-IUEM Directeur scientifique Remerciements Les travaux de recherche présentés dans ce manuscrit ont été réalisés avec le sou- tien de l’IRD (LMI-DISCOH), le LabexMer, l’ANR comanche et le IFS (International Foundation For Science). -
Lenguado De Ojos Chicos (Pleuronectiformes, Paralichthyidae): Un Caso Del Ambiente Y Un Análisis En Ejemplares Cultivados
Lat. Am. J. Aquat. Res., 41(1): 57-67,Inversión 2013 ocular en Paralichthys adspersus (Pleuronectiformes, Paralichthyidae) 57 DOI: 103856/vol41-issue1-fulltext-4 Research Article Inversión ocular en Paralichthys adspersus (Steindachner, 1867) lenguado de ojos chicos (Pleuronectiformes, Paralichthyidae): un caso del ambiente y un análisis en ejemplares cultivados Héctor Flores1 & Paula Martínez2 1Departamento de Acuicultura, Facultad de Ciencias del Mar, Universidad Católica del Norte Larrondo 1281, Coquimbo, Chile 2Corporación Nacional Forestal, Región de Coquimbo, Regimiento Arica 901, Coquimbo RESUMEN. En diversas especies de Pleuronectiformes se han registrado casos de inversión ocular, fenómeno, en que el individuo reposa en el fondo por el lado contrario al habitual y/o normal. La proporción en que se presenta esta condición es variable y depende de las especies que se analicen. En el género Paralichthys se ha reportado inversión ocular en cuatro especies: P. albigutta, P. orbignyanus, P. californicus y P. dentatus. En el presente trabajo, se informa la captura de un ejemplar silvestre de Paralichthys adspersus (Steindachner, 1867), con inversión ocular, capturado en Caldera (Chile). También, se han reportado individuos invertidos de esta especie provenientes de un cultivo, a partir de reproductores que fueron capturados en Bahía Coquimbo. En ejemplares diestros y siniestros proveniente de cultivo, se efectuó comparación de relaciones morfométricas. La proporción de peces con inversión ocular y que provienen de un cultivo, representa 2,2% de la población de peces producidos. Se discute la frecuencia de este tipo de anomalías y las probables causas que las estarían produciendo. Palabras clave: migración ojos, anormalidad ocular, desarrollo temprano, acuicultura, Coquimbo, Chile. -

For Peer Review
Page 1 of 57 Parasitology 1 New data on flatfish scuticociliatosis reveal 2 that Miamiensis avidus and Philasterides 3 dicentrarchi are different species 4 ANA-PAULA DEFELIPE 1, JESÚS LAMAS 2, ROSA-ANA SUEIRO 1,2, 5 IRIA FOLGUEIRAFor1 and Peer JOSÉ-MANUEL Review LEIRO 1* 6 1Departamento de Microbiología y Parasitología, Instituto de Investigación y Análisis Alimentarios, 7 Universidad de Santiago de Compostela, 15782 Santiago de Compostela, Spain 8 2Departamento de Biología Celular y Ecología, Instituto de Acuicultura, Universidad de Santiago de 9 Compostela, 15782 Santiago de Compostela, Spain 10 11 12 13 14 15 SHORT TITLE: Scuticociliatosis in flatfish 16 17 18 19 20 21 *Correspondence 22 José M. Leiro, Laboratorio de Parasitología, Instituto de Investigación y Análisis Alimentarios, 23 c/ Constantino Candeira s/n, 15782, Santiago de Compostela (A Coruña), Spain; Tel: 24 34981563100; Fax: 34881816070; E-mail: [email protected] Cambridge University Press Parasitology Page 2 of 57 25 SUMMARY 26 Scuticociliatosis is a severe disease in farmed flatfish. However, the causative agent is 27 not always accurately identified. In this study, we identified two isolates of 28 scuticociliates from an outbreak in cultured fine flounder Paralichthys adspersus . 29 Scuticociliate identification was based on morphological data, examination of life stages 30 and the use of molecular approaches. The isolates were compared with a strain of 31 Philasterides dicentrachi from turbot Scophthalmus maximus and with a strain 32 deposited in theFor American PeerType Culture ReviewCollection as Miamiensis avidus ATCC ® 33 50180 TM . The use of morphological, biological, and molecular methods enabled us to 34 identify the isolates from the fine flouder as P. -

A Comprehensive Integrated Genetic Map of the Complete Karyotype of Solea Senegalensis (Kaup 1858)
G C A T T A C G G C A T genes Article A Comprehensive Integrated Genetic Map of the Complete Karyotype of Solea senegalensis (Kaup 1858) Manuel A. Merlo, Silvia Portela-Bens, María E. Rodríguez , Aglaya García-Angulo, Ismael Cross, Alberto Arias-Pérez, Emilio García and Laureana Rebordinos * Genetics Area, Faculty of Marine and Environmental Sciences, INMAR, University of Cadiz, 11510 Cádiz, Spain; [email protected] (M.A.M.); [email protected] (S.P.-B.); [email protected] (M.E.R.); [email protected] (A.G.-A.); [email protected] (I.C.); [email protected] (A.A.-P.); [email protected] (E.G.) * Correspondence: [email protected] Abstract: Solea senegalensis aquaculture production has experienced a great increase in the last decade and, consequently, the genome knowledge of the species is gaining attention. In this sense, obtaining a high-density genome mapping of the species could offer clues to the aquaculture improvement in those aspects not resolved so far. In the present article, a review and new processed data have allowed to obtain a high-density BAC-based cytogenetic map of S. senegalensis beside the analysis of the sequences of such BAC clones to achieve integrative data. A total of 93 BAC clones were used to localize the chromosome complement of the species and 588 genes were annotated, thus almost reaching the 2.5% of the S. senegalensis genome sequences. As a result, important data about its genome organization and evolution were obtained, such as the lesser gene density of the large metacentric pair compared with the other metacentric chromosomes, which supports the theory of a sex proto-chromosome pair.