Diversidad Alfa Y Beta
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

A Set of 20 New SSR Markers Developed and Evaluated in Mandevilla Lindl
molecules Article A Set of 20 New SSR Markers Developed and Evaluated in Mandevilla Lindl. Alev Oder 1, Robert Lannes 1 and Maria Angeles Viruel 2,* 1 S.A.S. DHMINNOVATION 18, Avenue du Quercy—BP5, 82200 Malause, France; [email protected] (A.O.); [email protected] (R.L.) 2 Instituto de Hortofruticultura Subtropical y Mediterránea La Mayora (IHSM-UMA-CSIC), 29750 Algarrobo-Costa (Málaga), Spain * Correspondence: [email protected]; Tel.: +34-952-548-990 (ext. 120) Academic Editor: Derek J. McPhee Received: 12 August 2016; Accepted: 22 September 2016; Published: 30 September 2016 Abstract: Mandevilla is an ornamental crop with a bright future worldwide because of its high commercial acceptance and added value. However, as with most ornamental species, there are few molecular tools to support cultivar breeding and innovation. In this work, we report the development and analysis of 20 new Simple Sequence Repeat (SSR) markers in Mandevilla. Microsatellites were isolated from two enriched small-insert genomic libraries of Mandevilla × amabilis. The diversity parameters estimated after their amplification in a group of 11 commercial genotypes illustrate the effect of two opposite drifts: the high relatedness of cultivars belonging to the same commercial group and the high divergence of other cultivars, especially M. × amabilis. Based on their different band patterns, six genotypes were uniquely distinguished, and two groups of sport mutations remained undistinguishable. The amplification of the SSRs in three wild species suggested the existence of unexploited diversity available to be introgressed into the commercial pool. This is the first report of available microsatellites in Mandevilla. -

Caryologia International Journal of Cytology, Cytosystematics and Cytogenetics
0008-7114 2019 Vol. 72 – n. 1 72 – n. Vol. Caryologia 2019 International Journal of Cytology, Vol. 72 - n. 1 Cytosystematics and Cytogenetics Caryologia International Journal of Cytology, Cytosystematics and Cytogenetics International Journal of Cytology, FIRENZE PRESSUNIVERSITY FUP Caryologia. International Journal of Cytology, Cytosystematics and Cytogenetics Caryologia is devoted to the publication of original papers, and occasionally of reviews, about plant, animal and human kar- yological, cytological, cytogenetic, embryological and ultrastructural studies. Articles about the structure, the organization and the biological events relating to DNA and chromatin organization in eukaryotic cells are considered. Caryologia has a strong tradition in plant and animal cytosystematics and in cytotoxicology. Bioinformatics articles may be considered, but only if they have an emphasis on the relationship between the nucleus and cytoplasm and/or the structural organization of the eukaryotic cell. Editor in Chief Associate Editors Alessio Papini Alfonso Carabez-Trejo - Mexico City, Mexico Dipartimento di Biologia Vegetale Katsuhiko Kondo - Hagishi-Hiroshima, Japan Università degli Studi di Firenze Canio G. Vosa - Pisa, Italy Via La Pira, 4 – 0121 Firenze, Italy Subject Editors Mycology Plant Cytogenetics Histology and Cell Biology Renato Benesperi Lorenzo Peruzzi Alessio Papini Università di Firenze, Italy Università di Pisa Università di Firenze Human and Animal Cytogenetics Plant Karyology and Phylogeny Zoology Michael Schmid Andrea Coppi Mauro Mandrioli University of Würzburg, Germany Università di Firenze Università di Modena e Reggio Emilia Editorial Assistant Sara Falsini Università degli Studi di Firenze, Italy Editorial Advisory Board G. Berta - Alessandria, Italy G. Delfno - Firenze, Italy M. Mandrioli - Modena, Italy D. Bizzaro - Ancona, Italy S. D'Emerico - Bari, Italy G. -

The Hemiptera-Sternorrhyncha (Insecta) of Hong Kong, China—An Annotated Inventory Citing Voucher Specimens and Published Records
Zootaxa 2847: 1–122 (2011) ISSN 1175-5326 (print edition) www.mapress.com/zootaxa/ Monograph ZOOTAXA Copyright © 2011 · Magnolia Press ISSN 1175-5334 (online edition) ZOOTAXA 2847 The Hemiptera-Sternorrhyncha (Insecta) of Hong Kong, China—an annotated inventory citing voucher specimens and published records JON H. MARTIN1 & CLIVE S.K. LAU2 1Corresponding author, Department of Entomology, Natural History Museum, Cromwell Road, London SW7 5BD, U.K., e-mail [email protected] 2 Agriculture, Fisheries and Conservation Department, Cheung Sha Wan Road Government Offices, 303 Cheung Sha Wan Road, Kowloon, Hong Kong, e-mail [email protected] Magnolia Press Auckland, New Zealand Accepted by C. Hodgson: 17 Jan 2011; published: 29 Apr. 2011 JON H. MARTIN & CLIVE S.K. LAU The Hemiptera-Sternorrhyncha (Insecta) of Hong Kong, China—an annotated inventory citing voucher specimens and published records (Zootaxa 2847) 122 pp.; 30 cm. 29 Apr. 2011 ISBN 978-1-86977-705-0 (paperback) ISBN 978-1-86977-706-7 (Online edition) FIRST PUBLISHED IN 2011 BY Magnolia Press P.O. Box 41-383 Auckland 1346 New Zealand e-mail: [email protected] http://www.mapress.com/zootaxa/ © 2011 Magnolia Press All rights reserved. No part of this publication may be reproduced, stored, transmitted or disseminated, in any form, or by any means, without prior written permission from the publisher, to whom all requests to reproduce copyright material should be directed in writing. This authorization does not extend to any other kind of copying, by any means, in any form, and for any purpose other than private research use. -

2015 SNA Research Conference Proceedings
PROCEEDINGS OF RESEARCH CONFERENCE Sixtieth Annual Report 2015 Compiled and Edited By: Dr. Nick Gawel Tennessee State University College of Agriculture, Human and Natural Sciences Nursery Research Center 472 Cadillac Lane McMinnville, TN 37110 SNA Research Conference Vol. 60 2015 60th Annual Southern Nursery Association Research Conference Proceedings 2014 Southern Nursery Association, Inc. PO Box 801454 Acworth, GA 30101 Tel: 678-809-9992 Fax: 678-809-9993 [email protected] www.sna.org Proceedings of the SNA Research Conference are published annually by the Southern Nursery Association. It is the fine men and women in horticultural research that we, the Southern Nursery Association, pledge our continued support and gratitude for their tireless efforts in the pursuit of the advancement of our industry. Additional Copies: 2015 CD-Rom Additional Copies: SNA Members $15.00* Horticultural Libraries $15.00* Contributing Authors $15.00* Non-Members $20.00* *includes shipping and handling © Published October, 2015 ii SNA Research Conference Vol. 60 2015 Southern Nursery Association, Inc. BOARD OF DIRECTORS President Immediate Past President Michael Hobbs Richard May Warren County Nursery May Nursery 6492 Beersheba Highway 178 May Nursery Road McMinnville, TN 37110 Havana, FL 32333 Tel: 931.668.8941 Tel: 800.342.7134 Fax: 931.668.2245 Fax: 888.242.8271 E-mail: [email protected] [email protected] Vice President/Treasurer Director Chapter 3 Director Chapter 4 Arkansas, Kentucky, Missouri, Alabama, Louisiana, Mississippi, Oklahoma, Tennessee -

Chemotaxonomic Investigation of Apocynaceae for Retronecine-Type Pyrrolizidine 2 Alkaloids Using HPLC-MS/MS 3 4 Lea A
bioRxiv preprint doi: https://doi.org/10.1101/2020.08.23.260091; this version posted August 24, 2020. The copyright holder for this preprint (which was not certified by peer review) is the author/funder, who has granted bioRxiv a license to display the preprint in perpetuity. It is made available under aCC-BY-NC-ND 4.0 International license. 1 Chemotaxonomic Investigation of Apocynaceae for Retronecine-Type Pyrrolizidine 2 Alkaloids Using HPLC-MS/MS 3 4 Lea A. Barny1, Julia A. Tasca1,2, Hugo A. Sanchez1, Chelsea R. Smith3, Suzanne Koptur4, Tatyana 5 Livshultz3,5,*, Kevin P. C. Minbiole1,* 6 1Department of Chemistry, Villanova University, Villanova, PA 19085, USA 7 2Department of Biochemistry and Molecular Biophysics, Perelman School of Medicine at the 8 University of Pennsylvania, 3400 Civic Center Blvd, Philadelphia, PA 19104, USA 9 3Department of Biodiversity Earth and Environmental Sciences, Drexel University, PA 19104, 10 USA 11 4Department of Biology, Florida International University, 11200 SW 8th St, Miami, FL 33199 12 5Department of Botany, Academy of Natural Sciences of Drexel University, 1900 Benjamin 13 Franklin Parkway, Philadelphia PA, 19103, USA 14 Email addresses: 15 LAB: [email protected] 16 JAT: [email protected] 17 HAS: [email protected] 18 CRS: [email protected] 19 SK: [email protected] 20 TL: [email protected] 21 KPCM: [email protected] 22 * Authors for correspondence: [email protected] and [email protected] 1 bioRxiv preprint doi: https://doi.org/10.1101/2020.08.23.260091; this version posted August 24, 2020. The copyright holder for this preprint (which was not certified by peer review) is the author/funder, who has granted bioRxiv a license to display the preprint in perpetuity. -

(12) United States Plant Patent (10) Patent No.: US PP20,065 P2 Henny Et Al
USOOPP20065P2 (12) United States Plant Patent (10) Patent No.: US PP20,065 P2 Henny et al. (45) Date of Patent: Jun. 9, 2009 (54) MANDEVILLA PLANT NAMED “GEM06-1 (52) U.S. Cl. ....................................................... Pt/232 5O) Latin N Mandevilla hwbrid (58) Field of Classification Search .................... PtF232 (50) Varietalat1n Name: Denomination: Matileia EVOri6-1 See application file for complete search history. (75) Inventors: BarbaraRichard J.HK. Henny, T Tavares, FL FL (US (US); Pririmary ExamiExaminer—Annette Annette HPH Para enny, Tavares, FL (US) (74) Attorney, Agent, or Firm—C. A. Whealy (73) Assignee: sity Ornamentals, Inc., Tavares, FL (57) ABSTRACT (*) Notice: Subject to any disclaimer, the term of this A eW and distinct cultivar of Mandevilla plant named patent is extended or adjusted under 35 GEM06-1, characterized by its upright, outwardly spread U.S.C. 154(b) by 0 days. ing and Vining plant habit; moderately vigorous growth habit; large, Smooth, Shiny and dark green-colored leaves; (21) Appl. No.: 12/154.222 thick stems; white-colored flowers with distinct yellow orange-colored centers; flowers with imbricate petals with (22) Filed: May 21, 2008 ruffled margins; and good garden performance. (51) Int. Cl. AOIH 5/00 (2006.01) 1 Drawing Sheet 1. 2 Botanical designation: Mandevilla hybrid. 1. These characteristics in combination distinguish Cultivar denomination: GEMO6-1. GEM06-1 as a new and distinct cultivar of Mandevilla. BACKGROUND OF THE INVENTION . Upright, outwardly spreading and Vining plant habit. 5 The present invention relates to a new and distinct cultivar . Moderately vigorous growth habit. of Mandevilla, botanically known as Mandevilla hybrid and . -

Flora Ornamental Española, VI. Araliaceae
Flora Ornamental Flora Ornamental Española Española Tomo I Magnoliaceae • Casuarinaceae Tomo II Cactaceae • Cucurbitaceae Tomo III Salicaceae • Chrysobalanaceae Tomo IV Papilionaceae • Proteaceae Tomo V Flora Ornamental Española Santalaceae • Polygalaceae Tomo VI VI Araliaceae • Boraginaceae Tomo VII Verbenaceae • Rubiaceae Tomo VIII Caprifoliaceae • Asteraceae Tomo IX Limnocharitaceae • Pandanaceae Tomo X Lemnaceae • Orchidaceae Tomo XI Selaginellaceae • Ephedraceae Araliaceae • Boraginaceae Tomo XII VI Clave de familias adenda e índices generales Araliaceae • Boraginaceae ASOCIACIÓN ESPAÑOLA DE PARQUES Y Mundi-Prensa Libros, s.a. JARDINES PÚBLICOS flora 6_fam_1_2.qxp 27/4/10 08:56 Página 2 flora 6_fam_1_2.qxp 27/4/10 08:56 Página 3 FLORA ORNAMENTAL ESPAÑOLA Las plantas cultivadas en la España peninsular e insular Tomo VI Araliaceae • Boraginaceae Coordinador José Manuel Sánchez de Lorenzo Cáceres Coedición Junta de Andalucía Consejería de Agricultura y Pesca Ediciones Mundi-Prensa Madrid - Barcelona - México Asociación Española de Parques y Jardines Públicos flora 6_fam_1_2.qxp 27/4/10 08:56 Página 4 JUNTA DE ANDALUCÍA Consejería de Agricultura y Pesca Viceconsejería Servicio de Publicaciones y Divulgación C/ Tabladilla, s/n. 41071 SEVILLA Tlf.: 955 032 081 - Fax: 955 032 528 GRUPO MUNDI-PRENSA Mundi-Prensa Libros, S.A. Castelló, 37 - 28001 MADRID Tlf.: +34 914 363 700 - Fax: +34 915 753 998 E-mail: [email protected] Internet: www.mundiprensa.com Mundi-Prensa Barcelona Editorial Aedos, S.A. Aptdo. de Correos 33388 - 08009 BARCELONA Tlf.: +34 629 262 328 - Fax: +34 933 116 881 E-mail: [email protected] Mundi-Prensa México, S.A. de C.V. Río Pánuco, 141 - Col. Cuauhtémoc 06500 MÉXICO, D.F. Tlf.: 00 525 55 533 56 58 - Fax: 00 525 55 514 67 99 E-mail: [email protected] ASOCIACIÓN ESPAÑOLA DE PARQUES Y JARDINES PÚBLICOS C/ Madrid s/n, esquina c/ Río Humera 28223 Pozuelo de Alarcón, MADRID Tlf.: 917 990 394 - Fax: 917 990 362 www.aepjp.es © Textos y fotografías de los autores. -

Listado De Plantas Ornamentales Urbanas De Tunja (Boyacá, Colombia)
Vol. 10 (1) pp. 57-78, enero-junio del 2020 MUTIS https://doi.org/10.21789/22561498.1602 RESEARCH ARTICLE 57 Listado de plantas ornamentales urbanas de Tunja (Boyacá, Colombia) A List of Urban Ornamental Plants in Tunja (Boyacá, Colombia) Wilson Ricardo Álvaro Alba Grupo de Investigación Biología para la Conservación, Facultad de Ciencias Básicas, Escuela de Ciencias Biológicas, Universidad Pedagógica y Tecnológica de Colombia https://orcid.org/0000-0003-3089-9515 | [email protected] Mónica Patricia Díaz Pita Grupo de Investigación Biología para la Conservación, Facultad de Ciencias Básicas, Escuela de Ciencias Biológicas, Universidad Pedagógica y Tecnológica de Colombia https://orcid.org/0000-0001-9477-694X | [email protected] Fecha de recepción: 20 de abril de 2020 Fecha de aceptación: 29 de mayo de 2020 Sugerencia de citación: Álvaro-Alba, W. R. y Díaz-Pita, M. P. (2020). Listado de plantas ornamentales urbanas de Tunja (Boyacá, Colombia). Mutis, 10(1), 57-78. doi: 10.21789/22561498.1602 RESUMEN Se presenta el inventario florístico de las plantas ornamentales de la ciudad de Tunja (Boyacá). Se encontraron 430 especies, distribuidas en 314 géneros y 101 familias, de las cuales 307 especies son Eudicotiledóneas, 96 Monocotiledóneas, 11 Pteridofitos, 10 Gimnospermas y 6 Magnólidas. A nivel florístico, las familias Asteraceae, Cactaceae, Orchidaceae, Solanaceae y Asparagaceae presentaron el mayor número de géneros y especies. El hábito de crecimiento más importante en términos de riqueza de especies fue el de las hierbas, seguido por los hábitos leñosos (árboles y arbustos). En am- bientes de exterior se encontraron más especies de tipo arbóreo y arbustivo, mientras que en am- bientes de interior predominaron las suculentas. -

Valid Names Results Saissetia Coffeae (Walker, 1852) (Coccidae: Saissetia)
29/10/2018 scalenet.info/catalogue/Saissetia coffeae/ SEARCH CATALOGUE PARTS OF NAMES COMMON NAMES DISTRIBUTIONS ECOLOGICAL ASSOCIATES REFERENCES AUTHOR Valid Names Results Saissetia coffeae (Walker, 1852) (Coccidae: Saissetia) Nomenclatural History Lecanium coffeae Walker 1852: 1079. Type data: SRI LANKA:. Lectotype, female, by subsequent designation (Willia1957,314). Type depository: London: The Natural History Museum, England, UK . accepted valid name Chermes anthurii Boisduval 1867: 328. Type data: FRANCE: Paris, in greenhouse, on Anthurium sp. and on Caladium sp.. Syntypes, female, junior synonym (discovered by Green1904d, 232). Notes: Depository of type material unknown (Ben-Dov, 1993). Chermes filicum Boisduval 1867: 335. Type data: FRANCE: Paris, in greenhouse on fern, Pteris sp.. Syntypes, female, junior synonym (discovered by Green1904d, 232). Notes: Depository of type material unknown (Ben-Dov, 1993). Chermes hibernaculorum Boisduval 1867: 337. Type data: FRANCE: Paris, in greenhouse on fern, Zamia, Ardisia, Grevillea, Gardenia, Brexia and many more hosts.. Syntypes, female, junior synonym (discovered by Kirkal1902, 105). Notes: Depository of type material unknown. Lecanium hemisphaericum Targioni Tozzetti 1867: 26. Type data: ITALY: Firenze, Garden of Royal Museum, on Bletia sp. and Phyllarthron sp.. Syntypes, female, junior synonym (discovered by CockerPa1899, 164). Notes: Type material probably lost; G. Pellizzari Scaltriti, 1990, personal communication to Yair Ben-Dov. Lecanium hybernaculorum Targioni Tozzetti 1868: 37. misspelling of species epithet Lecanium filicum Signoret 1874a: 436. change of combination Lecanium hibernaculorum (Walker, 1852); Signoret 1874a: 437. subsequent use Lecanium beaumontiae Douglas 1887b: 95. Type data: ENGLAND: Royal Gardens, Kew, on Beaumontia grandiflora.. Syntypes, female, Type depository: London: The Natural History Museum, England, UK . junior synonym (discovered by Sander1909a, 439). -

Redalyc.Estudios En Las Apocynaceae Neotropicales XIX: La Familia
Darwiniana ISSN: 0011-6793 [email protected] Instituto de Botánica Darwinion Argentina Morales, J. Francisco Estudios en las Apocynaceae neotropicales XIX: La familia Apocynaceae (Rauvolfioideae, Apocynoideae) de Costa Rica Darwiniana, vol. 43, núm. 1-4, diciembre, 2005, pp. 90-191 Instituto de Botánica Darwinion Buenos Aires, Argentina Disponible en: http://www.redalyc.org/articulo.oa?id=66943411 Cómo citar el artículo Número completo Sistema de Información Científica Más información del artículo Red de Revistas Científicas de América Latina, el Caribe, España y Portugal Página de la revista en redalyc.org Proyecto académico sin fines de lucro, desarrollado bajo la iniciativa de acceso abierto DARWINIANA 43(1-4): 90-191. 2005 ISSN 0011-6793 ESTUDIOS EN LAS APOCYNACEAE NEOTROPICALES XIX: LA FAMILIA APOCYNACEAE S. STR. (APOCYNOIDEAE, RAUVOLFIOIDEAE) DE COSTA RICA J. FRANCISCO MORALES Instituto Nacional de Biodiversidad (INBio) Apto. 23-3100, Santo Domingo de Heredia, Costa Rica. E-mail: [email protected] ABSTRACT: Morales, J. F. 2005. Studies in the neotropical Apocynaceae XIX: the family Apocynaceae (Rauvolfioideae, Apocynoideae) in Costa Rica. Darwiniana 43(1-4): 90-191. A systematic treatment of the Costarican Apocynaceae (subfamilies Rauvolfioideae and Apocynoideae) is given. Thirty genera and 80 species are treated, including descriptions, keys and specimens examined, as well as the most relevant bibliographic references. Photographs for almost all the genera and species are included. Keywords: Apocynaceae, Apocynoideae, Rauvolfioideae, Floristics, Costa Rica. RESUMEN: Morales, J. F. 2005. Estudios en las Apocynaceae neotropicales XIX: la familia Apocynaceae (Rauvolfioideae, Apocynoideae) en Costa Rica. Darwiniana 43(1-4): 90-191. Se ofrece un tratamiento sistemático de la familia Apocynaceae, subfamilias Rauvolfioideae y Apocynoideae para Costa Rica. -

A Note on the Chestnut Vine and SéRaphin Mottet's 'Dictionnaire
Blumea 62, 2018: 240–244 ISSN (Online) 2212-1676 www.ingentaconnect.com/content/nhn/blumea RESEARCH ARTICLE https://doi.org/10.3767/blumea.2018.62.03.06 A note on the chestnut vine and Séraphin Mottet’s ‘Dictionnaire Pratique d’Horticulture et Jardinage’ (1892–1899) D.J. Mabberley1 Key words Abstract The discovery, introduction and naming of the chestnut vine (Tetrastigma voinierianum, Vitaceae), a Vietnamese plant, is examined and bibliographic citation corrected. The 173 at the time of writing disregarded new Baltet species names and new combinations made in Séraphin Mottet’s Dictionnaire Pratique d’Horticulture et Jardinage Bois (1892–1899) include six names in current use, hitherto attributed to later authors. All the other Mottet novelties, as well Bon as the 125 disregarded in Nicholson’s ‘mother volume’, his Illustrated Dictionary of Gardening (four names in current Miconia use) and its later Century Supplement (22) have been passed to IPNI editors as have 15 from Bois’s Dictionnaire Mottet d’Horticulture Illustré: none disturbs current nomenclature save six changes in authority. Many species introduced Nicholson to cultivation by Veitch were much cited by Mottet and Nicholson but were first published in Veitch catalogues, Sallier necessitating a new name in Miconia (Melastomataceae) and seven changes in authority in names in current use. Tetrastigma voinierianum Veitch Published on 20 February 2018 Voinier THE CHESTNUT VINE Voinier was recalled to France in 1888. It is perhaps not co- incidental that there was a seedsman business, ‘Voinier et The chestnut vine, so-called because of its chocolate-brown Blanpied’ founded in December 1892 at 14 fg Ste Catherine, stems, is a very vigorous liana, widely grown in warm countries Nancy, France (http://gallica.bnf.fr/ark:/12148/bpt6k56652574/ as a screening plant or for ground-cover, particularly as it is f10), then at ‘77 St-Georges’ where by 1892 succeeded by very shade-tolerant. -
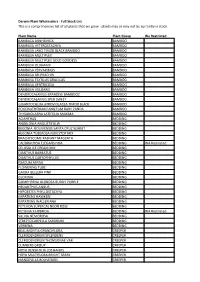
Full Stock List.Pdf
Darwin Plant Wholesalers - Full Stock List This is a comprehensive list of all plants that we grow - plants may or may not be currently in stock Plant Name Plant Group Wa Restricted BAMBUSA ARNHEMICA BAMBOO BAMBUSA HETEROSTACHYA BAMBOO BAMBUSA LAKO TIMOR BLACK BAMBOO BAMBOO BAMBUSA MULTIPLEX BAMBOO BAMBUSA MULTIPLEX GOLD GODDESS BAMBOO BAMBUSA OLDHAMII BAMBOO BAMBUSA PERVARIBILIS BAMBOO BAMBUSA SRI PRACHIN BAMBOO BAMBUSA TEXTILLIS GRACILLIS BAMBOO BAMBUSA VENTRICOSA BAMBOO BAMBUSA VULGARIS BAMBOO DENDROCALAMUS BRANDISII BAMBOOZ BAMBOO DENDROCALAMUS SPER SWEET BAMBOO GIGANTOCHLOA ATROVIOLACEA TIMOR BLACK BAMBOO POGONATHERUM PANICEUM BABY PANDA BAMBOO THYSANOLAENA LATIFOLIA MAXIMA BAMBOO ACIANTHUS BEDDING ANGELONIA ANGUSTIFOLIA BEDDING BEGONIA BOLIVIENSIS SANTA CRUZ SUNSET BEDDING BEGONIA TUBEROSA NON STOP MIX BEDDING BRACHYSCOME RADIANT MAGENTA BEDDING CALIBRACHOA ELEGANS NOA BEDDING WA Restricted CELOSIA ICE CREAM MIX BEDDING DIANTHUS BARBATUS BEDDING DIANTHUS CARYOPHYLLUS BEDDING EXACUM AFFINE BEDDING FLOWERING TUBE BEDDING GAURA BELLERA PINK BEDDING GLOXINIA BEDDING GOMPHRENA GLOBOSA BUDDY PURPLE BEDDING HELIANTHUS ANNUS BEDDING HYPOESTES PHYLLOSTACHYA BEDDING IMPATIENS HAWKERI BEDDING IMPATIENS WALLERIANA BEDDING PETCHOA SUPERCAL NEON ROSE BEDDING PETUNIA X HYBRIDA BEDDING WA Restricted SALVIA NEMOROSA BEDDING STREPTOCARPELLA SAXORUM BEDDING VERBENA BEDDING BEAUMONTIA GRANDIFLORA CREEPER CLERODENDRUM SPLENDENS CREEPER CLERODENDRUM THOMSONAE VAR CREEPER CLIMBERS GROUP CREEPER HOYA DENSIFOLIA LOS BANOS CREEPER HOYA MULTIFLORA BRIGHT SPARK