Verwendung Von Polyoxometallaten Gegen Den Befall Von
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Method for Producing Methacrylic Acid And/Or Ester Thereof
(19) TZZ _T (11) EP 2 894 224 A1 (12) EUROPEAN PATENT APPLICATION published in accordance with Art. 153(4) EPC (43) Date of publication: (51) Int Cl.: 15.07.2015 Bulletin 2015/29 C12P 7/62 (2006.01) C12N 15/09 (2006.01) (21) Application number: 13835104.4 (86) International application number: PCT/JP2013/005359 (22) Date of filing: 10.09.2013 (87) International publication number: WO 2014/038216 (13.03.2014 Gazette 2014/11) (84) Designated Contracting States: (72) Inventors: AL AT BE BG CH CY CZ DE DK EE ES FI FR GB • SATO, Eiji GR HR HU IE IS IT LI LT LU LV MC MK MT NL NO Yokohama-shi PL PT RO RS SE SI SK SM TR Kanagawa 227-8502 (JP) Designated Extension States: • YAMAZAKI, Michiko BA ME Yokohama-shi Kanagawa 227-8502 (JP) (30) Priority: 10.09.2012 JP 2012198840 • NAKAJIMA, Eiji 10.09.2012 JP 2012198841 Yokohama-shi 31.01.2013 JP 2013016947 Kanagawa 227-8502 (JP) 30.07.2013 JP 2013157306 • YU, Fujio 01.08.2013 JP 2013160301 Yokohama-shi 01.08.2013 JP 2013160300 Kanagawa 227-8502 (JP) 20.08.2013 JP 2013170404 • FUJITA, Toshio Yokohama-shi (83) Declaration under Rule 32(1) EPC (expert Kanagawa 227-8502 (JP) solution) • MIZUNASHI, Wataru Yokohama-shi (71) Applicant: Mitsubishi Rayon Co., Ltd. Kanagawa 227-8502 (JP) Tokyo 100-8253 (JP) (74) Representative: Hoffmann Eitle Patent- und Rechtsanwälte PartmbB Arabellastraße 30 81925 München (DE) (54) METHOD FOR PRODUCING METHACRYLIC ACID AND/OR ESTER THEREOF (57) To provide a method for directly and efficiently producing methacrylic acid in a single step from renew- able raw materials and/or biomass arising from the utili- zation of the renewable raw materials. -

Ecology and Epidemiology of Campylobacter Jejuni in Broiler Chickens
Ecology and Epidemiology of Campylobacter jejuni in Broiler Chickens A DISSERTATION SUBMITTED TO THE FACULTY OF THE UNIVERSITY OF MINNESOTA BY Hae Jin Hwang IN PARTIALL FULFILLMENT OF THE REQUIREMENTS FOR THE DEGREE OF DOCTOR OF PHILOSOPHY Dr. Randall Singer, Dr. George Maldonado June 2019 © Hae Jin Hwang, 2019 Acknowledgements I would like to sincerely thank my advisor, Dr. Randall Singer, for his intellectual guidance and support, great patience, and mentorship, which made this dissertation possible. I would also like to thank Dr. George Maldonado for his continuous encouragement and support. I would further like to thank my thesis committee, Dr. Richard Isaacson and Dr. Timothy Church, for their guidance throughout my doctoral training. I thank all my friends and colleagues I met over the course of my studies. I am especially indebted to my friends, Dr. Kristy Lee, Dr. Irene Bueno Padilla, Dr. Elise Lamont, Madhumathi Thiruvengadam, Dr. Kaushi Kanankege and Dr. Sylvia Wanzala, for their support and friendship. Heartfelt gratitude goes to my family, for always believing in me, encouraging me and helping me get through the difficult and stressful times during my studies. Lastly, I thank Sven and Bami for being the best writing companions I could ever ask for. i Abstract Campylobacteriosis, predominantly caused by Campylobacter jejuni, is a common, yet serious foodborne illness. With consumption and handling of poultry products as the most important risk factor of campylobacteriosis, reducing Campylobacter contamination in poultry products is considered the best public health intervention to reduce the burden and costs associated with campylobacteriosis. To this end, there is a need to improve our understanding of epidemiology and ecology of Campylobacter jejuni in poultry. -

Bioprospecting from Marine Sediments of New Brunswick, Canada: Exploring the Relationship Between Total Bacterial Diversity and Actinobacteria Diversity
Mar. Drugs 2014, 12, 899-925; doi:10.3390/md12020899 OPEN ACCESS marine drugs ISSN 1660-3397 www.mdpi.com/journal/marinedrugs Article Bioprospecting from Marine Sediments of New Brunswick, Canada: Exploring the Relationship between Total Bacterial Diversity and Actinobacteria Diversity Katherine Duncan 1, Bradley Haltli 2, Krista A. Gill 2 and Russell G. Kerr 1,2,* 1 Department of Biomedical Sciences, University of Prince Edward Island, 550 University Avenue, Charlottetown, PE C1A 4P3, Canada; E-Mail: [email protected] 2 Department of Chemistry, University of Prince Edward Island, 550 University Avenue, Charlottetown, PE C1A 4P3, Canada; E-Mails: [email protected] (B.H.); [email protected] (K.A.G.) * Author to whom correspondence should be addressed; E-Mail: [email protected]; Tel.: +1-902-566-0565; Fax: +1-902-566-7445. Received: 13 November 2013; in revised form: 7 January 2014 / Accepted: 21 January 2014 / Published: 13 February 2014 Abstract: Actinomycetes are an important resource for the discovery of natural products with therapeutic properties. Bioprospecting for actinomycetes typically proceeds without a priori knowledge of the bacterial diversity present in sampled habitats. In this study, we endeavored to determine if overall bacterial diversity in marine sediments, as determined by 16S rDNA amplicon pyrosequencing, could be correlated with culturable actinomycete diversity, and thus serve as a powerful tool in guiding future bioprospecting efforts. Overall bacterial diversity was investigated in eight marine sediments from four sites in New Brunswick, Canada, resulting in over 44,000 high quality sequences (x̄ = 5610 per sample). Analysis revealed all sites exhibited significant diversity (H’ = 5.4 to 6.7). -

The Subway Microbiome: Seasonal Dynamics and Direct Comparison Of
Gohli et al. Microbiome (2019) 7:160 https://doi.org/10.1186/s40168-019-0772-9 RESEARCH Open Access The subway microbiome: seasonal dynamics and direct comparison of air and surface bacterial communities Jostein Gohli1* , Kari Oline Bøifot1,2, Line Victoria Moen1, Paulina Pastuszek3, Gunnar Skogan1, Klas I. Udekwu4 and Marius Dybwad1,2 Abstract Background: Mass transit environments, such as subways, are uniquely important for transmission of microbes among humans and built environments, and for their ability to spread pathogens and impact large numbers of people. In order to gain a deeper understanding of microbiome dynamics in subways, we must identify variables that affect microbial composition and those microorganisms that are unique to specific habitats. Methods: We performed high-throughput 16S rRNA gene sequencing of air and surface samples from 16 subway stations in Oslo, Norway, across all four seasons. Distinguishing features across seasons and between air and surface were identified using random forest classification analyses, followed by in-depth diversity analyses. Results: There were significant differences between the air and surface bacterial communities, and across seasons. Highly abundant groups were generally ubiquitous; however, a large number of taxa with low prevalence and abundance were exclusively present in only one sample matrix or one season. Among the highly abundant families and genera, we found that some were uniquely so in air samples. In surface samples, all highly abundant groups were also well represented in air samples. This is congruent with a pattern observed for the entire dataset, namely that air samples had significantly higher within-sample diversity. We also observed a seasonal pattern: diversity was higher during spring and summer. -

Phenotypic and Microbial Influences on Dairy Heifer Fertility and Calf Gut Microbial Development
Phenotypic and microbial influences on dairy heifer fertility and calf gut microbial development Connor E. Owens Dissertation submitted to the faculty of the Virginia Polytechnic Institute and State University in partial fulfillment of the requirements for the degree of Doctor of Philosophy In Animal Science, Dairy Rebecca R. Cockrum Kristy M. Daniels Alan Ealy Katharine F. Knowlton September 17, 2020 Blacksburg, VA Keywords: microbiome, fertility, inoculation Phenotypic and microbial influences on dairy heifer fertility and calf gut microbial development Connor E. Owens ABSTRACT (Academic) Pregnancy loss and calf death can cost dairy producers more than $230 million annually. While methods involving nutrition, climate, and health management to mitigate pregnancy loss and calf death have been developed, one potential influence that has not been well examined is the reproductive microbiome. I hypothesized that the microbiome of the reproductive tract would influence heifer fertility and calf gut microbial development. The objectives of this dissertation were: 1) to examine differences in phenotypes related to reproductive physiology in virgin Holstein heifers based on outcome of first insemination, 2) to characterize the uterine microbiome of virgin Holstein heifers before insemination and examine associations between uterine microbial composition and fertility related phenotypes, insemination outcome, and season of breeding, and 3) to characterize the various maternal and calf fecal microbiomes and predicted metagenomes during peri-partum and post-partum periods and examine the influence of the maternal microbiome on calf gut development during the pre-weaning phase. In the first experiment, virgin Holstein heifers (n = 52) were enrolled over 12 periods, on period per month. On -3 d before insemination, heifers were weighed and the uterus was flushed. -

Halophilic Microorganisms Are Responsible for the Rosy Discolouration of Saline Environments in Three Historical Buildings with Mural Paintings
Halophilic Microorganisms Are Responsible for the Rosy Discolouration of Saline Environments in Three Historical Buildings with Mural Paintings Jo¨ rg D. Ettenauer1*, Valme Jurado2, Guadalupe Pin˜ ar1, Ana Z. Miller2,3, Markus Santner4, Cesareo Saiz-Jimenez2, Katja Sterflinger1 1 VIBT-BOKU, University of Natural Resources and Life Sciences, Department of Biotechnology, Vienna, Austria, 2 Instituto de Recursos Naturales y Agrobiologia, IRNAS- CSIC, Sevilla, Spain, 3 CEPGIST/CERENA, Instituto Superior Te´cnico, Universidade de Lisboa, Lisboa, Portugal, 4 Bundesdenkmalamt, Abteilung fu¨r Konservierung und Restaurierung, Vienna, Austria Abstract A number of mural paintings and building materials from monuments located in central and south Europe are characterized by the presence of an intriguing rosy discolouration phenomenon. Although some similarities were observed among the bacterial and archaeal microbiota detected in these monuments, their origin and nature is still unknown. In order to get a complete overview of this biodeterioration process, we investigated the microbial communities in saline environments causing the rosy discolouration of mural paintings in three Austrian historical buildings using a combination of culture- dependent and -independent techniques as well as microscopic techniques. The bacterial communities were dominated by halophilic members of Actinobacteria, mainly of the genus Rubrobacter. Representatives of the Archaea were also detected with the predominating genera Halobacterium, Halococcus and Halalkalicoccus. Furthermore, halophilic bacterial strains, mainly of the phylum Firmicutes, could be retrieved from two monuments using special culture media. Inoculation of building materials (limestone and gypsum plaster) with selected isolates reproduced the unaesthetic rosy effect and biodeterioration in the laboratory. Citation: Ettenauer JD, Jurado V, Pin˜ar G, Miller AZ, Santner M, et al. -
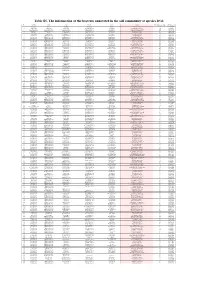
Table S5. the Information of the Bacteria Annotated in the Soil Community at Species Level
Table S5. The information of the bacteria annotated in the soil community at species level No. Phylum Class Order Family Genus Species The number of contigs Abundance(%) 1 Firmicutes Bacilli Bacillales Bacillaceae Bacillus Bacillus cereus 1749 5.145782459 2 Bacteroidetes Cytophagia Cytophagales Hymenobacteraceae Hymenobacter Hymenobacter sedentarius 1538 4.52499338 3 Gemmatimonadetes Gemmatimonadetes Gemmatimonadales Gemmatimonadaceae Gemmatirosa Gemmatirosa kalamazoonesis 1020 3.000970902 4 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas indica 797 2.344876284 5 Firmicutes Bacilli Lactobacillales Streptococcaceae Lactococcus Lactococcus piscium 542 1.594633558 6 Actinobacteria Thermoleophilia Solirubrobacterales Conexibacteraceae Conexibacter Conexibacter woesei 471 1.385742446 7 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas taxi 430 1.265115184 8 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas wittichii 388 1.141545794 9 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas sp. FARSPH 298 0.876754244 10 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sorangium cellulosum 260 0.764953367 11 Proteobacteria Deltaproteobacteria Myxococcales Polyangiaceae Sorangium Sphingomonas sp. Cra20 260 0.764953367 12 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas panacis 252 0.741416341 -

Diversity and Taxonomic Novelty of Actinobacteria Isolated from The
Diversity and taxonomic novelty of Actinobacteria isolated from the Atacama Desert and their potential to produce antibiotics Dissertation zur Erlangung des Doktorgrades der Mathematisch-Naturwissenschaftlichen Fakultät der Christian-Albrechts-Universität zu Kiel Vorgelegt von Alvaro S. Villalobos Kiel 2018 Referent: Prof. Dr. Johannes F. Imhoff Korreferent: Prof. Dr. Ute Hentschel Humeida Tag der mündlichen Prüfung: Zum Druck genehmigt: 03.12.2018 gez. Prof. Dr. Frank Kempken, Dekan Table of contents Summary .......................................................................................................................................... 1 Zusammenfassung ............................................................................................................................ 2 Introduction ...................................................................................................................................... 3 Geological and climatic background of Atacama Desert ............................................................. 3 Microbiology of Atacama Desert ................................................................................................. 5 Natural products from Atacama Desert ........................................................................................ 9 References .................................................................................................................................. 12 Aim of the thesis ........................................................................................................................... -

Microbiology in Shale: Alternatives for Enhanced Gas Recovery
Graduate Theses, Dissertations, and Problem Reports 2015 Microbiology in Shale: Alternatives for Enhanced Gas Recovery Yael Tarlovsky Tucker Follow this and additional works at: https://researchrepository.wvu.edu/etd Recommended Citation Tucker, Yael Tarlovsky, "Microbiology in Shale: Alternatives for Enhanced Gas Recovery" (2015). Graduate Theses, Dissertations, and Problem Reports. 6834. https://researchrepository.wvu.edu/etd/6834 This Dissertation is protected by copyright and/or related rights. It has been brought to you by the The Research Repository @ WVU with permission from the rights-holder(s). You are free to use this Dissertation in any way that is permitted by the copyright and related rights legislation that applies to your use. For other uses you must obtain permission from the rights-holder(s) directly, unless additional rights are indicated by a Creative Commons license in the record and/ or on the work itself. This Dissertation has been accepted for inclusion in WVU Graduate Theses, Dissertations, and Problem Reports collection by an authorized administrator of The Research Repository @ WVU. For more information, please contact [email protected]. Microbiology in Shale: Alternatives for Enhanced Gas Recovery Yael Tarlovsky Tucker Dissertation submitted to the Davis College of Agriculture, Natural Resources and Design at West Virginia University in partial fulfillment of the requirements for the degree of Doctor of Philosophy in Genetics and Developmental Biology Jianbo Yao, Ph.D., Chair James Kotcon, Ph.D. -

Hermetia Illucens)
Intestinal Microbiota and Functional Characteristics of Black Soldier Fly Larvae (Hermetia Illucens) Zhineng Yuan ( [email protected] ) Sun Yat-Sen University Ying Ma Sun Yat-Sen University The school of agriculture Bingjie Tang Sun Yat-sen University School of Life Science Rouxian Zeng Sun Yat-sen University School of Life Science Qiang Zhou Sun Yat-sen University School of Life Science https://orcid.org/0000-0002-7678-0563 Original Article Keywords: Hermetia illucens, intestinal bacteria, utilization eciency, metagenomics Posted Date: February 4th, 2021 DOI: https://doi.org/10.21203/rs.3.rs-168343/v1 License: This work is licensed under a Creative Commons Attribution 4.0 International License. Read Full License Version of Record: A version of this preprint was published at Annals of Microbiology on March 12th, 2021. See the published version at https://doi.org/10.1186/s13213-021-01626-8. Page 1/17 Abstract Purpose: Black soldier y transforms organic waste into insect protein and fat, which makes it valuable to ecological utilization. This process is associated with intestinal microbiota. This research was developed to determine the type and functional characteristics of intestinal microbiota present in black soldier y larvae. Methods: In this research, metagenomics has been used to study black soldier y larvae gut bacteria, which involves the high abundance of the gut microbes advantage bacterium group, the impact, and physiological functions of the microbiota. Furthermore, intestinal bacteria and their related functions were investigated by bioinformatics analysis to evaluate potential the microbial strains that may be used to improve feed utilization eciency in factory farming. Result: The results showed that black soldier y larvae´ intestine contains more than 11,000 bacteria. -

Variation of the Frog Skin Microbiota Across an Environmental Gradient: Taxonomic Diversity and Potential Function
VARIATION OF THE FROG SKIN MICROBIOTA ACROSS AN ENVIRONMENTAL GRADIENT: TAXONOMIC DIVERSITY AND POTENTIAL FUNCTION Brandon J. Varela Department of Biology, Neotropical Environment Option McGill University, Montreal August, 2017 A thesis submitted to McGill University in partial fulfillment of the requirements of the degree of Master’s in Science in Biology Brandon J. Varela, 2017 1 TABLE OF CONTENTS ABSTRACT .............................................................................................................. 4 RÉSUMÉ .................................................................................................................. 5 ACKNOWLEDGEMENTS ...................................................................................... 7 CONTRIBUTIONS OF AUTHORS ......................................................................... 9 Introduction ............................................................................................................ 10 Thesis objectives ......................................................................................................................... 14 Hypothesis 1 ........................................................................................................................................ 15 Hypothesis 2 ........................................................................................................................................ 15 Hypothesis 3 ....................................................................................................................................... -

Characterization of Antibiotic Resistance Genes in the Species of the Rumen Microbiota
ARTICLE https://doi.org/10.1038/s41467-019-13118-0 OPEN Characterization of antibiotic resistance genes in the species of the rumen microbiota Yasmin Neves Vieira Sabino1, Mateus Ferreira Santana1, Linda Boniface Oyama2, Fernanda Godoy Santos2, Ana Júlia Silva Moreira1, Sharon Ann Huws2* & Hilário Cuquetto Mantovani 1* Infections caused by multidrug resistant bacteria represent a therapeutic challenge both in clinical settings and in livestock production, but the prevalence of antibiotic resistance genes 1234567890():,; among the species of bacteria that colonize the gastrointestinal tract of ruminants is not well characterized. Here, we investigate the resistome of 435 ruminal microbial genomes in silico and confirm representative phenotypes in vitro. We find a high abundance of genes encoding tetracycline resistance and evidence that the tet(W) gene is under positive selective pres- sure. Our findings reveal that tet(W) is located in a novel integrative and conjugative element in several ruminal bacterial genomes. Analyses of rumen microbial metatranscriptomes confirm the expression of the most abundant antibiotic resistance genes. Our data provide insight into antibiotic resistange gene profiles of the main species of ruminal bacteria and reveal the potential role of mobile genetic elements in shaping the resistome of the rumen microbiome, with implications for human and animal health. 1 Departamento de Microbiologia, Universidade Federal de Viçosa, Viçosa, Minas Gerais, Brazil. 2 Institute for Global Food Security, School of Biological