Rattan Und Insekten
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Title Butterflies Collected in and Around Lambir Hills National Park
Butterflies collected in and around Lambir Hills National Park, Title Sarawak, Malaysia in Borneo ITIOKA, Takao; YAMAMOTO, Takuji; TZUCHIYA, Taizo; OKUBO, Tadahiro; YAGO, Masaya; SEKI, Yasuo; Author(s) OHSHIMA, Yasuhiro; KATSUYAMA, Raiichiro; CHIBA, Hideyuki; YATA, Osamu Contributions from the Biological Laboratory, Kyoto Citation University (2009), 30(1): 25-68 Issue Date 2009-03-27 URL http://hdl.handle.net/2433/156421 Right Type Departmental Bulletin Paper Textversion publisher Kyoto University Contn bioL Lab, Kyoto Univ., Vot. 30, pp. 25-68 March 2009 Butterflies collected in and around Lambir Hills National ParK SarawaK Malaysia in Borneo Takao ITioKA, Takuji YAMAMo'rD, Taizo TzucHiyA, Tadahiro OKuBo, Masaya YAGo, Yasuo SEKi, Yasuhiro OHsHIMA, Raiichiro KATsuyAMA, Hideyuki CHiBA and Osamu YATA ABSTRACT Data ofbutterflies collected in Lambir Hills National Patk, Sarawak, Malaysia in Borneo, and in ks surrounding areas since 1996 are presented. In addition, the data ofobservation for several species wimessed but not caught are also presented. In tota1, 347 butterfly species are listed with biological information (habitat etc.) when available. KEY WORDS Lepidoptera! inventory1 tropical rainforesti species diversity1 species richness! insect fauna Introduction The primary lowland forests in the Southeast Asian (SEA) tropics are characterized by the extremely species-rich biodiversity (Whitmore 1998). Arthropod assemblages comprise the main part of the biodiversity in tropical rainforests (Erwin 1982, Wilson 1992). Many inventory studies have been done focusing on various arthropod taxa to reveal the species-richness of arthropod assemblages in SEA tropical rainforests (e.g. Holloway & lntachat 2003). The butterfly is one of the most studied taxonomic groups in arthropods in the SEA region; the accumulated information on the taxonomy and geographic distribution were organized by Tsukada & Nishiyama (1980), Yata & Morishita (1981), Aoki et al. -

A Compilation and Analysis of Food Plants Utilization of Sri Lankan Butterfly Larvae (Papilionoidea)
MAJOR ARTICLE TAPROBANICA, ISSN 1800–427X. August, 2014. Vol. 06, No. 02: pp. 110–131, pls. 12, 13. © Research Center for Climate Change, University of Indonesia, Depok, Indonesia & Taprobanica Private Limited, Homagama, Sri Lanka http://www.sljol.info/index.php/tapro A COMPILATION AND ANALYSIS OF FOOD PLANTS UTILIZATION OF SRI LANKAN BUTTERFLY LARVAE (PAPILIONOIDEA) Section Editors: Jeffrey Miller & James L. Reveal Submitted: 08 Dec. 2013, Accepted: 15 Mar. 2014 H. D. Jayasinghe1,2, S. S. Rajapaksha1, C. de Alwis1 1Butterfly Conservation Society of Sri Lanka, 762/A, Yatihena, Malwana, Sri Lanka 2 E-mail: [email protected] Abstract Larval food plants (LFPs) of Sri Lankan butterflies are poorly documented in the historical literature and there is a great need to identify LFPs in conservation perspectives. Therefore, the current study was designed and carried out during the past decade. A list of LFPs for 207 butterfly species (Super family Papilionoidea) of Sri Lanka is presented based on local studies and includes 785 plant-butterfly combinations and 480 plant species. Many of these combinations are reported for the first time in Sri Lanka. The impact of introducing new plants on the dynamics of abundance and distribution of butterflies, the possibility of butterflies being pests on crops, and observations of LFPs of rare butterfly species, are discussed. This information is crucial for the conservation management of the butterfly fauna in Sri Lanka. Key words: conservation, crops, larval food plants (LFPs), pests, plant-butterfly combination. Introduction Butterflies go through complete metamorphosis 1949). As all herbivorous insects show some and have two stages of food consumtion. -

ISSN 2320-5407 International Journal of Advanced Research (2015), Volume 3, Issue 1, 206-211
ISSN 2320-5407 International Journal of Advanced Research (2015), Volume 3, Issue 1, 206-211 Journal homepage: http://www.journalijar.com INTERNATIONAL JOURNAL OF ADVANCED RESEARCH RESEARCH ARTICLE BUTTERFLY SPECIES DIVERSITY AND ABUNDANCE IN MANIKKUNNUMALA FOREST OF WESTERN GHATS, INDIA. M. K. Nandakumar1, V.V. Sivan1, Jayesh P Joseph1, M. M. Jithin1, M. K. Ratheesh Narayanan2, N. Anilkumar1. 1 Community Agrobiodiversity Centre, M S Swaminathan Research Foundation,Puthoorvayal, Kalpetta, Kerala- 673121, India 2 Department of Botany, Payyanur College, Edat P.O., Kannur, Kerala-670327, India Manuscript Info Abstract Manuscript History: Butterflies, one of the most researched insect groups throughout the world, are also one of the groups that face serious threats of various kinds and in Received: 11 November 2014 Final Accepted: 26 December 2014 varying degrees. Wayanad district is one of the biodiversity rich landscapes Published Online: January 2015 within the biodiversity hot spot of Western Ghats. This paper essentially deals with the abundance and diversity of butterfly species in Key words: Manikkunnumala forest in Wayanad district of Western Ghats. The hilly ecosystem of this area is under various pressures mainly being Butterfly diversity, Abundance, anthropogenic. Still this area exhibits fairly good diversity; this includes Wayanad, Western Ghats some very rare and endemic butterflies. When assessed the rarity and *Corresponding Author abundance, six out of 94 recorded butterflies comes under the Indian Wildlife Protection Act, 1972. The area needs immediate attention to conserve the M. K. Nandakumar remaining vegetation in order to protect the butterfly diversity. Copy Right, IJAR, 2015,. All rights reserved INTRODUCTION Butterflies are one of the unique groups of insects, which grasp the attention of nature lovers worldwide. -

Journal of Chromatography a Flavylium Chromophores As Species Markers for Dragon's Blood Resins from Dracaena and Daemonorops
Journal of Chromatography A, 1209 (2008) 153–161 Contents lists available at ScienceDirect Journal of Chromatography A journal homepage: www.elsevier.com/locate/chroma Flavylium chromophores as species markers for dragon’s blood resins from Dracaena and Daemonorops trees Micaela M. Sousa a,b , Maria J. Melo a,b,∗ , A. Jorge Parola b , J. Sérgio Seixas de Melo c , Fernando Catarino d , Fernando Pina b, Frances E.M. Cook e, Monique S.J. Simmonds e, João A. Lopes f a Department of Conservation and Restoration, Faculty of Sciences and Technology, New University of Lisbon, 2829-516 Monte da Caparica, Portugal b REQUIMTE, CQFB, Chemistry Department, Faculty of Sciences and Technology, New University of Lisbon, 2829-516 Monte da Caparica, Portugal c Department of Chemistry, University of Coimbra, P3004-535 Coimbra, Portugal d Botanical Garden, University of Lisbon, Lisbon, Portugal e Royal Botanic Gardens, Kew, Richmond, Surrey TW9 3AB, UK f REQUIMTE, Servic¸ o de Química-Física, Faculdade de Farmácia, Universidade do Porto, Rua Aníbal Cunha 164, 4099-030 Porto, Portugal article info abstract Article history: A simple and rapid liquid chromatographic method with diode-array UV–vis spectrophotometric detec- Received 20 May 2008 tion has been developed for the authentication of dragon’s blood resins from Dracaena and Daemonorops Received in revised form 28 August 2008 trees. Using this method it was discovered that the flavylium chromophores, which contribute to the red Accepted 3 September 2008 colour of these resins, differ among the species and could be used as markers to differentiate among Available online 7 September 2008 species. A study of parameters, such as time of extraction, proportion of MeOH and pH, was undertaken to optimise the extraction of the flavyliums. -

Contributing Authors Tan Ching-Feaw Maziah Zakaria Azmi Mahvudin Laurence G
Contributing Authors Tan Ching-Feaw Maziah Zakaria Azmi Mahvudin Laurence G. Kirton Edited by Wan Razali Wan Mohd John Dransfield N. Manokaran Published jointly by INBAR and FRIM 1994 FOREWORD The International Network for Bamboo and Rattan was established in 1993 to promote collaborative research on these two non-timber forest products which are so important in large areas of the tropics. At a planningmeetinglheld in June 1993 in Singapore, national program scientists made a series of recommendations, following detailed discus- sions by Working Groups of experts in different subject areas. These recommendations focused on re-orienting much ongoing research so that it becomes more strategic and more rapidly promotes technology transfer. The Working Group on Information, Training, and Technology Trans- fer recommended that INBAR should issue a manual on nursery tech- niques for rattan. The Forest Research Institute Malaysia (FRIM), with funds from the United Nations Development Program, had collated the results of research by many scientists to produce A Guide to the Cultivation of Rattans. The Director-General of FRIM, Dr. Salleh Mohd. Nor, has kindly given permis- sion for Chapter 9 (Nursery) and Chapter 15 (Pests and Diseases of Rattans), along with relevant parts of the bibliography, to be reissued as an INBAR technical report. Minor changes have been made to the original text to reflect information provided by the Kerala Forest Research Institute, India and the Indian Council of Forest Research and Education. Their inputs ensure that the report will be more useful to the entire INBAR network. It should be noted that this report concentrates on propagation through seed, the normal mechanism for the major commercial species of rattans such as Calamus manan, C. -
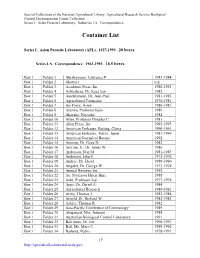
Container List
Special Collections of the National Agricultural Library: Agricultural Research Service Biological Control Documentation Center Collection Series I. Asian Parasite Laboratory. Subseries I.A. Correspondence. Container List Series I. Asian Parasite Laboratory (APL). 1927-1993. 20 boxes. Series I.A. Correspondence. 1963-1993. 16.5 boxes. Box 1 Folder 1 Abrahamson, Lawrence P. 1983-1984 Box 1 Folder 2 Abstract n.d. Box 1 Folder 3 Academic Press, Inc. 1986-1993 Box 1 Folder 4 Achterberg, Dr. Kees van 1982 Box 1 Folder 5 Aeschlimann, Dr. Jean-Paul 1981-1985 Box 1 Folder 6 Agricultural Counselor 1976-1981 Box 1 Folder 7 Air Force, Army 1980-1981 Box 1 Folder 8 Aizawa, Professor Keio 1986 Box 1 Folder 9 Akasaka, Naoyuki 1982 Box 1 Folder 10 Allen, Professor Douglas C. 1981 Box 1 Folder 11 Allen Press, Inc. 1992-1993 Box 1 Folder 12 American Embassy, Beijing, China 1990-1991 Box 1 Folder 13 American Embassy, Tokyo, Japan 1981-1990 Box 1 Folder 14 American Journal of Botany 1992 Box 1 Folder 15 Amman, Dr. Gene D. 1982 Box 1 Folder 16 Amrine, Jr., Dr. James W. 1986 Box 1 Folder 17 Anderson, Don M. 1981-1983 Box 1 Folder 18 Anderson, John F. 1975-1976 Box 1 Folder 19 Andres, Dr. Lloyd 1989-1990 Box 1 Folder 20 Angalet, Dr. George W. 1973-1978 Box 1 Folder 21 Annual Reviews Inc. 1992 Box 1 Folder 22 Ao, Professor Hsien-Bine 1988 Box 1 Folder 23 Aoki, Professor Joji 1977-1978 Box 1 Folder 24 Apps, Dr. Darrel A. 1984 Box 1 Folder 25 Agricultural Research 1980-1981 Box 1 Folder 26 Army, Thomas J. -

Chec List Distribution and Composition of Butterfly Species Along The
Check List 8(6): 1196–1215, 2012 © 2012 Check List and Authors Chec List ISSN 1809-127X (available at www.checklist.org.br) Journal of species lists and distribution PECIES S OF Distribution and composition of butterfly species along ISTS L the latitudinal and habitat gradients of the Western Ghats 1 * 2 of India 3 Anand Padhye , Sheetal Shelke and Neelesh Dahanukar 1 Abasaheb Garware College, Department of Zoology. Karve Road, Pune 411004, India. 2 Abasaheb Garware College, [email protected] of Biodiversity. Karve Road, Pune 411004, India. 3 Indian Institute of Science Education and Research, Sai Trinity Building, Sus Road, Pashan, Pune 411021, India. * Corresponding author. Email: Abstract: Distribution of butterfly species along the latitudinal and habitat gradients of the Western Ghats was studied. The Western Ghats was divided into 14 latitude zones and the species diversity in each latitude zone, along with habitats of their occurrence, were studied using the data from literature survey for the entire Western Ghats as well as data from personal observations in the areas between 14°N to 20°N latitudes. Out of 334 species recorded from the Western Ghats, 58 species were found in all latitudinal zones, while 5 species were reported in only one latitudinal zone. Further, southern Western Ghats consisted of more number of species and more number of genera as compared to northern Western Ghats. Latitudinal zones between 10°N to 12°N had most of the Western Ghats endemic species. Habitat wise distribution of species revealed three significant clusters grossly separated by the level of human disturbance. Evergreen forest habitats supported maximum number of species endemic to the Western Ghats. -

Butterfly Biodiversity in Singapore with Particular Reference to the Central
Proceedings of the Nature Reserves Survey Seminar. 70re 49(2) (1997) Gardens' Bulletin Singapore 49 (1997) 273-296. ~ laysia and Butterfly Biodiversity in Singapore with Particular :ingapore. Reference to the Central Catchment Nature Reserve discovery, 1 2 ~y Bulletin. S.K. KHEW AND STEVEN S.H. NE0 1103, Tai Keng Gardens, Singapore 535384 re. In: L.M. 2Blk 16, Simei Street 1, #05-13, Melville Park, Singapore 529942 )f Zoology, Abstract Chin, R.T. A total of 381 butterfly species have now been recorded in Singapore of which 18 are new City: Bukit records since 1990. Of this total, 236 species (62%) were recorded during the present JOre. Suppl. survey. A U except 8 (3%) of these occur within the Nature Reserves and 148 (63%) were recorded only within the Nature Reserves. A total of 74 species (31%) within the Reserves were considered very rare. e Nee Soon ion: Marine Introduction l impact of The study of butterflies by amateurs is not new, and indeed, it is through onservation. the observations of these dedicated individuals that much important data have been accumulated over the years. The information on butterfly biodiversity in Singapore is, at most, sketchy. Most of the documentation ater prawn, of the species occurred done during the post-war years until the late 1960s. nidae) from From our literature research, two references stand out: W.A. Fleming's )gy. 43: 299- Butterflies of West Malaysia and Singapore (1991) and Steven Corbet and Maurice Pendlebury's Butterfli es of the Malay Peninsula (1992). Although the latest editions of the two reference books were published in the early ~amalph eops 1990s, most of the updates referred only to the Peninsular Malaysia. -

Out of the Orient: Post-Tethyan Transoceanic and Trans-Arabian Routes
Systematic Entomology Page 2 of 55 1 1 Out of the Orient: Post-Tethyan transoceanic and trans-Arabian routes 2 fostered the spread of Baorini skippers in the Afrotropics 3 4 Running title: Historical biogeography of Baorini skippers 5 6 Authors: Emmanuel F.A. Toussaint1,2*, Roger Vila3, Masaya Yago4, Hideyuki Chiba5, Andrew 7 D. Warren2, Kwaku Aduse-Poku6,7, Caroline Storer2, Kelly M. Dexter2, Kiyoshi Maruyama8, 8 David J. Lohman6,9,10, Akito Y. Kawahara2 9 10 Affiliations: 11 1 Natural History Museum of Geneva, CP 6434, CH 1211 Geneva 6, Switzerland 12 2 Florida Museum of Natural History, University of Florida, Gainesville, Florida, 32611, U.S.A. 13 3 Institut de Biologia Evolutiva (CSIC-UPF), Passeig Marítim de la Barceloneta, 37, 08003 14 Barcelona, Spain 15 4 The University Museum, The University of Tokyo, Hongo, Bunkyo-ku, Tokyo 113-0033, Japan 16 5 B. P. Bishop Museum, 1525 Bernice Street, Honolulu, Hawaii, 96817-0916 U.S.A. 17 6 Biology Department, City College of New York, City University of New York, 160 Convent 18 Avenue, NY 10031, U.S.A. 19 7 Biology Department, University of Richmond, Richmond, Virginia, 23173, USA 20 8 9-7-106 Minami-Ôsawa 5 chome, Hachiôji-shi, Tokyo 192-0364, Japan 21 9 Ph.D. Program in Biology, Graduate Center, City University of New York, 365 Fifth Ave., New 22 York, NY 10016, U.S.A. 23 10 Entomology Section, National Museum of the Philippines, Manila 1000, Philippines 24 25 *To whom correspondence should be addressed: E-mail: [email protected] Page 3 of 55 Systematic Entomology 2 26 27 ABSTRACT 28 The origin of taxa presenting a disjunct distribution between Africa and Asia has puzzled 29 biogeographers for centuries. -

Dragon's Blood
Available online at www.sciencedirect.com Journal of Ethnopharmacology 115 (2008) 361–380 Review Dragon’s blood: Botany, chemistry and therapeutic uses Deepika Gupta a, Bruce Bleakley b, Rajinder K. Gupta a,∗ a University School of Biotechnology, GGS Indraprastha University, K. Gate, Delhi 110006, India b Department of Biology & Microbiology, South Dakota State University, Brookings, South Dakota 57007, USA Received 25 May 2007; received in revised form 10 October 2007; accepted 11 October 2007 Available online 22 October 2007 Abstract Dragon’s blood is one of the renowned traditional medicines used in different cultures of world. It has got several therapeutic uses: haemostatic, antidiarrhetic, antiulcer, antimicrobial, antiviral, wound healing, antitumor, anti-inflammatory, antioxidant, etc. Besides these medicinal applica- tions, it is used as a coloring material, varnish and also has got applications in folk magic. These red saps and resins are derived from a number of disparate taxa. Despite its wide uses, little research has been done to know about its true source, quality control and clinical applications. In this review, we have tried to overview different sources of Dragon’s blood, its source wise chemical constituents and therapeutic uses. As well as, a little attempt has been done to review the techniques used for its quality control and safety. © 2007 Elsevier Ireland Ltd. All rights reserved. Keywords: Dragon’s blood; Croton; Dracaena; Daemonorops; Pterocarpus; Therapeutic uses Contents 1. Introduction ........................................................................................................... -

Butterfly Extirpations
RAFFLES BULLETIN OF ZOOLOGY 2018 Conservation & Ecology RAFFLES BULLETIN OF ZOOLOGY 66: 217–257 Date of publication: 19 April 2018 http://zoobank.org/urn:lsid:zoobank.org:pub:CFF83D96-5239-4C56-B7CE-8CA1E086EBFD Butterfy extirpations, discoveries and rediscoveries in Singapore over 28 years Anuj Jain1,2*#, Khew Sin Khoon3, Cheong Weei Gan2, and Edward L. Webb1* Abstract. Habitat loss and urbanisation in the tropics have been recognised as major drivers of species extinctions. Concurrently, novel habitats such as urban parks have been shown to be important as habitats and stepping stones in urban ecosystems around the world. However, few studies have assessed long-term patterns of species extinctions and discoveries in response to these drivers in the tropics. We know little about long-term persistence and utility of novel habitats in tropical urban ecosystems. In this study, we produced an updated and exhaustive butterfy checklist of species recorded from Singapore till December 2017 to investigate trends in butterfy extirpations (local extinctions), discoveries (new country records) and rediscoveries and how these relate to land use change in 28 years (1990–2017) in Singapore. Up to 144 butterfy species were identifed to be extirpated in Singapore by 1990. From 1990–2017, an additional nine butterfy extirpations have potentially occurred, which suggests a maximum of 153 butterfy extirpations to date. The rate of extirpations between 1990 to 2017 (< 0.33 extirpations per year) was much lower than the rate of extirpations between 1926 to 1989 (> 1.52 extirpations per year). The majority of potentially extirpated butterfies between 1990 to 2017 were species restricted to mature forests. -

Specimen Records for North American Lepidoptera (Insecta) in the Oregon State Arthropod Collection. Lycaenidae Leach, 1815 and Riodinidae Grote, 1895
Catalog: Oregon State Arthropod Collection 2019 Vol 3(2) Specimen records for North American Lepidoptera (Insecta) in the Oregon State Arthropod Collection. Lycaenidae Leach, 1815 and Riodinidae Grote, 1895 Jon H. Shepard Paul C. Hammond Christopher J. Marshall Oregon State Arthropod Collection, Department of Integrative Biology, Oregon State University, Corvallis OR 97331 Cite this work, including the attached dataset, as: Shepard, J. S, P. C. Hammond, C. J. Marshall. 2019. Specimen records for North American Lepidoptera (Insecta) in the Oregon State Arthropod Collection. Lycaenidae Leach, 1815 and Riodinidae Grote, 1895. Catalog: Oregon State Arthropod Collection 3(2). (beta version). http://dx.doi.org/10.5399/osu/cat_osac.3.2.4594 Introduction These records were generated using funds from the LepNet project (Seltmann) - a national effort to create digital records for North American Lepidoptera. The dataset published herein contains the label data for all North American specimens of Lycaenidae and Riodinidae residing at the Oregon State Arthropod Collection as of March 2019. A beta version of these data records will be made available on the OSAC server (http://osac.oregonstate.edu/IPT) at the time of this publication. The beta version will be replaced in the near future with an official release (version 1.0), which will be archived as a supplemental file to this paper. Methods Basic digitization protocols and metadata standards can be found in (Shepard et al. 2018). Identifications were confirmed by Jon Shepard and Paul Hammond prior to digitization. Nomenclature follows that of (Pelham 2008). Results The holdings in these two families are extensive. Combined, they make up 25,743 specimens (24,598 Lycanidae and 1145 Riodinidae).