Diversidad De Aves Del Perú Pág
Total Page:16
File Type:pdf, Size:1020Kb

Load more
Recommended publications
-

TAG Operational Structure
PARROT TAXON ADVISORY GROUP (TAG) Regional Collection Plan 5th Edition 2020-2025 Sustainability of Parrot Populations in AZA Facilities ...................................................................... 1 Mission/Objectives/Strategies......................................................................................................... 2 TAG Operational Structure .............................................................................................................. 3 Steering Committee .................................................................................................................... 3 TAG Advisors ............................................................................................................................... 4 SSP Coordinators ......................................................................................................................... 5 Hot Topics: TAG Recommendations ................................................................................................ 8 Parrots as Ambassador Animals .................................................................................................. 9 Interactive Aviaries Housing Psittaciformes .............................................................................. 10 Private Aviculture ...................................................................................................................... 13 Communication ........................................................................................................................ -

Wild Patagonia & Central Chile
WILD PATAGONIA & CENTRAL CHILE: PUMAS, PENGUINS, CONDORS & MORE! NOVEMBER 1–18, 2019 Pumas simply rock! This year we enjoyed 9 different cats! Observing the antics of lovely Amber here and her impressive family of four cubs was certainly the highlight in Torres del Paine National Park — Photo: Andrew Whittaker LEADERS: ANDREW WHITTAKER & FERNANDO DIAZ LIST COMPILED BY: ANDREW WHITTAKER VICTOR EMANUEL NATURE TOURS, INC. 2525 WALLINGWOOD DRIVE, SUITE 1003 AUSTIN, TEXAS 78746 WWW.VENTBIRD.COM Sensational, phenomenal, outstanding Chile—no superlatives can ever adequately describe the amazing wildlife spectacles we enjoyed on this year’s tour to this breathtaking and friendly country! Stupendous world-class scenery abounded with a non-stop array of exciting and easy birding, fantastic endemics, and super mega Patagonian specialties. Also, as I promised from day one, everyone fell in love with Chile’s incredible array of large and colorful tapaculos; we enjoyed stellar views of all of the country’s 8 known species. Always enigmatic and confiding, the cute Chucao Tapaculo is in the Top 5 — Photo: Andrew Whittaker However, the icing on the cake of our tour was not birds but our simply amazing Puma encounters. Yet again we had another series of truly fabulous moments, even beating our previous record of 8 Pumas on the last day when I encountered a further 2 young Pumas on our way out of the park, making it an incredible 9 different Pumas! Our Puma sightings take some beating, as they have stood for the last three years at 6, 7, and 8. For sure none of us will ever forget the magical 45 minutes spent observing Amber meeting up with her four 1- year-old cubs as they joyfully greeted her return. -
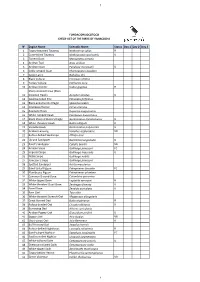
N° English Name Scientific Name Status Day 1
1 FUNDACIÓN JOCOTOCO CHECK-LIST OF THE BIRDS OF YANACOCHA N° English Name Scientific Name Status Day 1 Day 2 Day 3 1 Tawny-breasted Tinamou Nothocercus julius R 2 Curve-billed Tinamou Nothoprocta curvirostris U 3 Torrent Duck Merganetta armata 4 Andean Teal Anas andium 5 Andean Guan Penelope montagnii U 6 Sickle-winged Guan Chamaepetes goudotii 7 Cattle Egret Bubulcus ibis 8 Black Vulture Coragyps atratus 9 Turkey Vulture Cathartes aura 10 Andean Condor Vultur gryphus R Sharp-shinned Hawk (Plain- 11 breasted Hawk) Accipiter striatus U 12 Swallow-tailed Kite Elanoides forficatus 13 Black-and-chestnut Eagle Spizaetus isidori 14 Cinereous Harrier Circus cinereus 15 Roadside Hawk Rupornis magnirostris 16 White-rumped Hawk Parabuteo leucorrhous 17 Black-chested Buzzard-Eagle Geranoaetus melanoleucus U 18 White-throated Hawk Buteo albigula R 19 Variable Hawk Geranoaetus polyosoma U 20 Andean Lapwing Vanellus resplendens VR 21 Rufous-bellied Seedsnipe Attagis gayi 22 Upland Sandpiper Bartramia longicauda R 23 Baird's Sandpiper Calidris bairdii VR 24 Andean Snipe Gallinago jamesoni FC 25 Imperial Snipe Gallinago imperialis U 26 Noble Snipe Gallinago nobilis 27 Jameson's Snipe Gallinago jamesoni 28 Spotted Sandpiper Actitis macularius 29 Band-tailed Pigeon Patagoienas fasciata FC 30 Plumbeous Pigeon Patagioenas plumbea 31 Common Ground-Dove Columbina passerina 32 White-tipped Dove Leptotila verreauxi R 33 White-throated Quail-Dove Zentrygon frenata U 34 Eared Dove Zenaida auriculata U 35 Barn Owl Tyto alba 36 White-throated Screech-Owl Megascops -

Diversity and Natural History of Birds in Green Urban Areas of the City of Quito, Ecuador (America)
Diversity and natural history of birds in green urban areas of the city of Quito, Ecuador (America) Diego F. Cisneros-Heredia1,2,3* & Eliana Montenegro1 1 Universidad San Francisco de Quito, Colegio de Ciencias Biológicas y Ambientales, Laboratorio de Zoología Terrestre. Casilla Postal 17-1200-841, Quito, Ecuador 2 King’s College London, Department of Geography, Strand, London WC2R 2LS, UK 3 Aves&Conservación / BirdLife Ecuador, Quito, Ecuador * E-mail: [email protected] Abstract The diversity and ecology of urban bird communities have been extensively studied in Neartic and Paleartic areas, however, little is known about urban Neotropical areas. Quito, capital city of Ecuador, is located on a highland valley in the megadiverse tropical Andes. Founded in 1534, Quito did not increase significantly its urban area until the late 19th century, growing at an accelerated and unplanned rate during the 20th century. More than 100 species were known to inhabit in Quito at the end of the 19th century. Currently, most authors estimated that no more than 40 species occur in Quito, although no systematic bird studies have been conducted. Our research is a first approach to the avifauna of Quito, surveying the diversity living in green urban areas within the city borders. We used two field methodologies, i.e. line transects and point counts, to survey 16 green urban areas over 12 months. We recorded 65 species of birds, belonging to 20 families and 9 orders. Three species were the most common and frequent: Eared Dove Zenaida auriculata, Rufous-collared Sparrow Zonotrichia capensis, and Great Thrush Turdus fuscater, being omnivores and granivores adapted to anthropic habitats with low ecological complexity. -

The Natural Choice for Wildlife Holidays Welcome
HOLIDAYS WITH 100% FINANCIAL PROTECTION The natural choice for wildlife holidays Welcome After spending considerable time and effort reflecting, questioning what we do and how we do it, and scrutinising the processes within our office and the systems we use for support, I am delighted to say that we are imbued with a new vigour, undiminished enthusiasm, and greater optimism than ever. My own determination to continue building on the solid foundation of twenty years of experience in wildlife tourism, since we started from very humble beginnings – to offer what is simply the finest selection of high quality, good value, tailor-made wildlife holidays – remains undaunted, and is very much at the core of all we do. A physical move to high-tech office premises in the attractive city of Winchester leaves us much better connected to, and more closely integrated with, the outside world, and thus better able to receive visitors. Our team is leaner, tighter, more widely travelled and more knowledgeable than ever before, allowing us to focus on terrestrial, marine and – along with Dive Worldwide – submarine life without distraction. In planning this brochure we deliberately set out to whet the appetite, and make no mention of either dates or prices. As the vast majority of trips are tailored to our clients’ exact requirements – whether in terms of itinerary, duration, standard of accommodation or price – the itineraries herein serve merely as indications of what is possible. Thereafter, you can refine these suggestions in discussion with one of our experienced consultants to pin down your precise needs and wants, so we can together create the wildlife holiday of your dreams. -

Peru: from the Cusco Andes to the Manu
The critically endangered Royal Cinclodes - our bird-of-the-trip (all photos taken on this tour by Pete Morris) PERU: FROM THE CUSCO ANDES TO THE MANU 26 JULY – 12 AUGUST 2017 LEADERS: PETE MORRIS and GUNNAR ENGBLOM This brand new itinerary really was a tour of two halves! For the frst half of the tour we really were up on the roof of the world, exploring the Andes that surround Cusco up to altitudes in excess of 4000m. Cold clear air and fantastic snow-clad peaks were the order of the day here as we went about our task of seeking out a number of scarce, localized and seldom-seen endemics. For the second half of the tour we plunged down off of the mountains and took the long snaking Manu Road, right down to the Amazon basin. Here we traded the mountainous peaks for vistas of forest that stretched as far as the eye could see in one of the planet’s most diverse regions. Here, the temperatures rose in line with our ever growing list of sightings! In all, we amassed a grand total of 537 species of birds, including 36 which provided audio encounters only! As we all know though, it’s not necessarily the shear number of species that counts, but more the quality, and we found many high quality species. New species for the Birdquest life list included Apurimac Spinetail, Vilcabamba Thistletail, Am- pay (still to be described) and Vilcabamba Tapaculos and Apurimac Brushfnch, whilst other montane goodies included the stunning Bearded Mountaineer, White-tufted Sunbeam the critically endangered Royal Cinclodes, 1 BirdQuest Tour Report: Peru: From the Cusco Andes to The Manu 2017 www.birdquest-tours.com These wonderful Blue-headed Macaws were a brilliant highlight near to Atalaya. -

Bolborhynchus Orbygnesius in Argentina, Roosting Communally in a Stick Nest Krabbe, N.; Sureda, A
First documented record of Andean Parakeet Bolborhynchus orbygnesius in Argentina, roosting communally in a stick nest Krabbe, N.; Sureda, A. L.; Canelo, R. 2009 Cita: Krabbe, N.; Sureda, A. L.; Canelo, R. (2009) First documented record of Andean Parakeet Bolborhynchus orbygnesius in Argentina, roosting communally in a stick nest. Hornero 024 (02) : 095-098 www.digital.bl.fcen.uba.ar Puesto en linea por la Biblioteca Digital de la Facultad de Ciencias Exactas y Naturales Universidad de Buenos Aires 2009Hornero 24(2):95–98, 2009FIRST RECORD OF BOLBORHYNCHUS ORBYGNESIUS IN ARGENTINA 95 FIRST DOCUMENTED RECORD OF ANDEAN PARAKEET BOLBORHYNCHUS ORBYGNESIUS IN ARGENTINA, ROOSTING COMMUNALLY IN A STICK NEST NIELS KRABBE 1, ANA LAURA SUREDA 2 AND ROBERTO CANELO 3 1 Zoological Museum, University of Copenhagen. Copenhagen, Denmark. [email protected] 2 Delegación Regional Noroeste, Administración de Parques Nacionales. Santa Fe 23, 4400 Salta, Argentina. 3 Parque Nacional Los Cardones, Administración de Parques Nacionales. Av. San Martín s/n, 4415 Payogasta, Salta, Argentina. ABSTRACT.— A group of several Andean Parakeet (Bolborhynchus orbygnesius) individuals was observed, photographed and tape-recorded at Finca El Candado, near Los Cardones National Park, Salta Province, northwestern Argentina. There is no previously published record of Andean Parakeet from south of Cochabamba, Bolivia, although there is a tape-recording from Tarija, Bo- livia, which is about 350 km north-northwest of Finca El Candado. Additionally, there is an un- documented record of a group of birds 218 km north-northwest of Finca El Candado, between Valle Colorado and Santa Ana, in Jujuy Province, Argentina. Birds were coming to roost in a large stick nest that did not look like any described nest. -

La Brea and Beyond: the Paleontology of Asphalt-Preserved Biotas
La Brea and Beyond: The Paleontology of Asphalt-Preserved Biotas Edited by John M. Harris Natural History Museum of Los Angeles County Science Series 42 September 15, 2015 Cover Illustration: Pit 91 in 1915 An asphaltic bone mass in Pit 91 was discovered and exposed by the Los Angeles County Museum of History, Science and Art in the summer of 1915. The Los Angeles County Museum of Natural History resumed excavation at this site in 1969. Retrieval of the “microfossils” from the asphaltic matrix has yielded a wealth of insect, mollusk, and plant remains, more than doubling the number of species recovered by earlier excavations. Today, the current excavation site is 900 square feet in extent, yielding fossils that range in age from about 15,000 to about 42,000 radiocarbon years. Natural History Museum of Los Angeles County Archives, RLB 347. LA BREA AND BEYOND: THE PALEONTOLOGY OF ASPHALT-PRESERVED BIOTAS Edited By John M. Harris NO. 42 SCIENCE SERIES NATURAL HISTORY MUSEUM OF LOS ANGELES COUNTY SCIENTIFIC PUBLICATIONS COMMITTEE Luis M. Chiappe, Vice President for Research and Collections John M. Harris, Committee Chairman Joel W. Martin Gregory Pauly Christine Thacker Xiaoming Wang K. Victoria Brown, Managing Editor Go Online to www.nhm.org/scholarlypublications for open access to volumes of Science Series and Contributions in Science. Natural History Museum of Los Angeles County Los Angeles, California 90007 ISSN 1-891276-27-1 Published on September 15, 2015 Printed at Allen Press, Inc., Lawrence, Kansas PREFACE Rancho La Brea was a Mexican land grant Basin during the Late Pleistocene—sagebrush located to the west of El Pueblo de Nuestra scrub dotted with groves of oak and juniper with Sen˜ora la Reina de los A´ ngeles del Rı´ode riparian woodland along the major stream courses Porciu´ncula, now better known as downtown and with chaparral vegetation on the surrounding Los Angeles. -

Vigilancia Dirigida De Influenza Aviar En Aves Silvestres De Los Humedales De Puerto Viejo Usando Patos Domésticos (Cairina Moschata) Como Centinelas
UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS FACULTAD DE MEDICINA VETERINARIA UNIDAD DE POST GRADO Vigilancia dirigida de influenza aviar en aves silvestres de los humedales de Puerto Viejo usando patos domésticos (Cairina moschata) como centinelas TESIS para optar el grado de magíster en Salud Animal AUTOR Juan Alexander Rondón Espinoza Lima-Perú 2011 Dedicado a: Mis padres Tula y Manuel, viejitos desde aquí les mando esta dedicatoria con todo mi amor para ustedes que están en el cielo. Mis hermanos Manuel y Alfredo, les agradezco por haber compartido el tiempo de mi niñez con ustedes, un abrazo imaginario para los dos. Mis hermanos Erwin, Tula, Ricardo e Ysabel, a ustedes que comparten conmigo su cariño, sus alegrías y tristezas…, los quiero mucho. Mis sobrinos Miguelito, Yair y Franco, a ustedes que con sus travesuras me hicieron volver a mi niñez, haciéndome reír. ¡Gracias a ustedes por ser mi familia! Este trabajo también está dedicado a ti joven estudiante; - Que, desde muy niño tuviste muchos obstáculos y problemas por muchos motivos y, cuando creciste tuviste carencias de comodidades, pero a la vez fuiste consciente de eso y supiste afrontarlo de alguna manera, no dejando de luchar por alcanzar tus metas. - Que, supiste encontrar solo tu camino con ayuda de tus seres queridos, y que a pesar de quererlos mucho, no fuiste un hijito de papá, ni de mamá. - Que, para avanzar supiste agradecer y retribuir todo lo que te dieron alguna vez las personas cercanas (familia, amigos, conocidos, etc.). - Que, para trabajar en grupo, siempre ofreciste y ofreces buena voluntad, dedicación, y sobretodo cumpliste con la ley del amor impersonal, dando lo mejor de ti en todo lo que haces. -

Dated Phylogenetic and Biogeographic Inference of Migratory Behavior in Bee Hummingbirds Yuyini Licona-Vera and Juan Francisco Ornelas*
Licona-Vera and Ornelas BMC Evolutionary Biology (2017) 17:126 DOI 10.1186/s12862-017-0980-5 RESEARCH ARTICLE Open Access The conquering of North America: dated phylogenetic and biogeographic inference of migratory behavior in bee hummingbirds Yuyini Licona-Vera and Juan Francisco Ornelas* Abstract Background: Geographical and temporal patterns of diversification in bee hummingbirds (Mellisugini) were assessed with respect to the evolution of migration, critical for colonization of North America. We generated a dated multilocus phylogeny of the Mellisugini based on a dense sampling using Bayesian inference, maximum- likelihood and maximum parsimony methods, and reconstructed the ancestral states of distributional areas in a Bayesian framework and migratory behavior using maximum parsimony, maximum-likelihood and re-rooting methods. Results: All phylogenetic analyses confirmed monophyly of the Mellisugini and the inclusion of Atthis, Calothorax, Doricha, Eulidia, Mellisuga, Microstilbon, Myrmia, Tilmatura,andThaumastura. Mellisugini consists of two clades: (1) South American species (including Tilmatura dupontii), and (2) species distributed in North and Central America and the Caribbean islands. The second clade consists of four subclades: Mexican (Calothorax, Doricha)and Caribbean (Archilochus, Calliphlox, Mellisuga)sheartails,Calypte,andSelasphorus (incl. Atthis). Coalescent-based dating places the origin of the Mellisugini in the mid-to-late Miocene, with crown ages of most subclades in the early Pliocene, and subsequent species splits in the Pleistocene. Bee hummingbirds reached western North America by the end of the Miocene and the ancestral mellisuginid (bee hummingbirds) was reconstructed as sedentary, with four independent gains of migratory behavior during the evolution of the Mellisugini. Conclusions: Early colonization of North America and subsequent evolution of migration best explained biogeographic and diversification patterns within the Mellisugini. -

Patagonia Wildlife Safari Paul Prior BIRD SPECIES - Total 177 Seen/ No
BIRD CHECKLIST Leaders: Steve Ogle Eagle-Eye Tours 2018 Patagonia Wildlife Safari Paul Prior BIRD SPECIES - Total 177 Seen/ No. Common Name Latin Name Heard RHEIFORMES: Rheidae 1 Lesser Rhea Rhea pennata s TINAMIFORMES: Tinamidae 2 Elegant Crested-Tinamou Eudromia elegans s ANSERIFORMES: Anhimidae 3 Southern Screamer Chauna torquata s ANSERIFORMES: Anatidae 4 White-faced Whistling-Duck Dendrocygna viduata s 5 Fulvous Whistling-Duck Dendrocygna bicolor s 6 Black-necked Swan Cygnus melancoryphus s 7 Coscoroba Swan Coscoroba coscoroba s 8 Upland Goose Chloephaga picta s 9 Kelp Goose Chloephaga hybrida s 10 Flying Steamer-Duck Tachyeres patachonicus s 11 Flightless Steamer-Duck Tachyeres pteneres s 12 White-headed Steamer-Duck Tachyeres leucocephalus s 13 Crested Duck Lophonetta specularioides s 14 Spectacled Duck Speculanas specularis s 15 Brazilian Teal Amazonetta brasiliensis s 16 Torrent Duck Merganetta armata s 17 Chiloe Wigeon Anas sibilatrix s 18 Cinnamon Teal Anas cyanoptera s 19 Red Shoveler Anas platalea s 20 Yellow-billed Pintail Anas georgica s 21 Silver Teal Anas versicolor s 22 Yellow-billed Teal Anas flavirostris s 23 Rosy-billed Pochard Netta peposaca s 24 Black-headed Duck Heteronetta atricapilla s 25 Lake Duck Oxyura vittata s PODICIPEDIFORMES: Podicipedidae 26 White-tufted Grebe Rollandia rolland s 27 Great Grebe Podiceps major s 28 Silvery Grebe Podiceps occipitalis s PHOENICOPTERIFORMES: Phoenicopteridae 29 Chilean Flamingo Phoenicopterus chilensis s SPHENISCIFORMES: Spheniscidae 30 King Penguin Aptenodytes patagonicus s 31 Gentoo Penguin Pygoscelis papua s 32 Magellanic Penguin Spheniscus magellanicus s PROCELLARIIFORMES: Diomedeidae 33 Black-browed Albatross Thalassarche melanophris s Page 1 of 6 BIRD CHECKLIST Leaders: Steve Ogle Eagle-Eye Tours 2018 Patagonia Wildlife Safari Paul Prior BIRD SPECIES - Total 177 Seen/ No. -

IGUAZU FALLS Extension 1-15 December 2016
Tropical Birding Trip Report NW Argentina & Iguazu Falls: December 2016 A Tropical Birding SET DEPARTURE tour NW ARGENTINA: High Andes, Yungas and Monte Desert and IGUAZU FALLS Extension 1-15 December 2016 TOUR LEADER: ANDRES VASQUEZ (All Photos by Andres Vasquez) A combination of breathtaking landscapes and stunning birds are what define this tour. Clockwise from bottom left: Cerro de los 7 Colores in the Humahuaca Valley, a World Heritage Site; Wedge-tailed Hillstar at Yavi; Ochre-collared Piculet on the Iguazu Falls Extension; and one of the innumerable angles of one of the World’s-must-visit destinations, Iguazu Falls. www.tropicalbirding.com +1-409-515-9110 [email protected] p.1 Tropical Birding Trip Report NW Argentina & Iguazu Falls: December 2016 Introduction: This is the only tour that I guide where I feel that the scenery is as impressive (or even surpasses) the birds themselves. This is not to say that the birds are dull on this tour, far from it. Some of the avian highlights included wonderfully jeweled hummingbirds like Wedge-tailed Hillstar and Red-tailed Comet; getting EXCELLENT views of 4 Tinamou species of, (a rare thing on all South American tours except this one); nearly 20 species of ducks, geese and swans, with highlights being repeated views of Torrent Ducks, the rare and oddly, parasitic Black-headed Duck, the beautiful Rosy-billed Pochard, and the mountain-dwelling Andean Goose. And we should not forget other popular bird features like 3 species of Flamingos on one lake, 11 species of Woodpeckers, including the hulking Cream-backed, colorful Yellow-fronted and minuscule Ochre-collared Piculet on the extension to Iguazu Falls.