Universidade Federal Do Rio Grande
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Uso De Polissacarídeos Não-Amiláceos Pela Tainha
1 UNIVERSIDADE FEDERAL DO RIO GRANDE 2 INTITUTO DE OCEANOGRAFIA 3 PROGRAMA DE PÓS-GRADUAÇÃO EM AQUICULTURA 4 5 6 7 8 9 10 11 12 USO DE POLISSACARÍDEOS NÃO-AMILÁCEOS POR JUVENIS DE TAINHA 13 MUGIL LIZA (VALENCIENNES, 1836) 14 15 16 17 18 19 20 21 22 LEONARDO ROCHA VIDAL RAMOS 23 24 25 26 27 28 29 30 31 32 33 RIO GRANDE 34 ABRIL 2015 1 1 UNIVERSIDADE FEDERAL DO RIO GRANDE 2 INTITUTO DE OCEANOGRAFIA 3 PROGRAMA DE PÓS-GRADUAÇÃO EM AQUICULTURA 4 5 6 7 8 USO DE POLISSACARÍDEOS NÃO-AMILÁCEOS POR JUVENIS DE TAINHA 9 MUGIL LIZA (VALENCIENNES, 1836). 10 11 Leonardo Rocha Vidal Ramos 12 13 Tese apresentada como parte dos requisitos para 14 a obtenção do grau de doutor em Aquicultura no 15 Programa de Pós-Graduação em Aquicultura da 16 Universidade Federal do Rio Grande 17 Orientador: Dr. Marcelo Borges Tesser 18 Co-orientador: Dr. Paulo Cesar Abreu 19 20 21 22 23 24 25 26 Rio Grande – RS – Brasil 27 Abril 2015 28 2 1 ÍNDICE 2 DEDICATÓRIA --------------------------------------------------------------------------------- 4 3 AGRADECIMENTOS ------------------------------------------------------------------------- 5 4 RESUMO GERAL------------------------------------------------------------------------------- 6 5 GENERAL ABSTRACT ----------------------------------------------------------------------- 7 6 INTRODUÇÃO GERAL --------------------------------------------------------------------- 10 7 REFERÊNCIAS BIBLIOGRÁFICAS------------------------------------------------------ 22 8 OBJETIVOS ------------------------------------------------------------------------------------ -

Short-Term Storage of Lebranche Mullet Mugil Liza (Valenciennes, 1836) Semen in Natura and Diluted with CF-HBSS
Acta Scientiarum http://periodicos.uem.br/ojs/acta ISSN on-line: 1807-8672 Doi: 10.4025/actascianimsci.v40i1.39563 AQUICULTURE Short-term storage of lebranche mullet Mugil liza (Valenciennes, 1836) semen in natura and diluted with CF-HBSS Caio Cesar França Magnotti1*, Jorgélia de Jesus Pinto Castro1, Fabiola Santiago Pedrotti1, Fábio Carneiro Sterzelecki1, Eduardo Gomes Sanches2 and Vinicius Ronzani Cerqueira1 1Laboratório de Piscicultura Marinha, Departamento de Aquicultura, Universidade de Santa Catarina, Rua dos Coroas, 503, 88061-600, Florianópolis, Santa Caratina, Brazil. 2Instituto de Pesca, Centro Avançado de Pesquisa Tecnológica do Pescado Marinho, Núcleo de Pesquisa do Litoral Norte, Ubatuba, São Paulo, Brazil. *Author for correspondence. E-mail: [email protected] ABSTRACT. The present study aimed to evaluate the activation characteristics of the lebranche mullet spermatozoa in natura and diluted with CF-HBSS for 96h at 4±2°C. The semen was collected from eight wild fish in Florianópolis – SC (Brazil) (27°S) in May, during reproductive migration. Three pools of semen were divided into two treatments: in natura and diluted with CF-HBSS 1:3. The semen was activated with seawater (salinity of 34, pH 8.7 and 4±2°C) to determine: motility time, motility rate and sperm cell membrane integrity. Dilution with CF-HBSS 1:3 increased motility time of diluted semen (15- 20% for 6, 12 and 18h). Motility rate was equal to fresh semen for up to 24h of refrigeration and it was 30% higher than in natura semen at 12, 18 and 24h. Cell membrane integrity was maintained in fresh semen up to 6h, and it was 15-20% higher than in natura semen from 6 to 48h (p < 0.05). -

Dissertação Ana Medeiros (N.4120485).Pdf
INSTITUTO POLITÉCNICO DE LEIRIA ESCOLA SUPERIOR DE TURISMO E TECNOLOGIA DO MAR Identificação e caracterização do potencial reprodutivo da tainha Mugil cephalus Linnaeus, 1758 Ana Luísa Rente Medeiros 2014 INSTITUTO POLITÉCNICO DE LEIRIA ESCOLA SUPERIOR DE TURISMO E TECNOLOGIA DO MAR Identificação e caracterização do potencial reprodutivo da tainha Mugil cephalus (Linnaeus, 1758) Ana Luísa Rente Medeiros Dissertação para a obtenção do Grau de Mestre em Aquacultura Dissertação de Mestrado realizada sob a orientação de: Especialista Teresa Baptista Doutora Florbela Soares Doutora Maria Emília Cunha 2014 ii Identificação e caracterização do potencial reprodutivo da tainha Mugil cephalus (Linnaeus, 1758) © Copyright Ana Luísa Rente Medeiros Escola Superior de Turismo e Tecnologia do Mar – Peniche Instituto Politécnico de Leiria A Escola Superior de Turismo e Tecnologia do Mar e o Instituto Politécnico de Leiria têm o direito, perpétuo e sem limites geográficos, de arquivar e publicar este trabalho através de exemplares impressos reproduzidos em papel ou de forma digital, ou por qualquer outro meio conhecido ou que venha a ser inventado, e de o divulgar através de repositórios científicos e de admitir a sua cópia e distribuição com objetivos educacionais ou de investigação, não comerciais, desde que seja dado crédito ao autor e editor. 2014 iii iv “Foi o tempo que dedicaste à tua rosa que a fez tão importante” (Antoine de Saint-Exupéry) Dedico in memoriam esta dissertação aos meus Avós v vi Agradecimentos Ao Doutor Pedro Pousão-Ferreira, responsável da Estação Piloto de Piscicultura de Olhão (EPPO) por me ter permitido e proporcionado as condições necessárias para a elaboração da minha Tese. -

FCEN-UBA | Callicó Fortunato, Roberta Glenda. 2017 02 20
Tesis Doctoral Aplicación de los otolitos en el estudio de la interconectividad de stocks pesqueros de mugílidos de zonas costeras de la provincia de Buenos Aires, Argentina y de la costa valenciana, España Callicó Fortunato, Roberta Glenda 2017-02-20 Este documento forma parte de la colección de tesis doctorales y de maestría de la Biblioteca Central Dr. Luis Federico Leloir, disponible en digital.bl.fcen.uba.ar. Su utilización debe ser acompañada por la cita bibliográfica con reconocimiento de la fuente. This document is part of the doctoral theses collection of the Central Library Dr. Luis Federico Leloir, available in digital.bl.fcen.uba.ar. It should be used accompanied by the corresponding citation acknowledging the source. Cita tipo APA: Callicó Fortunato, Roberta Glenda. (2017-02-20). Aplicación de los otolitos en el estudio de la interconectividad de stocks pesqueros de mugílidos de zonas costeras de la provincia de Buenos Aires, Argentina y de la costa valenciana, España. Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. Cita tipo Chicago: Callicó Fortunato, Roberta Glenda. "Aplicación de los otolitos en el estudio de la interconectividad de stocks pesqueros de mugílidos de zonas costeras de la provincia de Buenos Aires, Argentina y de la costa valenciana, España". Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. 2017-02-20. Dirección: Biblioteca Central Dr. Luis F. Leloir, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. Contacto: [email protected] Intendente Güiraldes 2160 - C1428EGA - Tel. (++54 +11) 4789-9293 UNIVERSIDAD DE BUENOS AIRES Facultad de Ciencias Exactas y Naturales Departamento de Biodiversidad y Biolog´ıa Experimental Aplicaci´on de los otolitos en el estudio de la interconectividad de stocks pesqueros de mug´ılidos de zonas costeras de la provincia de Buenos Aires, Argentina y de la costa Valenciana, Espa˜na. -
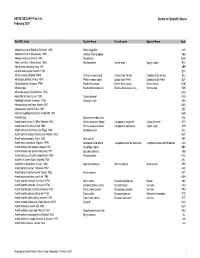
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste -

The Living Planet Index (Lpi) for Migratory Freshwater Fish Technical Report
THE LIVING PLANET INDEX (LPI) FOR MIGRATORY FRESHWATER FISH LIVING PLANET INDEX TECHNICAL1 REPORT LIVING PLANET INDEXTECHNICAL REPORT ACKNOWLEDGEMENTS We are very grateful to a number of individuals and organisations who have worked with the LPD and/or shared their data. A full list of all partners and collaborators can be found on the LPI website. 2 INDEX TABLE OF CONTENTS Stefanie Deinet1, Kate Scott-Gatty1, Hannah Rotton1, PREFERRED CITATION 2 1 1 Deinet, S., Scott-Gatty, K., Rotton, H., Twardek, W. M., William M. Twardek , Valentina Marconi , Louise McRae , 5 GLOSSARY Lee J. Baumgartner3, Kerry Brink4, Julie E. Claussen5, Marconi, V., McRae, L., Baumgartner, L. J., Brink, K., Steven J. Cooke2, William Darwall6, Britas Klemens Claussen, J. E., Cooke, S. J., Darwall, W., Eriksson, B. K., Garcia Eriksson7, Carlos Garcia de Leaniz8, Zeb Hogan9, Joshua de Leaniz, C., Hogan, Z., Royte, J., Silva, L. G. M., Thieme, 6 SUMMARY 10 11, 12 13 M. L., Tickner, D., Waldman, J., Wanningen, H., Weyl, O. L. Royte , Luiz G. M. Silva , Michele L. Thieme , David Tickner14, John Waldman15, 16, Herman Wanningen4, Olaf F., Berkhuysen, A. (2020) The Living Planet Index (LPI) for 8 INTRODUCTION L. F. Weyl17, 18 , and Arjan Berkhuysen4 migratory freshwater fish - Technical Report. World Fish Migration Foundation, The Netherlands. 1 Indicators & Assessments Unit, Institute of Zoology, Zoological Society 11 RESULTS AND DISCUSSION of London, United Kingdom Edited by Mark van Heukelum 11 Data set 2 Fish Ecology and Conservation Physiology Laboratory, Department of Design Shapeshifter.nl Biology and Institute of Environmental Science, Carleton University, Drawings Jeroen Helmer 12 Global trend Ottawa, ON, Canada 15 Tropical and temperate zones 3 Institute for Land, Water and Society, Charles Sturt University, Albury, Photography We gratefully acknowledge all of the 17 Regions New South Wales, Australia photographers who gave us permission 20 Migration categories 4 World Fish Migration Foundation, The Netherlands to use their photographic material. -

Diplostomatosis in Cultured Venezuelan Grey Mullets
Bull. Eur. Ass. FishPathol. J (l), 14, 1985 DIPLOSTOMATOSISIN CULTURED VENEZUELAN GREY MULLETS By G. CoNnoy, D.A. CoNRoY, J.A. SaNr,q'cANAAND F' PEnoouo The Venezuelan authorities have 4009) was obtained from one of the assigned a top priority rating to the ponds. It was noted that I of the culture of an edible native characin lebranche mullets had a single metacer- known as "cachama" (Colossoma cariae in each eye. In addition, this silver mqcrompomrz.iCuv., l8l8), lebranche mullet had bilateral cataract. No mullet (Mugil liza Yal., 1836) and silver metacercariaewere detected in a random mullet (M. curema Val., 1836) respec- sample of 7 "cachamas" taken from the tively. In 1982a private concern initiated samepond. the mixed culture of these 3 speciesat One of the affected silver mullet eyes Boca de Aroa, Falcon State, in an earth was fixed in 1090 buffered formol saline pond complexwith a total surfacearea of for histological studies, . and living 22.5 Ha situated approximately l0 km metacercariae were removed from the from the coast. Small juvenile mullets other eye and fixed in cold acetic acid- were captured during February 1983 in formalin prior to staining in Delafield's watersof varying saiinity at the mouth of haematoxylin. On a basis of its the River Aroa, and were held for 7 days morphological characteristics and in a 1 : I mixture of fresh water and sea measurements,the parasite was identified water before being introduced together as the metacercaria of Diplostomum with "cachamas" to the ponds containing compactum (Lutz, 1928)Dubois, 1970in freshwater. The fish are fed a commerciai accordance with the detailed description pelleted feed, with supplementary food given by Ostrowski de Nirnez (1982) for beingderived from the fertilization of the this species.In histological section, the water with chicken manure, until they affected eye showed epithelial vacuoli- attain a size suitable for sale to the zation and degeneration of the lens consumer. -

Order MUGILIFORMES MUGILIDAE Mullets by I.J
click for previous page Bony Fishes 1071 Order MUGILIFORMES MUGILIDAE Mullets by I.J. Harrison, American Museum of Natural History, New York, USA iagnostic characters: Medium- to large-sized fishes, reaching a maximum size of 120 cm standard Dlength, but commonly to about 30 cm standard length; elongate with subcylindrical body. Head often broad and flattened dorsally (rounded in Agonostomus and Joturus). Eyes partly covered by adipose ‘eyefold’ tissue (translucent fatty extensions of anterior and posterior rims of eye socket) that may cover most of eye except for a small area over pupil; adipose eyefold can be seen by inserting a small pointer between surface of eye and overlying adipose tissue; adipose eyefold absent in juveniles and in Agonostomus and Joturus. Snout short; mouth small or moderate in size, terminal or inferior; premaxillae protractile; teeth small, hidden, or absent. Two short dorsal fins, well-separated; first with 4 slender spines, second with 8 to 10 soft rays;anal fin short with 2 or 3 spines and 7 to 11 soft rays in adults (for species in area); caudal fin emarginate or forked; pectoral fins inserted high on body, with dorsal ray appearing short and spinous (although not a true spine); pelvic fins with 1 spine and 5 soft rays, inserted subabdominally, about equidistant between insertion of pectoral fin and origin of first dorsal fin. Lat- eral line absent. Scales moderate to large size, with 1 or more longitudinal rows of striae (grooves) on each scale; scales ctenoid except for those on anterior predorsal and lateral parts of head, which may be cycloid. -

La Revista Ciencia Pesquera Ha Sido Parte
Bienvenida nuevamente Ciencia Pesquera a revista Ciencia Pesquera ha sido parte vación de recursos naturales relacionados con integral de la historia del Instituto Nacio- la pesca, sin dejar de lado aspectos básicos de la L nal de Pesca desde 1981, cuando con la biología y el estudio de recursos potenciales. Por dirección del doctor Jorge Carranza Fraser y del otro lado, en esta nueva etapa de Ciencia Pes- licenciado Fernando Rafful, en ese entonces jefe quera serán incluidos artículos relacionados con del Departamento de Pesca, se fundó con el pro- el cultivo y la engorda de organismos acuáticos, pósito de publicar los resultados de las investiga- como una forma de reconocer su importancia ciones que se realizaban de manera cotidiana en económica y social, y como actividades produc- nuestra Institución. También ha estado abierta a tivas abastecedoras de proteínas en México y el investigadores, organismos e instituciones que mundo. han trabajado en el desarrollo de conocimientos La publicación de trabajos se hará en estric- sobre pesca y las ciencias marinas en general. to apego a normas de alto estándar y a rigurosos Tras un breve receso hemos retomado Ciencia procedimientos editoriales. De esta manera as- Pesquera, pues si bien en México y Latinoamérica piramos a contribuir a la difusión de resultados existen varias y muy buenas revistas relacionadas de investigaciones científicas y tecnológicas que con las ciencias acuáticas, identificamos un ni- impliquen la generación de conocimiento para cho para la publicación especializada de artícu- el manejo pesquero y acuícola que demanda el los científicos y tecnológicos relacionados con la siglo XXI . -

WECAFC/SAG/VIII/2017/3(Rev) November 2017 E
WECAFC/SAG/VIII/2017/3(rev) November 2017 E WESTERN CENTRAL ATLANTIC FISHERY COMMISSION (WECAFC) EIGHT SESSION OF THE SCIENTIFIC ADVISORY GROUP (SAG) Merida, Mexico, 3-4 November 2017 Review of the State of Fisheries in FAO Area 311 Introduction 1. This document is intended to update the state of fisheries in the region of the Western Central Atlantic Fisheries Commission (WECAFC), as presented in the VIIth Session of the Scientific Advisory Group and the XVIth Session of the Commission, by adding current information on reported landings up to 2015 and reviewing recent assessment reports for different species. This document only covers FAO Area 31 (Western Central Atlantic, Fig. 1). Figure 1. Area of competence of the Western Central Atlantic Fisheries Commission (FAO Statistical Area 31 is delineated in light orange) 2. WECAFC covers nearly 15 million km2 of marine area extending from Cape Hatteras in North Carolina, United States of America (35°N), to south of Cape Recife, Brazil (10°S). This area covers the south-east coast of the United States, the Gulf of Mexico, the Caribbean Sea and the north-east coast of South America. Approximately 51% of the mandate area is in areas beyond 1 Prepared by Jeremy J. Mendoza FAO Consultant WECAFC/SAG/VIII/2017/3(rev) November 2017 E national jurisdiction (ABNJ) and around 81% corresponds to waters with depths greater than 400 m. Except for Northern Brazil which is included in FAO Area 41, the rest of the management area corresponds to FAO Area 31 (Table 1 and Fig. 1). The Caribbean Sea supports the highest species diversity in the Atlantic Ocean and is a global-scale hot spot of marine biodiversity (Roberts et al., 2002). -

Fish, Crustaceans, Molluscs, Etc Capture Production by Species
471 Fish, crustaceans, molluscs, etc Capture production by species items Atlantic, Western Central C-31 Poissons, crustacés, mollusques, etc Captures par catégories d'espèces Atlantique, centre-ouest (a) Peces, crustáceos, moluscos, etc Capturas por categorías de especies Atlántico, centro-occidental English name Scientific name Species group Nom anglais Nom scientifique Groupe d'espèces 2005 2006 2007 2008 2009 2010 2011 Nombre inglés Nombre científico Grupo de especies t t t t t t t Highwaterman catfish Hypophthalmus edentatus 13 ... ... ... ... 44 50 49 American eel Anguilla rostrata 22 17 11 13 13 27 52 163 American shad Alosa sapidissima 24 103 145 149 155 148 169 202 Alewife Alosa pseudoharengus 24 0 0 - - - - - Hickory shad Alosa mediocris 24 - - - - 22 - - American gizzard shad Dorosoma cepedianum 24 ... ... ... ... 10 ... ... Yellowfin river pellona Pellona flavipinnis 24 ... ... ... ... 35 40 40 Striped bass Morone saxatilis 25 99 18 14 9 4 7 9 White perch Morone americana 25 ... ... ... ... 1 ... ... Tonguefishes Cynoglossidae 31 - - 4 25 - - - Summer flounder Paralichthys dentatus 31 8 9 8 7 4 - 2 Bastard halibuts nei Paralichthys spp 31 334 399 379 468 444 398 434 Flatfishes nei Pleuronectiformes 31 428 396 339 263 257 3 330 332 White hake Urophycis tenuis 32 1 2 0 0 0 0 0 Gadiformes nei Gadiformes 32 2 2 1 3 1 1 286 Ladyfish Elops saurus 33 1 259 1 224 974 660 571 973 955 Tarpon Megalops atlanticus 33 137 53 71 73 59 83 219 Bonefish Albula vulpes 33 16 51 40 35 32 34 164 Sea catfishes nei Ariidae 33 21 953 14 483 9 997 6 -

UNESP Filogeografia Das Espécies De Tainha, Mugil Liza E M. Platanus
UNIVERSIDADE ESTADUAL PAULISTA – UNESP INSTITUTO DE BIOCIÊNCIAS DE BOTUCATU Filogeografia das espécies de tainha, Mugil liza e M. platanus (Teleostei: Mugiliformes) Zoila Raquel Siccha Ramirez Botucatu 2011 UNIVERSIDADE ESTADUAL PAULISTA – UNESP INSTITUTO DE BIOCIÊNCIAS DE BOTUCATU Filogeografia das espécies de tainha, Mugil liza e M. platanus (Teleostei: Mugiliformes) Tese apresentada ao Programa de Pós- Graduação em Ciências Biológicas (Zoologia) do Instituto de Biociências de Botucatu, como parte dos requisitos para a obtenção do título de Mestre. ORIENTADA: Zoila Raquel Siccha Ramirez ORIENTADOR: Dr. Claudio de Oliveira CO-ORIENTADOR: Dr. Naércio Aquino de Menezes Botucatu 2011 Ficha catalográfica elaborada pela Seção Técnica de Aquisição e Tratamento da Informação Divisão Técnica de Biblioteca e Documentação - Campus De Botucatu - UNESP Bibliotecária responsável: Sulamita Selma Clemente Colnago – CRB 8/4716 Siccha Ramirez, Zoila Raquel. Filogeografia das espécies de tainha, Mugil liza e M. platanus (Teleostei: Mugiliformes) / Zoila Raquel Siccha Ramirez. - Botucatu, 2011 Dissertação (mestrado) – Universidade Estadual Paulista, Instituto de Biociências de Botucatu 2011. Orientador: Dr. Claudio de Oliveira Co-orientador: Dr. Naércio Aquino de Menezes Capes: 20204000 1. Tainha (Peixe) - Filogeografia. Palavras-chave: Citocromo-oxidase-subunidade-I; DNA mitocondrial; Filogeografia; Mugilideos; Peixe-marinho `| ØÇ|vt {xÜxÇv|t ät t áxÜ ‹àâ xwâvtv|™Ç444 `| ÅtÅö Agradecimientos Yo creo que si tuviera que agradecer a todas las personas que