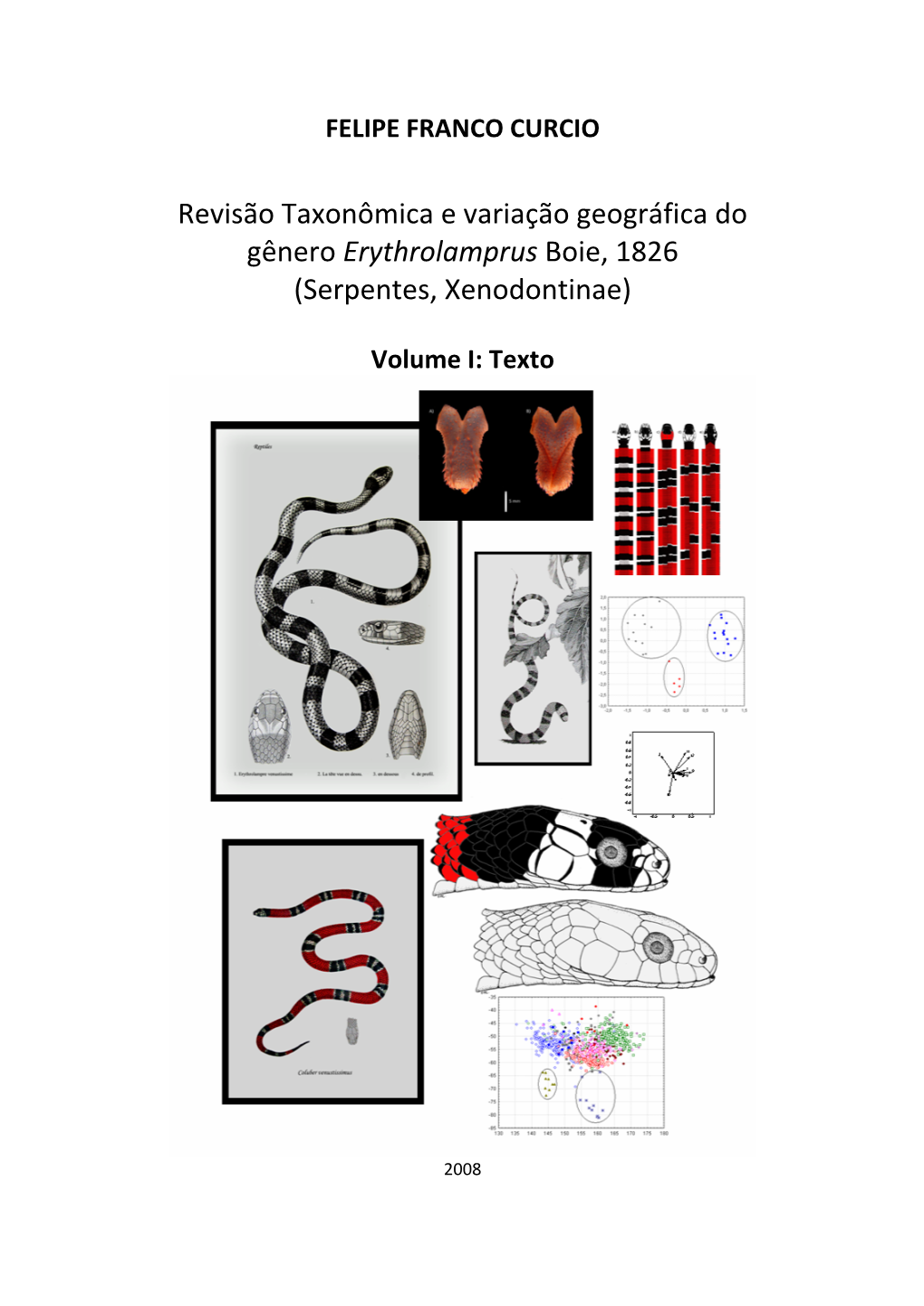
Serpentes, Xenodontinae)
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Does Color Polymorphism Affect the Predation Risk on Phalotris Lemniscatus (Duméril, Bibron and Duméril, 1854) (Serpentes, Dipsadidae)?
Acta Herpetologica 14(1): 57-63, 2019 DOI: 10.13128/Acta_Herpetol-24274 Does color polymorphism affect the predation risk on Phalotris lemniscatus (Duméril, Bibron and Duméril, 1854) (Serpentes, Dipsadidae)? Fernanda R. de Avila1,2,*, Juliano M. Oliveira3, Mateus de Oliveira1, Marcio Borges-Martins4, Victor Hugo Valiati2, Alexandro M. Tozetti1 1 Laboratório de Ecologia de Vertebrados Terrestres, Programa de Pós-Graduação em Biologia, Universidade do Vale do Rio dos Sinos, Avenida Unisinos, 950, Cristo Rei, CEP 93022-970, São Leopoldo, RS, Brasil. *Corresponding author. Email: [email protected] 2 Laboratório de Genética e Biologia Molecular, Programa de Pós-Graduação em Biologia, Universidade do Vale do Rio dos Sinos, Ave- nida Unisinos, 950, Cristo Rei, CEP 93022-970, São Leopoldo, RS, Brasil 3 Laboratório de Ecologia Vegetal, Programa de Pós-Graduação em Biologia, Universidade do Vale do Rio dos Sinos, Avenida Unisinos, 950, Cristo Rei, CEP 93022-970, São Leopoldo, RS, Brasil 4 Laboratório de Herpetologia, Departamento de Zoologia, Instituto de Biociências, Universidade Federal do Rio Grande do Sul, Ave- nida Bento Gonçalves, 9500, Agronomia, CEP 91501-970, Porto Alegre, RS, Brasil Submitted on: 2018, 3rd December; revised on: 2018, 12th April; accepted on: 2018, 2nd May Editor: Rocco Tiberti Abstract. The snake Phalotris lemniscatus is a polymorphic species regarding color, which varies between light shades with a yellow predominance (pale yellow-brown) to darker shades with a red predominance (red-dark). Pale yellow- brown individuals are more frequent in coastal populations while there is a tendency of increasing the frequency of red-dark morphs in inland areas. Considering the variation in substrate color along the species distribution (light/ sandy on the coast to reddish and dark/argillaceous in inland areas), we raise the hypothesis that the predation rate of each morph would be lower in sites were its crypsis potential is higher. -

Revista ACTA BIOLOGICA BRASILIENSIA
UMA NOVA ESPÉCIE DE Phalotris (SERPENTES, DIPSADIDAE) DO CERRADO NO NORDESTE DO BRASIL A NEW SPECIES OF Phalotris (SERPENTES, DIPSADIDAE) FROM CERRADO IN THE NORTHEAST BRAZIL Adriano Lima Silveira Biótica Estudos Ambientais. Fazenda Gameleira, região de São Jerônimo, CEP 38770-000, João Pinheiro, MG, Brasil [email protected] RESUMO O gênero Phalotris é atualmente composto por 15 espécies de serpentes que se distribuem em áreas de formações abertas na América do Sul. As espécies do gênero encontram-se arranjadas em três grupos, dos quais o grupo de P. nasutus contempla esta espécie e P. concolor, P. lativittatus, P. nigrilatus e P. labiomaculatus. No presente trabalho, descreve-se uma nova espécie de Phalotris do Cerrado no Nordeste do Brasil, pertencente ao grupo de P. nasutus. O novo táxon é conhecido apenas do holótipo, procedente de Cocos, no sudoeste do estado da Bahia. A nova espécie é diagnosticada das demais congêneres por apresentar uma combinação exclusiva de caracteres, dentre eles: escama rostral proeminente, mas com o ápice arredondado; escama rostral em contato com pré-frontal; 1+1 escamas temporais; número relativamente elevado de escamas ventrais (202) e subcaudais (36); dorso com coloração uniforme, amarelado em preservação e vermelho-alaranjado em vida; dorso e lateral da cabeça de cor preta uniforme, com manchas brancas no lábio; um colar nucal anterior branco, evidente e muito estreito (1-2 escamas); um colar nucal posterior preto, evidente e extenso (3-5 escamas). Dentre as espécies do grupo de P. nasutus, o novo táxon exibe maior similaridade fenotípica com P. labiomaculatus e P. concolor. A nova espécie é considerada endêmica do Cerrado, um dos biomas mais ameaçados do planeta. -

Mordedura De Phalotris Lemniscatus
Acta Toxicol. Argent. (2019) 27 (2): 65-71 Mordedura de Phalotris lemniscatus (Duméril, Bibron & Duméril, 1854) (Squamata, Dipsadidae) en Uruguay Phalotris lemniscatus (Duméril, Bibron & Duméril, 1854) (Squamata, Dipsadidae) bites in Uruguay Negrin, Alba1*; Morais, Víctor2; Carreira, Santiago3,4,5; Tortorella, María Noel1 1Departamento de Toxicología, Hospital de Clínicas, Facultad de Medicina. Universidad de la República, Av. Italia s/n. Montevideo, 11600, Uruguay. 2Departamento de Desarrollo Biotecnológico y Producción, Instituto de Higiene, Facultad de Medicina, Universidad de la República, Av. Alfredo Navarro 3051, Montevideo, 11600, Uruguay. 3Bioterio de Animales Ponzoñosos (Serpentario), Instituto de Higiene, Facultad de Ciencias, Universidad de la República, Av. Alfredo Navarro 3051, Montevideo, 11600, Uruguay. 4Laboratorio de Sistemática e Historia Natural de Vertebrados, Instituto de Ecología y Ciencias Ambientales, Facultad de Ciencias, Udelar, Iguá 4225, 11400. Montevideo, Uruguay. 5Sección Herpetología, Museo Nacional de Historia Natural, 25 de Mayo 582, 11000, Montevideo, Uruguay. Telefax: +59824870300 *[email protected] Recibido: 28 de marzo de 2019 Aceptado: 25 de julio de 2019 Resumen. Phalotris lemniscatus es la única especie representante del género Phalotris en Uruguay. Esta especie tiene una amplia distribución que incluye Uruguay, Rio Grande do Sul en Brasil y el norte de Argentina que se extiende a las áreas fronterizas con Bolivia y Paraguay. Aunque este ofidio no es agresivo, se registraron dos accidentes en Uruguay en los que se observó acción local y sistémica del veneno. Los mismos ocurrieron en las manos después de manipulación excesiva y prolongada de los ejemplares. Localmente presentaron edema leve, pero en términos sistémicos el veneno de Phalotris causó alteraciones en la coagulación. -

De Los Reptiles Del Yasuní
guía dinámica de los reptiles del yasuní omar torres coordinador editorial Lista de especies Número de especies: 113 Amphisbaenia Amphisbaenidae Amphisbaena bassleri, Culebras ciegas Squamata: Serpentes Boidae Boa constrictor, Boas matacaballo Corallus hortulanus, Boas de los jardines Epicrates cenchria, Boas arcoiris Eunectes murinus, Anacondas Colubridae: Dipsadinae Atractus major, Culebras tierreras cafés Atractus collaris, Culebras tierreras de collares Atractus elaps, Falsas corales tierreras Atractus occipitoalbus, Culebras tierreras grises Atractus snethlageae, Culebras tierreras Clelia clelia, Chontas Dipsas catesbyi, Culebras caracoleras de Catesby Dipsas indica, Culebras caracoleras neotropicales Drepanoides anomalus, Culebras hoz Erythrolamprus reginae, Culebras terrestres reales Erythrolamprus typhlus, Culebras terrestres ciegas Erythrolamprus guentheri, Falsas corales de nuca rosa Helicops angulatus, Culebras de agua anguladas Helicops pastazae, Culebras de agua de Pastaza Helicops leopardinus, Culebras de agua leopardo Helicops petersi, Culebras de agua de Peters Hydrops triangularis, Culebras de agua triángulo Hydrops martii, Culebras de agua amazónicas Imantodes lentiferus, Cordoncillos del Amazonas Imantodes cenchoa, Cordoncillos comunes Leptodeira annulata, Serpientes ojos de gato anilladas Oxyrhopus petolarius, Falsas corales amazónicas Oxyrhopus melanogenys, Falsas corales oscuras Oxyrhopus vanidicus, Falsas corales Philodryas argentea, Serpientes liana verdes de banda plateada Philodryas viridissima, Serpientes corredoras -

Rhachidelus Brazili
ISSN 1809-127X (online edition) © 2011 Check List and Authors Chec List Open Access | Freely available at www.checklist.org.br Journal of species lists and distribution N Rhachidelus brazili ISTRIBUTIO and distribution map Boulenger, in Mato Grosso1908 (Squamata: and Mato Grosso do D SulSerpentes: states, Brazil Dipsadidae): New records, range extension RAPHIC G EO Luana A. G. Arruda 1, Robson W. Ávila 2, Drausio H. Morais 3 and Ricardo A. Kawashita-Ribeiro 1,4* G N O 1 Universidade Federal de Mato Grosso, Instituto de Biociências, Coleção Zoológica de Vertebrados. Avenida Fernando Corrêa da Costa, 2367. CEP 78060-900. Cuiabá, MT, Brazil. 2 Universidade Regional do Cariri, Centro de Ciências Biológicas e da Saúde, Departamento de Ciências Biológicas, Campus do Pimenta. Rua Cel. OTES Antonio Luiz, 1161, Bairro do Pimenta. CEP 63105-100, Crato, CE, Brazil. N 3 Universidade Estadual Paulista, Instituto de Biociências, Departamento de Parasitologia, Programa de Pós-Graduação em Ciências Biológicas. Distrito de Rubião Júnior s/n. CEP 18618-000. Botucatu, SP, Brazil. 4 Universidade Federal de Mato Grosso, Instituto de Biociências, Departamento de Ecologia, Programa de Pós-Graduação em Ecologia e Conservação da Biodiversidade. Avenida Fernando Corrêa da Costa, 2367. CEP 78060-900. Cuiabá, MT, Brazil. [email protected] * Corresponding author. E-mail: Abstract: The present study reports new records of the Dipsadid snake Rhachidelus brazili Boulenger, 1908, from Mato Grosso and Mato Grosso do Sul states, Brazil. Our data extend the known geographical distribution ca. 713 km to the northwest and constitute the first record in the Upper Paraguay sub-basin. The Dipsadid snake Rhachidelus brazili Boulenger, – Cuiabá, Mato Grosso (15°35’ S, 56°05’ W) UFMT-R 1908 belongs to a monotypic genus of the Pseudoboini 5465; 2 – Vale de São Domingos, Mato Grosso (14°57’ tribe (Peters and Orejas-Miranda 1986; Zaher 1999). -

Amazon Alive: a Decade of Discoveries 1999-2009
Amazon Alive! A decade of discovery 1999-2009 The Amazon is the planet’s largest rainforest and river basin. It supports countless thousands of species, as well as 30 million people. © Brent Stirton / Getty Images / WWF-UK © Brent Stirton / Getty Images The Amazon is the largest rainforest on Earth. It’s famed for its unrivalled biological diversity, with wildlife that includes jaguars, river dolphins, manatees, giant otters, capybaras, harpy eagles, anacondas and piranhas. The many unique habitats in this globally significant region conceal a wealth of hidden species, which scientists continue to discover at an incredible rate. Between 1999 and 2009, at least 1,200 new species of plants and vertebrates have been discovered in the Amazon biome (see page 6 for a map showing the extent of the region that this spans). The new species include 637 plants, 257 fish, 216 amphibians, 55 reptiles, 16 birds and 39 mammals. In addition, thousands of new invertebrate species have been uncovered. Owing to the sheer number of the latter, these are not covered in detail by this report. This report has tried to be comprehensive in its listing of new plants and vertebrates described from the Amazon biome in the last decade. But for the largest groups of life on Earth, such as invertebrates, such lists do not exist – so the number of new species presented here is no doubt an underestimate. Cover image: Ranitomeya benedicta, new poison frog species © Evan Twomey amazon alive! i a decade of discovery 1999-2009 1 Ahmed Djoghlaf, Executive Secretary, Foreword Convention on Biological Diversity The vital importance of the Amazon rainforest is very basic work on the natural history of the well known. -

O Mimetismo Das Serpentes Corais Em Ambientes
UNIVERSIDADE DE BRASÍLIA INSTITUTO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE ECOLOGIA O MIMETISMO DAS SERPENTES CORAIS EM AMBIENTES CAMPESTRES, SAVÂNICOS E FLORESTAIS DA AMÉRICA DO SUL Frederico Gustavo Rodrigues França Brasília-DF 2008 UNIVERSIDADE DE BRASÍLIA INSTITUTO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE ECOLOGIA O MIMETISMO DAS SERPENTES CORAIS EM AMBIENTES CAMPESTRES, SAVÂNICOS E FLORESTAIS DA AMÉRICA DO SUL Frederico Gustavo Rodrigues França Orientador: Alexandre Fernandes Bamberg de Araújo Tese apresentada ao Departamento de Ecologia do Instituto de Ciências Biológicas da Universidade de Brasília, como parte dos requisitos necessários para a obtenção do título de Doutor em Ecologia. Brasília-DF 2008 Trabalho realizado junto ao Departamento de Ecologia do Instituto de Ciências Biológicas da Universidade de Brasília, sob orientação do Prof. Alexandre Fernandes Bamberg de Araújo, com o apoio financeiro da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) e Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), como parte dos requisitos para obtenção do título de Doutor em Ecologia. Data da Defesa: 01 de agosto de 2008 Banca Examinadora Prof. Dr. Alexandre Fernandes Bamberg de Araújo (Orientador) ________________________________________________ Prof. Dr. Daniel Oliveira Mesquita ________________________________________________ Prof. Dr. Guarino Rinaldi Colli ________________________________________________ Prof. Dr. Hélio Ricardo da Silva ________________________________________________ Prof. Dr. Raimundo -

Life History Traits of the Snake Phalotris Lativittatus (Xenodontinae: Elapomorphini) from the Brazilian Cerrado
Herpetology Notes, volume 2: 163-164 (2009) (published online on 05 October 2009) Life history traits of the snake Phalotris lativittatus (Xenodontinae: Elapomorphini) from the Brazilian Cerrado Henrique B. P. Braz1*, Cybele O. Araujo1,2, Selma M. Almeida-Santos1 Abstract. Data on life history traits (fecundity, egg size, relative clutch mass, hatchling size) of the snake Phalotris lativittatus are reported. This is the first record of such data for this rare endemic species of the Brazilian Cerrado biome. Fecundity is low, but relative clutch mass is high for the species, as well as for other fossorial squamates. Keywords. Relative clutch mass, fecundity, hatchling size, incubation period, growth rate. The snake genus Phalotris belongs to the tribe 14th January 2008 it laid 5 eggs within the cage. Eggs Elapomorphini and is composed of nearly 14 species averaged 45.2 ± 3.3 mm in length (range = 39.8-48.7 with fossorial habits (Uetz, 2009). Phalotris lativittatus is mm), 14.5 ± 0.2 mm in width (range = 14.2-14.9 mm) a rare, medium-sized species distributed endemically in and 6.5 ± 0.4 g in mass (range = 6.0-6.9 g). Clutch mass Cerrado vegetation areas in São Paulo state (Ferrarezzi, was 32.7 g and after oviposition the female weighed 1993; Sawaya, Marques and Martins, 2008; Vasconcelos 62.0 g. The RCM (total clutch mass/body mass of and Santos, 2009). Data on feeding habits are unknown, mother after oviposition; cf. Shine, 1980) was 0.53. The but as well as congenerics, it is likely that diet may female was deposited at the Herpetological Collection be constituted of other elongated fossorial vertebrates “Alphonse Richard Hoge”, at Instituto Butantan (IBSP) (Sawaya, Marques and Martins, 2008). -

Ecological Functions of Neotropical Amphibians and Reptiles: a Review
Univ. Sci. 2015, Vol. 20 (2): 229-245 doi: 10.11144/Javeriana.SC20-2.efna Freely available on line REVIEW ARTICLE Ecological functions of neotropical amphibians and reptiles: a review Cortés-Gomez AM1, Ruiz-Agudelo CA2 , Valencia-Aguilar A3, Ladle RJ4 Abstract Amphibians and reptiles (herps) are the most abundant and diverse vertebrate taxa in tropical ecosystems. Nevertheless, little is known about their role in maintaining and regulating ecosystem functions and, by extension, their potential value for supporting ecosystem services. Here, we review research on the ecological functions of Neotropical herps, in different sources (the bibliographic databases, book chapters, etc.). A total of 167 Neotropical herpetology studies published over the last four decades (1970 to 2014) were reviewed, providing information on more than 100 species that contribute to at least five categories of ecological functions: i) nutrient cycling; ii) bioturbation; iii) pollination; iv) seed dispersal, and; v) energy flow through ecosystems. We emphasize the need to expand the knowledge about ecological functions in Neotropical ecosystems and the mechanisms behind these, through the study of functional traits and analysis of ecological processes. Many of these functions provide key ecosystem services, such as biological pest control, seed dispersal and water quality. By knowing and understanding the functions that perform the herps in ecosystems, management plans for cultural landscapes, restoration or recovery projects of landscapes that involve aquatic and terrestrial systems, development of comprehensive plans and detailed conservation of species and ecosystems may be structured in a more appropriate way. Besides information gaps identified in this review, this contribution explores these issues in terms of better understanding of key questions in the study of ecosystem services and biodiversity and, also, of how these services are generated. -

Reserva Natural Laguna Blanca, Departmento San Pedro
Russian Journal of Herpetology Vol. 23, No. 1, 2016, pp. 25 – 34 RESERVA NATURAL LAGUNA BLANCA, DEPARTAMENTO SAN PEDRO: PARAGUAY’S FIRST IMPORTANT AREA FOR THE CONSERVATION OF AMPHIBIANS AND REPTILES? Paul Smith,1,2 Karina Atkinson,2 Jean-Paul Brouard,2 Helen Pheasey2 Submitted December 30, 2014. Geographical sampling bias and restricted search methodologies have resulted in the distribution of Paraguayan reptiles and amphibians being patchily known. Available data is almost entirely based on brief collecting trips and rapid ecological inventories, often several decades apart, which inevitably struggle to detect more inconspicuous species and patterns of abundance. This has led to a deficit in our knowledge of the true distribution and abun- dance of Paraguayan reptiles and amphibians. The establishment of the NGO Para La Tierra at Reserva Natural Laguna Blanca (RNLB), Depto. San Pedro, Paraguay allowed the first modern sustained, multi-method inventory of Paraguayan reptiles and amphibians to be performed at a single site. Despite the small size of the reserve (804 ha), a total of 57 reptiles (12 of national conservation concern) and 32 amphibians (one of national conserva- tion concern) were collected during five years of random sampling, qualifying RNLB as the most biodiverse re- serve for reptiles and amphibians in the country. Six species occurring at RNLB have been found at no other Para- guayan locality. Legal protection for this private reserve expired in January 2015 and the conservation implica- tions of the inventory results are discussed. It is proposed that the long term legal protection of the reserve be con- sidered a national conservation priority and that the diversity of the herpetofauna be recognized with the designa- tion of RNLB as Paraguay’s first Important Area for the Conservation of Amphibians and Reptiles. -

Iheringia Zoologia 1
i »r> 2 E CO _ C/> co LIBRARIES SMITHSONIAN INSTITUTION NOIinillSNI NVINOSHIMS S3IHV 2 i ^ z « co z co z ^NouniiisNi NViNOSHims^SB avaa h li B RAR I ES^SMITHSONIAN^INSTITL <n <" — ^ ^ Z \ ^ ^ 5 co 'LIBRARIES^SMITHSONIAN^INSTITUTION^OIiniliSNI^NVINOSHIlWS^SaiaV ^NOIiniliSNI^NVINOSHilWS^SBiaVaan^lBRARIES^SMITHSONiAN'lNSTIU LI B RAR I ES SMITHSONIAN INSTITUTION^NOlinillSNI^NVINOSHlIWS^ _ I d Vi Z ^rr^ ?> 2 M ZZ CO < *N0linillSNI^NVIN0SHllWS^S3 I H VH S 11 "Yl B RAR I ES^SMITHSONIAN^INSTITU B RAR I ES SMITHSONIAN^INSTITUTION^NOlinillSNrNVINOSHlIWS^SB I h Vfc CO Z CO 5 Ä ^NOIinillSNI^NVINOSHlIWS'sa I d fl Vd H LI B RAR I ES^SMITHSONIAN^NSTITU oo 00 , Z J Z ES SMITHS0NIAN" |NSTITUTI0N N0linillSNl" NVIN0SHllWS S3 I HVh Z l~ 21 r* -» co *• Z —-"^ iy5 *•!/> — II L NOIlfUUSNrNVINOSHlMS S3 I U VU a *R I ES^SMITHSONIAN^INSTITUTION co z * co mm^ ^ ^ S ^ s. ^ -^ < o /£/ CO *" co 2 co 2 CO Z INSTITUTION 11I1SNI NVIN0SH1MS S3ldVdan LIBRARIES SMITHSONIAN J to o: o: Z -I z -J -», l ARIES SMITHSONIAN INSTITUTION NOIlfUllSNI NVIN0SH1IWS S3 1 dV^J 8 II z o ^~~^ co E co X == °° UI1SNI NVIN0SH1IWS S3IUVHail LI B RAR I ES SMITHSONIAN INSTITUTION^ » CO Z ~v co z 2 AR I ES^SMITHSONIAN INSTITUTION NOIlfllllSNI NVINOSHlIWS^Sa I HVH 3 II co 2 co J :Z Z I SMITHSONIAN"jNSTITUTION UllSNl" NVIN0SHllWS S3 I d VU 8 II^LI B RAR ES z r- z 1 > J/ » N> — co _ co ± CO l"l ARIES SMITHSONIAN INSTITUTION NOIlfUllSNI NVIN0SH1IWS S3 I HVHS co co Z . -

From Four Sites in Southern Amazonia, with A
Bol. Mus. Para. Emílio Goeldi. Cienc. Nat., Belém, v. 4, n. 2, p. 99-118, maio-ago. 2009 Squamata (Reptilia) from four sites in southern Amazonia, with a biogeographic analysis of Amazonian lizards Squamata (Reptilia) de quatro localidades da Amazônia meridional, com uma análise biogeográfica dos lagartos amazônicos Teresa Cristina Sauer Avila-PiresI Laurie Joseph VittII Shawn Scott SartoriusIII Peter Andrew ZaniIV Abstract: We studied the squamate fauna from four sites in southern Amazonia of Brazil. We also summarized data on lizard faunas for nine other well-studied areas in Amazonia to make pairwise comparisons among sites. The Biogeographic Similarity Coefficient for each pair of sites was calculated and plotted against the geographic distance between the sites. A Parsimony Analysis of Endemicity was performed comparing all sites. A total of 114 species has been recorded in the four studied sites, of which 45 are lizards, three amphisbaenians, and 66 snakes. The two sites between the Xingu and Madeira rivers were the poorest in number of species, those in western Amazonia, between the Madeira and Juruá Rivers, were the richest. Biogeographic analyses corroborated the existence of a well-defined separation between a western and an eastern lizard fauna. The western fauna contains two groups, which occupy respectively the areas of endemism known as Napo (west) and Inambari (southwest). Relationships among these western localities varied, except between the two northernmost localities, Iquitos and Santa Cecilia, which grouped together in all five area cladograms obtained. No variation existed in the area cladogram between eastern Amazonia sites. The easternmost localities grouped with Guianan localities, and they all grouped with localities more to the west, south of the Amazon River.