Centre De Cooperation Internationale En
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Diversity and Levels of Endemism of the Bromeliaceae of Costa Rica – an Updated Checklist
A peer-reviewed open-access journal PhytoKeys 29: 17–62Diversity (2013) and levels of endemism of the Bromeliaceae of Costa Rica... 17 doi: 10.3897/phytokeys.29.4937 CHECKLIST www.phytokeys.com Launched to accelerate biodiversity research Diversity and levels of endemism of the Bromeliaceae of Costa Rica – an updated checklist Daniel A. Cáceres González1,2, Katharina Schulte1,3,4, Marco Schmidt1,2,3, Georg Zizka1,2,3 1 Abteilung Botanik und molekulare Evolutionsforschung, Senckenberg Forschungsinstitut Frankfurt/Main, Germany 2 Institut Ökologie, Evolution & Diversität, Goethe-Universität Frankfurt/Main, Germany 3 Biodive rsität und Klima Forschungszentrum (BiK-F), Frankfurt/Main, Germany 4 Australian Tropical Herbarium & Center for Tropical Biodiversity and Climate Change, James Cook University, Cairns, Australia Corresponding author: Daniel A. Cáceres González ([email protected]) Academic editor: L. Versieux | Received 1 March 2013 | Accepted 28 October 2013 | Published 11 November 2013 Citation: González DAC, Schulte K, Schmidt M, Zizka G (2013) Diversity and levels of endemism of the Bromeliaceae of Costa Rica – an updated checklist. PhytoKeys 29: 17–61. doi: 10.3897/phytokeys.29.4937 This paper is dedicated to the late Harry Luther, a world leader in bromeliad research. Abstract An updated inventory of the Bromeliaceae for Costa Rica is presented including citations of representa- tive specimens for each species. The family comprises 18 genera and 198 species in Costa Rica, 32 spe- cies being endemic to the country. Additional 36 species are endemic to Costa Rica and Panama. Only 4 of the 8 bromeliad subfamilies occur in Costa Rica, with a strong predominance of Tillandsioideae (7 genera/150 spp.; 75.7% of all bromeliad species in Costa Rica). -

12. Plantas Y Líquenes Del Parque Nacional Natural De La Serranía De
PLANTAS Y LÍQUENES DEL PARQUE NACIONAL NATURAL SERRANÍA DE CHIRIBIQUETE, COLOMBIA Dairon Cárdenas1*1*,, MaríaMaría FernandaFernanda GonzálezGonzález12 ,, NóridaNórida MarínMarín11 y Sonia Sua11,, JulioJulio BetancurBetancur2 RESUMEN principales de formaciones vegetales registrados para la Guayana: bosques, matorrales, praderas o Se presenta el inventario de las plantas y los pastizales y la vegetación pionera sobre roca dura. líquenes del Parque Nacional Natural Serranía de En los afloramientos rocosos predominan especies Chiribiquete (PNNSCh), obtenido a través de como: Abolboda spp., Acanthella sprucei, Bonnetia información de herbarios y exploraciones de campo. sessilis, Calliandra vaupesiana, Clusia spp., Cyrilla Chiribiquete es el área protegida más grande de racemiflora, Decagonocarpus oppositifolius, Drosera Colombia, pertenece a la formación Guayana, esmeraldae, Euphronia hirtelloides, Gongylolepis tiene altitudes entre 200 y 800 metros y representa una gran meseta tectónica fraccionada por erosión martiana, Hevea nitida, Molongum lucidum, hídrica y disectada en numerosas mesas (tepuyes). Navia spp., Ochthocosmus berryi, Monotrema aemu- Se registraron 2,138 especies que corresponden lans, Pachira coriacea, Parahancornia surrogata, al 7.6 % de las encontradas en Colombia y al 66.5 Senefelderopsis chiribiquetensis, Steyerbromelia % de las de la región amazónica. Las familias con garcia-barrigae, Styrax rigidifolius, Tepuianthus más especies fueron: Fabaceae (184), Rubiaceae savannensis, Utricularia spp., Vellozia tubiflora (167) -
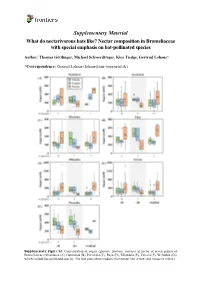
Supplementary Material What Do Nectarivorous Bats Like? Nectar Composition in Bromeliaceae with Special Emphasis on Bat-Pollinated Species
Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S1: Concentration of sugars (glucose, fructose, sucrose) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)) which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S2: Concentration of amino acids (ala, arg, asn, asp, gaba, gln, glu, gly, his, iso, leu, lys, met, phe, pro, ser, thr, trp, tyr, val) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)), which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S3: Cation concentrations (Ca2+, K+, Na+, Mg2+) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)), which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). -

AUTOR: Nelson Armando Jaramillo Díaz DIRECTOR
UNIVERSIDAD NACIONAL DE LOJA ÁREA AGROPECUARIA Y DE RECURSOS NATURALES RENOVABLES CARRERA DE INGENIERÍA FORESTAL ESTRUCTURA FUNCIONAL DE COMUNIDADES DE BROMELIÁCEAS CON ÉNFASIS EN EL FLUJO DE METANO, AGUA Y NUTRIENTES A LO LARGO DE LA GRADIENTE ALTITUDINAL DE LA CUENCA AMAZÓNICA ECUATORIANA Tesis de Grado, previa a la obtención del Título de Ingeniero Forestal AUTOR: Nelson Armando Jaramillo Díaz DIRECTOR: Zhofre Aguirre Mendoza, Ph. D Loja – Ecuador 2015 i CERTIFICACIÓN Ing. Zhofre Aguirre Mendoza, Ph. D DIRECTOR DE TESIS CERTIFICA: Que la tesis titulada “ESTRUCTURA FUNCIONAL DE COMUNIDADES DE BROMELIÁCEAS CON ÉNFASIS EN EL FLUJO DE METANO, AGUA Y NUTRIENTES A LO LARGO DE LA GRADIENTE ALTITUDINAL DE LA CUENCA AMAZÓNICA ECUATORIANA”, de autoría del egresado Nelson Armando Jaramillo Díaz, ha sido dirigida, revisada y aprobada en su integridad, por lo que autorizo su publicación y difusión. Loja, mayo del 2015 .......................................................... Ing. Zhofre Aguirre Mendoza Ph. D DIRECTOR DE TESIS ii EL TRIBUNAL CALIFICADOR DE LA TESIS “ESTRUCTURA FUNCIONAL DE COMUNIDADES DE BROMELIÁCEAS CON ÉNFASIS EN EL FLUJO DE METANO, AGUA Y NUTRIENTES A LO LARGO DE LA GRADIENTE ALTITUDINAL DE LA CUENCA AMAZÓNICA ECUATORIANA” CERTIFICA: En calidad de Tribunal de Calificación de la tesis titulada “ESTRUCTURA FUNCIONAL DE COMUNIDADES DE BROMELIÁCEAS CON ÉNFASIS EN EL FLUJO DE METANO, AGUA Y NUTRIENTES A LO LARGO DE LA GRADIENTE ALTITUDINAL DE LA CUENCA AMAZÓNICA ECUATORIANA”, de autoría del egresado Nelson Armando Jaramillo Díaz, ha sido dirigida, revisada e incorporadas todas las sugerencias efectuadas por el Tribunal Calificador, y luego de su revisión se ha procedido a la respectiva calificación y aprobación. -

Plethora of Plants – Collections of the Botanical Garden, Faculty Of
Nat. Croat. Vol. 24(2), 2015 361 NAT. CROAT. VOL. 24 No 2 361–397* ZAGREB December 31, 2015 professional paper / stručni članak – museal collections / muzejske zbirke DOI: 10.302/NC.2015.24.26 PLETHORA OF PLANTS – ColleCtions of the BotaniCal Garden, faCulty of ScienCe, university of ZaGreB (1): temperate Glasshouse exotiCs – HISTORIC OVERVIEW Sanja Kovačić Botanical Garden, department of Biology, faculty of science, university of Zagreb, marulićev trg 9a, HR-10000 Zagreb, Croatia (e-mail: [email protected]) Kovačić, S.: Plethora of plants – collections of the Botanical garden, Faculty of Science, Univer- sity of Zagreb (1): Temperate glasshouse exotics – historic overview. Nat. Croat., Vol. 24, No. 2, 361–397*, 2015, Zagreb due to the forthcoming obligation to thoroughly catalogue and officially register all living and non-living collections in the european union, an inventory revision of the plant collections in Zagreb Botanical Garden of the faculty of science (university of Zagreb, Croatia) has been initiated. the plant lists of the temperate (warm) greenhouse collections since the construction of the first, exhibition Glasshouse (1891), until today (2015) have been studied. synonymy, nomenclature and origin of plant material have been sorted. lists of species grown (or that presumably lived) in the warm greenhouse conditions during the last 120 years have been constructed to show that throughout that period at least 1000 plant taxa from 380 genera and 90 families inhabited the temperate collections of the Garden. today, that collection holds 320 exotic taxa from 146 genera and 56 families. Key words: Zagreb Botanical Garden, warm greenhouse conditions, historic plant collections, tem- perate glasshouse collection Kovačić, S.: Obilje bilja – zbirke Botaničkoga vrta Prirodoslovno-matematičkog fakulteta Sve- učilišta u Zagrebu (1): Uresnice toplog staklenika – povijesni pregled. -

Systematics of Vriesea (Bromeliaceae): Phylogenetic Relationships Based on Nuclear Gene and Partial Plastome Sequences
Published in "Botanical Journal of the Linnean Society 192(4): 656–674, 2020" which should be cited to refer to this work. Systematics of Vriesea (Bromeliaceae): phylogenetic relationships based on nuclear gene and partial plastome sequences TALITA MOTA MACHADO1*, , ORIANE LOISEAU2, MARGOT PARIS3, ANNA WEIGAND4, LEONARDO M. VERSIEUX5, JOÃO RENATO STEHMANN1, CHRISTIAN LEXER6 and NICOLAS SALAMIN2, 1Departamento de Botânica, Instituto de Ciências Biológicas, Programa de Pós-Graduação em Biologia Vegetal, Universidade Federal de Minas Gerais, Belo Horizonte, CEP 31270–901, MG, Brazil 2Department of Computational Biology, University of Lausanne, 1015 Lausanne, Switzerland 3Department of Biology, Unit Ecology and Evolution, University of Fribourg, Fribourg, Switzerland 4Department of Systematic and Evolutionary Botany, University of Zurich, 8008, Zurich, Switzerland 5Laboratório de Botânica Sistemática, Departamento de Botânica e Zoologia, Centro de Biociências, Universidade Federal do Rio Grande do Norte, Natal, CEP 59078–970, RN, Brazil 6Department of Botany and Biodiversity Research, Faculty of Life Sciences, University of Vienna, Rennweg 14, 1030 Vienna, Austria Vriesea is the second largest genus in Tillandsioideae, the most diverse subfamily of Bromeliaceae. Although recent studies focusing on Tillandsioideae have improved the systematics of Vriesea, no consensus has been reached regarding the circumscription of the genus. Here, we present a phylogenetic analysis of core Tillandsioideae using the nuclear gene phyC and plastid data obtained from genome skimming. We investigate evolutionary relationships at the intergeneric level in Vrieseeae and at the intrageneric level in Vriesea s.s. We sampled a comprehensive dataset, including 11 genera of Tillandsioideae and nearly 50% of all known Vriesea spp. Using a genome skimming approach, we obtained a 78 483-bp plastome alignment containing 35 complete and 55 partial protein-coding genes. -

Andean Flora of Ecuador
Andean Flora of Ecuador Naturetrek Tour Report 24 September - 9 October 2013 Report compiled by Gustavo Cañas-Valle Naturetrek Cheriton Mill Cheriton Alresford Hampshire SO24 0NG England T: +44 (0)1962 733051 F: +44 (0)1962 736426 E: [email protected] W: www.naturetrek.co.uk Tour Report Andean Flora of Ecuador Tour Leader: Gustavo Cañas-Valle Participants: Neil Sanders Vivien Aylmer Peter Douch Monica Douch George Everett Joan Vincent Introduction Ecuador harbors one of the richest floras of the world. Walking forested areas, along roads and paths, we try to convey the diversity of the flora of the Eastern Andes of Ecuador. Our exploration progresses through the main vegetation formations of a corridor traced between Quito and Vilcabamba, with side trips to the Cloud Forest on the eastern slopes. During the trip, we had brief evening gatherings to identify some of the readily described flowers up to level of genus. We photographed flowers belonging to 184 genera and 74 families. Among them, I identified 220 flowers to the species level. These 220 species included 34 plants endemic to Ecuador, 55 specialties unique to Ecuador and either Colombia or Peru, and 16 species only available in the territory covered by the three countries. In the end, our 14 day adventure generated a list of 105 range restricted flowering plants identified to species, which can be seen only in the Andes of either Ecuador or its neighbouring countries. Most of them occurr in habitats which also represent a reduced extension of native vegetation, for example: the Andean Paramos and the Dry Inter-Andean Valleys. -

VOLUME LII Third Quarter 2018
Bromeliaceae VOLUME LII Third Quarter 2018 The Bromeliad Society of Queensland Inc. P.O. Box 565, Fortitude Valley, Q 4006 www.bromsqueensland.com.au Email: [email protected] [email protected] [email protected] Committee Details PRESIDENT Barry Kable (07) 3824 5931 VICE PRESIDENT John Olsen (07) 3856 0265 TREASURER John Olsen SECRETARY Alfonso Trudu COMMITTEE Pam Butler, John Williamson, Gilda Trudu, Fred Thomson, Tom Isaac, Joy Constantino, Maxim Wilson, Bruce Dunstan. DATABASE MANAGER John Williamson LIBRARIAN Evelyn Rees SHOW CONVENOR John Williamson BROMELIACEAE EDITORS John Olsen, Barbara Murray, Maxim Wilson BSQ WEBMASTER Joy Constantino FIELD DAY COORDINATORS Ruth Kimber & Bev Mulcahy SEED BANK COORDINATOR Peter Ball SUPPER STEWARDS Selga Boothby & Sharon Born PLANT SALES Margaret Kraa & Lee Thornycroft ASSISTANT SALES Michelle Cameron COMPETITION STEWARDS Fred Thomson, Denice McLean, Helen Moriarty NEWSLETTER COORDINATOR Maxim Wilson ASSISTANT SHOW CONVENER Peter Ball HALL COORDINATOR David Rees RAFFLE COORDINATOR Lesley Gibbs EXHIBITION COORDINATOR Amanda Meads HISTORIAN Glenn Bernoth MONTHLY MEETINGS of the Society are held on the 3rd Thursday of each month except for December, at the Uniting Hall, 52 Merthyr Road, New Farm, Brisbane, commencing 7:30 pm. ANNUAL GENERAL MEETING is held immediately before the March Meeting Front Cover: Tillandsia ‘Olive’ By Margaret Paterson Rear Cover: Guzmania lychnis By: Bruce Dunstan The Bromeliad Society of Queensland Inc., gives permission to all Bromeliad Societies to reprint articles in their journals provided [email protected] is advised and proper acknowledgement is given to the original author and Bromeliaceae. This permission does not apply to any other person or organisation without the prior permission of the author. -

(Bromeliaceae) En Megaméxico, Con Énfasis En La Alianza Androlepis
Centro de Investigación Científica de Yucatán, A.C. Posgrado en Ciencias Biológicas Sistemática de Bromelioideae (Bromeliaceae) en Megaméxico, con énfasis en la Alianza Androlepis Tesis que presenta Claudia Janeth Ramírez Díaz En opción al título de MAESTRA EN CIENCIAS (Ciencias Biológicas: Opción Recursos Naturales) Mérida, Yucatán, México Mayo, 2019 DECLARACIÓN DE PROPIEDAD Declaro que la información contenida en la sección de Materiales y Métodos Experimentales, los Resultados y Discusión de este documento proviene de las actividades de experimentación realizadas durante el período que se me asignó para desarrollar mi trabajo de tesis, en las Unidades y Laboratorios del Centro de Investigación Científica de Yucatán, A.C., y que a razón de lo anterior y en contraprestación de los servicios educativos o de apoyo que me fueron brindados, dicha información, en términos de la Ley Federal del Derecho de Autor y la Ley de la Propiedad Industrial, le pertenece patrimonialmente a dicho Centro de Investigación. Por otra parte, en virtud de lo ya manifestado, reconozco que de igual manera los productos intelectuales o desarrollos tecnológicos que deriven o pudieran derivar de lo correspondiente a dicha información, le pertenecen patrimonialmente al Centro de Investigación Científica de Yucatán, A.C., y en el mismo tenor, reconozco que si derivaren de este trabajo productos intelectuales o desarrollos tecnológicos, en lo especial, estos se regirán en todo caso por lo dispuesto por la Ley Federal del Derecho de Autor y la Ley de la Propiedad Industrial, en el tenor de lo expuesto en la presente Declaración. Firma: ________________________________ Claudia Janeth Ramírez Díaz AGRADECIMIENTOS Al Consejo Nacional de Ciencia y Tecnología (CONACyT) por la Beca Nacional No. -

Glossary of Bromeliaceae Terms Based on Information from Many Botanical Sources
Glossary of Bromeliaceae terms based on information from many Botanical sources. by Derek Butcher August 2016. If you come across a botanical term that you are not sure of, please contact me. I might not know the answer but can try to find out and add it the list A a-, an-: Without. a, ab: away from abaxial: Situated out of, or directed away from, the axis. eg. the underside of a leaf aberrant: Unusual or exceptional; a plant or structure that varies from the type: mostly used with regard to variation. abortive: Defective; barren; not developed. about: circa, circum, circiter, fere, quasi. abr-: Delicate (abrophyllum = delicate-leaved). abscissus; cut off acantha: Referring to a thorn, spines (e.g., Acanthostachys pitcairnioides). acaulescent: Stemless, or apparently so (acauline = without a stem). accedens: approaching, resembling acclimatization: A process by which an organism attains tolerance to a changed environment. -aceae: Added to stem of name or synonym of type genus to form name of family. acerose: Pointed or shaped like a needle. -aceus: Resembling; having the nature of; belonging to. Used to form adjectives from nouns. accretus: grown together achyrostachys: Chaff-like spike. acicular: Needle-shaped; like a needle or bristle as some leaves; having sharp points like needles. aciculatus: marked with very fine irregular streaks acidophile: an organism adapted for life under very acid growing conditions acranthus: with flowers actino-: Star-like; radiating from the center; rayed (actinophylla = rayed leaves). actinomorphic: Regular flowers. When individual flower parts are bisected vertically in two or more planes and have similar halves. Not to be used to describe sepals or petals active transport: the controlled movement of substances across biological membranes against an osmotic gradient, a process requiring metabolic energy supplied by the cell involved. -

Bromeliaceae): History of Disjunct Diversification in Three Biodiversity Hotspots of the Neotropics
City University of New York (CUNY) CUNY Academic Works All Dissertations, Theses, and Capstone Projects Dissertations, Theses, and Capstone Projects 9-2015 SYSTEMATICS AND EVOLUTION OF THE Ronnbergia ALLIANCE (BROMELIACEAE): HISTORY OF DISJUNCT DIVERSIFICATION IN THREE BIODIVERSITY HOTSPOTS OF THE NEOTROPICS Julian Andres Aguirre Santoro Graduate Center, City University of New York How does access to this work benefit ou?y Let us know! More information about this work at: https://academicworks.cuny.edu/gc_etds/828 Discover additional works at: https://academicworks.cuny.edu This work is made publicly available by the City University of New York (CUNY). Contact: [email protected] SYSTEMATICS AND EVOLUTION OF THE Ronnbergia ALLIANCE (BROMELIACEAE): HISTORY OF DISJUNCT DIVERSIFICATION IN THREE BIODIVERSITY HOTSPOTS OF THE NEOTROPICS by JULIÁN ANDRÉS AGUIRRE SANTORO A dissertation submitted to the Graduate Faculty in Biology in partial fulfillment of the requirements for the degree of Doctor of Philosophy, The City University of New York 2015 © 2015 JULIAN ANDRES AGUIRRE SANTORO All Rights Reserved ii This manuscript has been read and accepted for the Graduate Faculty in Biology to satisfy the dissertation requirement for the degree of Doctor of Philosophy. Dr. Fabián Michelangeli Date Chair of Examining Committee Dr. Laurel Eckhardt Date Executive Officer Dr. Ana Carolina Carnaval Dr. Wendy Clement Dr. Dwight Kincaid Dr. Dennis W. Stevenson Dr. William Wayt Thomas THE CITY UNIVERSITY OF NEW YORK iii Abstract SYSTEMATICS AND EVOLUTION OF THE Ronnbergia ALLIANCE (BROMELIACEAE): HISTORY OF DISJUNCT DIVERSIFICATION IN THREE BIODIVERSITY HOTSPOTS OF THE NEOTROPICS by Julián Andrés Aguirre Santoro Adviser: Dr. Fabián Michelnageli The systematics, biogeography and evolution of the “Ronnbergia Alliance,” a nested lineage within the Core Bromelioideae, were investigated. -

BROMELIACEAE) PARA COLOMBIA Synopsis of Aechmea (Bromeliaceae) for Colombia
www.unal.edu.co/icn/publicaciones/caldasia.htm CaldasiaAguirre-S. 30(2):265-288. & Betancur 2008 SINOPSIS DEL GÉNERO AECHMEA (BROMELIACEAE) PARA COLOMBIA Synopsis of Aechmea (Bromeliaceae) for Colombia JULIAN AGUIRRE-SANTORO Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Apartado 7495, Bogotá D. C., Colombia. Programa de Pós-Graduação em Ciências Biológicas (Botânica), Museu Nacional/Universidade Federal do Rio de Janeiro, Rio de Janeiro. [email protected] JULIO BETANCUR Instituto de Ciencias Naturales, Universidad Nacional de Colombia, Apartado 7495, Bogotá D. C., Colombia. [email protected] RESUMEN Se presenta la sinopsis de Aechmea (Bromeliaceae: Bromelioideae) para Colombia, la cual incluye la descripción del género, una clave para la identificación de las especies y la lista anotada de las mismas. Además, para cada especie se incluyen comentarios sobre el hábito de crecimiento, la categoría de amenaza y la distribución geográfica y altitudinal. Se registran 44 especies de Aechmea para Colombia, de las cuales nueve son endémicas: A. anomala, A. nivea, A. stenosepala, A. subpetiolata y cinco especies nuevas para la ciencia. La mayor parte de las especies prefieren los bosques húmedos de tierras bajas, concentrándose en las regiones amazónica (58%) y andina (51%), particularmente en las subregiones llanura Amazónica (51%), las vertientes magdalenense (33%) y oriental andina (30%) y las serranías de las formaciones del Escudo Guayanés (30%). Por otra parte, las especies se distribuyen desde el nivel del mar hasta 2400 m de altitud, pero la mayor riqueza se encontró por debajo de 800 m. Palabras clave. Aechmea, Bromeliaceae, Bromelioideae, Colombia, Plantas neotropicales. ABSTRACT A synopsis of Aechmea (Bromeliaceae: Bromelioideae) for Colombia is presented, including the genus description, an artificial identification key and an annotated list of the species.