The Orphan 7TM Protein GPR50 As a Novel Regulator of TGF Signal
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

The G Protein-Coupled Receptor Subset of the Dog Genome Is More Similar
BMC Genomics BioMed Central Research article Open Access The G protein-coupled receptor subset of the dog genome is more similar to that in humans than rodents Tatjana Haitina1, Robert Fredriksson1, Steven M Foord2, Helgi B Schiöth*1 and David E Gloriam*2 Address: 1Department of Neuroscience, Functional Pharmacology, Uppsala University, BMC, Box 593, 751 24, Uppsala, Sweden and 2GlaxoSmithKline Pharmaceuticals, New Frontiers Science Park, 3rd Avenue, Harlow CM19 5AW, UK Email: Tatjana Haitina - [email protected]; Robert Fredriksson - [email protected]; Steven M Foord - [email protected]; Helgi B Schiöth* - [email protected]; David E Gloriam* - [email protected] * Corresponding authors Published: 15 January 2009 Received: 20 August 2008 Accepted: 15 January 2009 BMC Genomics 2009, 10:24 doi:10.1186/1471-2164-10-24 This article is available from: http://www.biomedcentral.com/1471-2164/10/24 © 2009 Haitina et al; licensee BioMed Central Ltd. This is an Open Access article distributed under the terms of the Creative Commons Attribution License (http://creativecommons.org/licenses/by/2.0), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited. Abstract Background: The dog is an important model organism and it is considered to be closer to humans than rodents regarding metabolism and responses to drugs. The close relationship between humans and dogs over many centuries has lead to the diversity of the canine species, important genetic discoveries and an appreciation of the effects of old age in another species. The superfamily of G protein-coupled receptors (GPCRs) is one of the largest gene families in most mammals and the most exploited in terms of drug discovery. -

Hecate-Cgb Conjugate and Gonadotropin Suppression Shows Two Distinct Mechanisms of Action in the Treatment of Adrenocortical
Endocrine-Related Cancer (2009) 16 549–564 Hecate-CGb conjugate and gonadotropin suppression shows two distinct mechanisms of action in the treatment of adrenocortical tumors in transgenic mice expressing Simian Virus 40 T antigen under inhibin-a promoter Susanna Vuorenoja1,2, Bidut Prava Mohanty1, Johanna Arola3, Ilpo Huhtaniemi1,4, Jorma Toppari1,2 and Nafis A Rahman1 Departments of 1Physiology and 2Pediatrics, University of Turku, Kiinamyllynkatu 10, FIN-20520 Turku, Finland 3Department of Pathology, University of Helsinki and HUSLAB, Helsinki, Finland 4Institute of Reproductive and Developmental Biology, Imperial College, London, UK (Correspondence should be addressed to N A Rahman; Email: nafis.rahman@utu.fi) Abstract Lytic peptide Hecate (23-amino acid (AA)) fused with a 15-AA fragment of human chorionic gonadotropin-b (CG-b), Hecate-CGb conjugate (H-CGb-c) selectively binds to and destroys tumor cells expressing LH/chorionic gonadotropin receptor (Lhcgr). Transgenic mice (6.5 month old) expressing SV40 T-antigen under the inhibin-a promoter (inha/Tag) presenting with Lhcgr expressing adrenal tumors were treated either with H-CGb-c, GnRH antagonist (GnRH-a), estradiol (E2; only females) or their combinations for 1 month. We expected that GnRH-a or E2 in combination with H-CGb-c could improve the treatment efficacy especially in females by decreasing circulating LH and eliminating the potential competition of serum LH with the H-CGb-c. GnRH-a and H-CGb-c treatments were successful in males (adrenal weights 14G2.8 mg and 60G26 vs 237G59 mg in controls; P!0.05). Histopathologically, GnRH-a apparently destroyed the adrenal parenchyma leaving only the fibrotic capsule with few necrotic foci. -

REVIEW Dimerization and Oligomerization of G-Protein-Coupled Receptors
435 REVIEW Dimerization and oligomerization of G-protein-coupled receptors: debated structures with established and emerging functions La´szlo´ Szidonya1, Miklo´s Cserzo˝ 1 and La´szlo´ Hunyady1,2 1Department of Physiology, Semmelweis University, PO Box 259, H-1444 Budapest, Hungary 2Laboratory for Neurobiochemistry and Molecular Physiology, Hungarian Academy of Sciences and Semmelweis University, H-1444 Budapest, Hungary (Correspondence should be addressed to L Hunyady; Email: [email protected]) Abstract Dimerization or oligomerization of G-protein-coupled homo- or heterodimeric or oligomeric complexes, in which receptors (GPCRs) is a novel concept, which may lead to receptor monomers have stable direct interactions. However, the reevaluation of the actions of pharmacological ligands, overwhelming amounts of data suggest that many GPCRs hormones, neurotransmitters, and other mediators acting on exhibit functional properties that require direct or indirect GPCRs. Although a large number of data obtained using interactions between clustered receptors. Although it is different biophysical, biochemical and structural methods, difficult to conclude, about the exact nature of these and functional approaches argue for dimerization or interactions, dimerization or oligomerization of GPCRs is a oligomerization of these receptors, several publications useful paradigm for pharmacologists to study properties of criticized the applied methods and challenged the concept. receptors, which require functionally important clustering of The aim of this paper is to review the data that support the receptors, such as trafficking of newly synthesized receptors to concept of receptor oligomerization, and the most important the cell surface, allosteric modulation of ligand binding, arguments against it. We conclude that it will require major signaling specificity, co-internalization, or cross-inhibition of methodical improvements to obtain decisive proof, whether GPCRs. -

Genetic Basis of Idiopathic Scoliosis
Research & Review: Management of Cardiovascular and Orthopedic Complications Volume 1 Issue 1 Genetic Basis of Idiopathic Scoliosis S. Sreeremya Assistant Professor, Department of Biotechnology, Sree Narayana Guru College, Coimbatore, Tamil Nadu, India Email: [email protected] Abstract Idiopathic scoliosis (IS), the most usual spinal deformity, affects otherwise healthy children and adolescents during growth. The etiology is still not quiet understood, although genetic factors are believed to be important. This review corroborates the understanding of IS as a complex disease with a polygenic background. Presumably IS can be typically due to a spectrum of genetic risk variants, ranging from very rare or even private to very common. The most promising candidate genes are highlighted. Keywords: Idiopathic scoliosis, Genetics, Pathogenesis, Heredity INTRODUCTION marked by phenotypic complexity Idiopathic scoliosis (IS), the most general (variations in curve morphology and form of spinal deformity, affects otherwise magnitude, age of onset, rate of healthy children and adolescents during progression), and a prognosis mainly growth (Fig: 1). It usually presents as a rib ranging from increase in curve magnitude, hump visible at forward bending, together to stabilization, or to resolution with with unlevelled shoulders and an growth [5]. Genetic factors are known to asymmetrical waist [1]. According to play a pivotal role, as observed in twin Cobb, the diagnosis is specifically studies and their observation and singleton confirmed by a standing spinal radiograph multigenerational families [6]. A recent showing a lateral curvature of the spine research of monozygotic and dizygotic exceeding 10° [2]. A main concern in IS is twins from the Swedish twin registry the absence of reliable means by which to estimated that overall genetic effects predict risk of progression, leading to accounted for 39 % of the observed frequent follow-ups, radiographs, and phenotypic variance, leaving the remaining potentially unnecessary brace treatments. -

Edinburgh Research Explorer
Edinburgh Research Explorer International Union of Basic and Clinical Pharmacology. LXXXVIII. G protein-coupled receptor list Citation for published version: Davenport, AP, Alexander, SPH, Sharman, JL, Pawson, AJ, Benson, HE, Monaghan, AE, Liew, WC, Mpamhanga, CP, Bonner, TI, Neubig, RR, Pin, JP, Spedding, M & Harmar, AJ 2013, 'International Union of Basic and Clinical Pharmacology. LXXXVIII. G protein-coupled receptor list: recommendations for new pairings with cognate ligands', Pharmacological reviews, vol. 65, no. 3, pp. 967-86. https://doi.org/10.1124/pr.112.007179 Digital Object Identifier (DOI): 10.1124/pr.112.007179 Link: Link to publication record in Edinburgh Research Explorer Document Version: Publisher's PDF, also known as Version of record Published In: Pharmacological reviews Publisher Rights Statement: U.S. Government work not protected by U.S. copyright General rights Copyright for the publications made accessible via the Edinburgh Research Explorer is retained by the author(s) and / or other copyright owners and it is a condition of accessing these publications that users recognise and abide by the legal requirements associated with these rights. Take down policy The University of Edinburgh has made every reasonable effort to ensure that Edinburgh Research Explorer content complies with UK legislation. If you believe that the public display of this file breaches copyright please contact [email protected] providing details, and we will remove access to the work immediately and investigate your claim. Download date: 02. Oct. 2021 1521-0081/65/3/967–986$25.00 http://dx.doi.org/10.1124/pr.112.007179 PHARMACOLOGICAL REVIEWS Pharmacol Rev 65:967–986, July 2013 U.S. -

The Neuroprotective Effects of Melatonin: Possible Role in the Pathophysiology of Neuropsychiatric Disease
brain sciences Perspective The Neuroprotective Effects of Melatonin: Possible Role in the Pathophysiology of Neuropsychiatric Disease Jung Goo Lee 1,2 , Young Sup Woo 3, Sung Woo Park 2,4, Dae-Hyun Seog 5, Mi Kyoung Seo 6 and Won-Myong Bahk 3,* 1 Department of Psychiatry, College of Medicine, Haeundae Paik Hospital, Inje University, Busan 47392, Korea; [email protected] 2 Paik Institute for Clinical Research, Department of Health Science and Technology, Graduate School, Inje University, Busan 47392, Korea; [email protected] 3 Department of Psychiatry, College of Medicine, The Catholic University of Korea, Seoul 07345, Korea; [email protected] 4 Department of Convergence Biomedical Science, College of Medicine, Inje University, Busan 47392, Korea 5 Department of Biochemistry, College of Medicine, Inje University, Busan 47392, Korea; [email protected] 6 Paik Institute for Clinical Research, Inje University, Busan 47392, Korea; [email protected] * Correspondence: [email protected] Received: 16 September 2019; Accepted: 19 October 2019; Published: 21 October 2019 Abstract: Melatonin is a hormone that is secreted by the pineal gland. To date, melatonin is known to regulate the sleep cycle by controlling the circadian rhythm. However, recent advances in neuroscience and molecular biology have led to the discovery of new actions and effects of melatonin. In recent studies, melatonin was shown to have antioxidant activity and, possibly, to affect the development of Alzheimer’s disease (AD). In addition, melatonin has neuroprotective effects and affects neuroplasticity, thus indicating potential antidepressant properties. In the present review, the new functions of melatonin are summarized and a therapeutic target for the development of new drugs based on the mechanism of action of melatonin is proposed. -

The Roles Played by Highly Truncated Splice Variants of G Protein-Coupled Receptors Helen Wise
Wise Journal of Molecular Signaling 2012, 7:13 http://www.jmolecularsignaling.com/content/7/1/13 REVIEW Open Access The roles played by highly truncated splice variants of G protein-coupled receptors Helen Wise Abstract Alternative splicing of G protein-coupled receptor (GPCR) genes greatly increases the total number of receptor isoforms which may be expressed in a cell-dependent and time-dependent manner. This increased diversity of cell signaling options caused by the generation of splice variants is further enhanced by receptor dimerization. When alternative splicing generates highly truncated GPCRs with less than seven transmembrane (TM) domains, the predominant effect in vitro is that of a dominant-negative mutation associated with the retention of the wild-type receptor in the endoplasmic reticulum (ER). For constitutively active (agonist-independent) GPCRs, their attenuated expression on the cell surface, and consequent decreased basal activity due to the dominant-negative effect of truncated splice variants, has pathological consequences. Truncated splice variants may conversely offer protection from disease when expression of co-receptors for binding of infectious agents to cells is attenuated due to ER retention of the wild-type co-receptor. In this review, we will see that GPCRs retained in the ER can still be functionally active but also that highly truncated GPCRs may also be functionally active. Although rare, some truncated splice variants still bind ligand and activate cell signaling responses. More importantly, by forming heterodimers with full-length GPCRs, some truncated splice variants also provide opportunities to generate receptor complexes with unique pharmacological properties. So, instead of assuming that highly truncated GPCRs are associated with faulty transcription processes, it is time to reassess their potential benefit to the host organism. -

Determination of Biological Activity of Gonadotropins Hcg and FSH By
www.nature.com/scientificreports OPEN Determination of biological activity of gonadotropins hCG and FSH by Förster resonance energy transfer Received: 14 October 2016 Accepted: 06 January 2017 based biosensors Published: 09 February 2017 Olga Mazina1,2, Anni Allikalt1, Juha S. Tapanainen3, Andres Salumets2,3,4,5 & Ago Rinken1 Determination of biological activity of gonadotropin hormones is essential in reproductive medicine and pharmaceutical manufacturing of the hormonal preparations. The aim of the study was to adopt a G-protein coupled receptor (GPCR)-mediated signal transduction pathway based assay for quantification of biological activity of gonadotropins. We focussed on studying human chorionic gonadotropin (hCG) and follicle-stimulating hormone (FSH), as these hormones are widely used in clinical practice. Receptor-specific changes in cellular cyclic adenosine monophosphate (cAMP, second messenger in GPCR signalling) were monitored by a Förster resonance energy transfer (FRET) biosensor protein TEpacVV in living cells upon activation of the relevant gonadotropin receptor. The BacMam gene delivery system was used for biosensor protein expression in target cells. In the developed assay only biologically active hormones initiated GPCR-mediated cellular signalling. High assay sensitivities were achieved for detection of hCG (limit of detection, LOD: 5 pM) and FSH (LOD: 100 pM). Even the small- scale conformational changes caused by thermal inactivation and reducing the biological activity of the hormones were registered. In conclusion, the proposed assay is suitable for quantification of biological activity of gonadotropins and is a good alternative to antibody- and animal-testing-based assays used in pharmaceutical industry and clinical research. Gonadotropin medications are widely used in controlled ovarian stimulation and induction of ovulation as key components of infertility treatment. -

Luteinizing Hormonereleasing Hormone (LHRH) Receptor Agonists Vs Antagonists
Review Luteinizing hormone-releasing hormone (LHRH) receptor agonists vs antagonists: a matter of the receptors? Yuri Tolkach, Steven Joniau* and Hendrik Van Poppel* Urology Clinic, Military Medical Academy, Saint-Petersburg, Russia, and *Department of Urology, University Hospital Gasthuisberg, Katholieke Universiteit Leuven, Leuven, Belgium Luteinizing hormone-releasing hormone (LHRH) agonists and antagonists are commonly used androgen deprivation therapies prescribed for patients with advanced prostate cancer (PCa). Both types of agent target the receptor for LHRH but differ in their mode of action: agonists, via pituitary LRHR receptors (LHRH-Rs), cause an initial surge in luteinizing hormone (LH), follicle-stimulating hormone (FSH) and, subsequently, testosterone. Continued overstimulation of LHRH-R down-regulates the production of LH and leads to castrate levels of testosterone. LHRH antagonists, however, block LHRH-R signalling causing a rapid and sustained inhibition of testosterone, LH and FSH. The discovery and validation of the presence of functional LHRH-R in the prostate has led to much work investigating the role of LHRH signalling in the normal prostate as well as in the treatment of PCa with LHRH agonists and antagonists. In this review we discuss the expression and function of LHRH-R, as well as LH/human chorionic gonadotropin receptors and FSH receptors and relate this to the differential clinical responses to agonists and antagonists used in the hormonal manipulation of PCa. Keywords androgen deprivation therapy, LHRH agonist, GnRH antagonist, LHRH receptor, prostate cancer Introduction the last 30 years. LHRH agonists, by continually stimulating The most common type of treatment prescribed for the LHRH-R, down-regulate receptor expression in the patients with advanced prostate cancer (PCa) is LHRH pituitary leading to decreased levels of LH, and to a lesser agonists and these are increasingly being used in patients extent, FSH. -
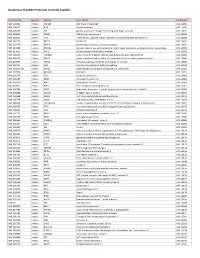
Quantigene Flowrna Probe Sets Currently Available
QuantiGene FlowRNA Probe Sets Currently Available Accession No. Species Symbol Gene Name Catalog No. NM_003452 Human ZNF189 zinc finger protein 189 VA1-10009 NM_000057 Human BLM Bloom syndrome VA1-10010 NM_005269 Human GLI glioma-associated oncogene homolog (zinc finger protein) VA1-10011 NM_002614 Human PDZK1 PDZ domain containing 1 VA1-10015 NM_003225 Human TFF1 Trefoil factor 1 (breast cancer, estrogen-inducible sequence expressed in) VA1-10016 NM_002276 Human KRT19 keratin 19 VA1-10022 NM_002659 Human PLAUR plasminogen activator, urokinase receptor VA1-10025 NM_017669 Human ERCC6L excision repair cross-complementing rodent repair deficiency, complementation group 6-like VA1-10029 NM_017699 Human SIDT1 SID1 transmembrane family, member 1 VA1-10032 NM_000077 Human CDKN2A cyclin-dependent kinase inhibitor 2A (melanoma, p16, inhibits CDK4) VA1-10040 NM_003150 Human STAT3 signal transducer and activator of transcripton 3 (acute-phase response factor) VA1-10046 NM_004707 Human ATG12 ATG12 autophagy related 12 homolog (S. cerevisiae) VA1-10047 NM_000737 Human CGB chorionic gonadotropin, beta polypeptide VA1-10048 NM_001017420 Human ESCO2 establishment of cohesion 1 homolog 2 (S. cerevisiae) VA1-10050 NM_197978 Human HEMGN hemogen VA1-10051 NM_001738 Human CA1 Carbonic anhydrase I VA1-10052 NM_000184 Human HBG2 Hemoglobin, gamma G VA1-10053 NM_005330 Human HBE1 Hemoglobin, epsilon 1 VA1-10054 NR_003367 Human PVT1 Pvt1 oncogene homolog (mouse) VA1-10061 NM_000454 Human SOD1 Superoxide dismutase 1, soluble (amyotrophic lateral sclerosis 1 (adult)) -

Thyrotropin-Luteinizing Hormone/Chorionic Gonadotropin
Proc. Natl. Acad. Sci. USA Vol. 88, pp. 902-905, February 1991 Medical Sciences Thyrotropin-luteinizing hormone/chorionic gonadotropin receptor extracellular domain chimeras as probes for thyrotropin receptor function (hormone binding/signal transduction) Yuji NAGAYAMA, HARRY L. WADSWORTH, GREGORIO D. CHAZENBALK, DIEGO Russo, Pui SETO, AND BASIL RAPOPORT Thyroid Molecular Biology Unit, Veterans Administration Medical Center, San Francisco, CA 94121; and the University of California, San Francisco, CA 94143-0534 Communicated by William J. Rutter, November 2, 1990 ABSTRACT To define the sites in the extracellular domain site(s) involved in ligand binding or the region(s) important in of the human thyrotropin (TSH) receptor that are involved in signal transduction. TSH binding and signal transduction we constructed chimeric Recent studies indicate that ligand- and antibody-binding thyrotropin-luteinizing hormone/chorionic gonadotropin sites in folded globular proteins are conformational and may (TSH-LH/CG) receptors. The extracellular domain of the consist of discontinuous regions of the linear amino acid human TSH receptor was divided into five regions that were sequence (13-17). In studies defining ligand-binding sites in replaced, either singly or in various combinations, with ho- native proteins it is therefore important to conserve the mologous regions of the rat LH/CG receptor. The chimeric three-dimensional structure of the protein. The considerable receptors were stably expressed in Chinese hamster ovary cells. (30-50%) homology in the extracellular domains of the gly- The data obtained suggest that the carboxyl region of the coprotein hormone receptors together with the presence of 10 extracellular domain (amino acid residues 261418) and par- conserved extracellular cysteine residues [some ofwhich are ticularly the middle region (residues 171-260) play a role in thought to form disulfide bonds (12)] suggest a similar three- signal transduction. -

Synaptamide Activates the Adhesion GPCR GPR110 (ADGRF1) Through GAIN Domain Binding
ARTICLE https://doi.org/10.1038/s42003-020-0831-6 OPEN Synaptamide activates the adhesion GPCR GPR110 (ADGRF1) through GAIN domain binding Bill X. Huang1, Xin Hu2, Heung-Sun Kwon1, Cheng Fu1, Ji-Won Lee1, Noel Southall2, Juan Marugan2 & ✉ Hee-Yong Kim1 1234567890():,; Adhesion G protein-coupled receptors (aGPCR) are characterized by a large extracellular region containing a conserved GPCR-autoproteolysis-inducing (GAIN) domain. Despite their relevance to several disease conditions, we do not understand the molecular mechanism by which aGPCRs are physiologically activated. GPR110 (ADGRF1) was recently deorphanized as the functional receptor of N-docosahexaenoylethanolamine (synaptamide), a potent synap- togenic metabolite of docosahexaenoic acid. Thus far, synaptamide is the first and only small- molecule endogenous ligand of an aGPCR. Here, we demonstrate the molecular basis of synaptamide-induced activation of GPR110 in living cells. Using in-cell chemical cross-linking/ mass spectrometry, computational modeling and mutagenesis-assisted functional assays, we discover that synaptamide specifically binds to the interface of GPR110 GAIN subdomains through interactions with residues Q511, N512 and Y513, causing an intracellular conforma- tional change near TM6 that triggers downstream signaling. This ligand-induced GAIN-tar- geted activation mechanism provides a framework for understanding the physiological function of aGPCRs and therapeutic targeting in the GAIN domain. 1 Laboratory of Molecular Signaling, National Institute on Alcohol Abuse