Diss Corrigida Camila
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Siluriformes: Callichthyidae) in the Subterranean Domain of Northern and Northeastern Brazil
13 4 297 Tencatt et al NOTES ON GEOGRAPHIC DISTRIBUTION Check List 13 (4): 297–303 https://doi.org/10.15560/13.4.297 First report of armored catfishes Callichthyinae Bonaparte, 1838 (Siluriformes: Callichthyidae) in the subterranean domain of northern and northeastern Brazil Luiz Fernando Caserta Tencatt,1 Bruno Ferreira dos Santos,2 Maria Elina Bichuette3 1 Universidade Estadual de Maringá, Coleção Ictiológica do Núcleo de Pesquisas em Limnologia, Ictiologia e Aquicultura e Programa de Pós- Graduação em Ecologia de Ambientes Aquáticos Continentais, Av. Colombo, 5790, 87020-900 Maringá, Paraná, Brazil. 2 Universidade Federal de Mato Grosso do Sul, Programa de Pós-Graduação em Biologia Animal, Av. Costa e Silva, 79070-900 Campo Grande, Mato Grosso do Sul, Brazil. 3 Universidade Federal de São Carlos, Departamento de Ecologia e Biologia Evolutiva, Laboratório de Estudos Subterrâneos, Rodovia Washington Luis, km 235, 13565-905 São Carlos, São Paulo, Brazil. Corresponding author: Luiz Fernando Caserta Tencatt, [email protected] Abstract The first occurrence of the armored catfishes of the subfamily Callichthynae is reported in subterranean water bodies of northern and northeastern Brazil. The records include 3 species, each occurring in 1 of the 3 caves in the central and northeastern regions of Brazil: Callichthys callichthys from Casa do Caboclo cave, Sergipe state; Hoplosternum lit- torale from the Gruna da Lagoa do Meio, Bahia state; and Megalechis thoracata, from Casa de Pedra cave, Tocantins state. Keywords Camboatá, cave, hypogean habitat, karstic areas, Neotropical region. Academic editor: Bárbara Calegari | Received 2 March 2017 | Accepted 10 June 2017 | Published 14 August 2017 Citation: Tencatt LFC, Ferreira dos Santos B, Bichuette ME (2017) First report of armored catfishes Callichthyinae( Bonaparte, 1838) (Siluriformes: Callichthyidae) in the subterranean domain. -
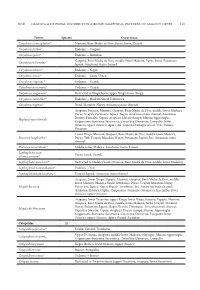
DAGOSTA & DE PINNA: DISTRIBUTION & BIOGEOGRAPHICAL PATTERNS of AMAZON FISHES Taxon Species Occurrence Corydoras Stenocep
2019 DAGOSTA & DE PINNA: DISTRIBUTION & BIOGEOGRAPHICAL PATTERNS OF AMAZON FISHES 113 Taxon Species Occurrence Corydoras stenocephalus* Mamoré, Beni-Madre de Dios, Purus, Juruá, Ucayali Corydoras sterbai* Endemic – Guaporé Corydoras sychri* Endemic – Marañon Guaporé, Beni-Madre de Dios, middle-lower Madeira, Purus, Juruá, Putumayo, Corydoras trilineatus* Japurá, Amazonas main channel Corydoras tukano* Endemic – Negro Corydoras urucu* Endemic – Coari-Urucu Corydoras virginiae* Endemic – Ucayali Corydoras weitzmani* Endemic – Ucayali Corydoras xinguensis* Restricted to Xingu basin (upper Xingu, lower Xingu) Corydoras zawadzkii* Endemic – Madeira Shield Tributaries Corydoras zygatus* Juruá, Marañon-Nanay, Amazonas main channel Araguaia, Juruena, Mamoré, Guaporé, Beni-Madre de Dios, middle-lower Madeira, Purus, Ucayali, Putumayo, Japurá, Negro, Amazonas main channel, Amazonas Estuary, Parnaíba, Capim, Araguari-Macari-Amapá, Maroni-Approuague, Hoplosternum littorale Coppename-Suriname-Saramacca, Corentyne-Demerara, Essequibo, lower Orinoco, upper Orinoco, Apure, Atl. Coastal Drainages of Col. Ven., Paraná- Paraguay Lower Xingu, Mamoré, Guaporé, Beni-Madre de Dios, middle-lower Madeira, Dianema longibarbis* Purus, Tefé, Ucayali, Marañon-Nanay, Putumayo, Japurá, Jari, Amazonas main channel Dianema urostriatum* Middle-lower Madeira, Amazonas main channel Lepthoplosternum Purus, Juruá, Ucayali altamazonicum* Lepthoplosternum beni* Restricted to Madeira basin (Mamoré, Beni-Madre de Dios, middle-lower Madeira) Lepthoplosternum stellatum* Endemic -

Check List 5(3): 673–691, 2009
Check List 5(3): 673–691, 2009. ISSN: 1809-127X LISTS OF SPECIES Fishes from the upper Yuruá river, Amazon basin, Peru Tiago P. Carvalho 1 S. June Tang 1 Julia I. Fredieu 1 Roberto Quispe 2 Isabel Corahua 2 Hernan Ortega 2 1 James S. Albert 1 University of Louisiana at Lafayette, Department of Biology. Lafayette, LA 70504, USA. E-mail: [email protected] 2 Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos. Av. Arenales 1256, Lima 11, Peru. Abstract We report results of an ichthyological survey of the upper Rio Yuruá in southeastern Peru. Collections were made at low water (July-August, 2008) near the headwaters of the Brazilian Rio Juruá. This is the first of four expeditions to the Fitzcarrald Arch - an upland associated with the Miocene-Pliocene rise of the Peruvian Andes - with the goal of comparing the ichthyofauna across the headwaters of the largest tributary basins in the western Amazon (Ucayali, Juruá, Purús and Madeira). We recorded a total of 117 species in 28 families and 10 orders, with all species accompanied by tissue samples preserved in 100% ethanol for subsequent DNA analysis, and high-resolution digital images of voucher specimens with live color to facilitate accurate identification. From interviews with local fishers and comparisons with other ichthyological surveys of the region we estimate the actual diversity of fishes in the upper Juruá to exceed 200 species. Introduction The Yuruá river rises in the department of Ucayali The freshwater f sh fauna of tropical South in Peru and runs into Brazilian territory, where it America is among the richest vertebrate faunas is known as Juruá river. -

Dwarf Hoplo (Lepthoplosternum Pectorale) Ecological Risk Screening Summary
Dwarf Hoplo (Lepthoplosternum pectorale) Ecological Risk Screening Summary U.S. Fish and Wildlife Service, July 2017 Revised, January 2018 Web Version, 5/16/2018 1 Native Range and Status in the United States Native Range From Froese and Pauly (2017): “South America: Paraguay River basin. [The basin includes the countries of Argentina, Brazil, Bolivia, Paraguay and Uruguay]” From Zarucki et al. (2010): “We report the presence of Leporinus lacustris, Lepthoplosternum pectorale, and Apistogramma borellii registered from the middle Paraná River (Casciotta et al. 2005) in the middle and lower Uruguay River [in Uruguay].” Status in the United States This catfish species has not been reported in the United States. There is no indication that this species is in trade in the U.S. 1 Means of Introductions in the United States Lepthoplosternum pectorale has not been reported as introduced in the United States. Remarks From ScotCat (2005): “One look at the photograph of this species and you will realise that this [i.e., Lepthoplosternum pectorale] is, or used to be, Hoplosternum pectorale. The above has been moved into a new genus along with Hoplosternum thoracatum ( now Megalechis thoracata) with Hoplosternum littorale staying put. The Brazilian ichthyologist Roberto E.Reis [sic] completely revised this family in 1996 and erected a new genus for pectorale.” 2 Biology and Ecology Taxonomic Hierarchy and Taxonomic Standing From ITIS (2017): “Kingdom Animalia Subkingdom Bilateria Infrakingdom Deuterostomia Phylum Chordata Subphylum Vertebrata Infraphylum -

Comparison of Fish Assemblages in Flooded Forest Versus Floating Meadows Habitats of an Upper Amazon Floodplain (Pacaya Samiria National Reserve, Peru)
COMPARISON OF FISH ASSEMBLAGES IN FLOODED FOREST VERSUS FLOATING MEADOWS HABITATS OF AN UPPER AMAZON FLOODPLAIN (PACAYA SAMIRIA NATIONAL RESERVE, PERU) By SANDRA BIBIANA CORREA A THESIS PRESENTED TO THE GRADUATE SCHOOL OF THE UNIVERSITY OF FLORIDA IN PARTIAL FULFILLMENT OF THE REQUIREMENTS FOR THE DEGREE OF MASTER OF SCIENCE UNIVERSITY OF FLORIDA 2005 Copyright 2005 by Sandra Bibiana Correa To my parents and my family. During the course of my life their love and belief in my potential encouraged me to keep going and achieve my dreams. They supported me in all of my decisions even when they separated us for long periods of time. I also dedicate this thesis to Michael Goulding who inspired me to study Amazonian fishes and who is a pioneer in showing their beauty and fragility to the world. ACKNOWLEDGMENTS This thesis would not have been possible without the support and commitment of my supervisory committee chair (Dr. James S. Albert) and my committee members (Dr. Lauren J. Chapman and Dr. William G.R. Crampton). All of them put lots of energy and time into the development of different aspects of this work. I thank James and Will for the outstanding time we spent in Peru during the field work that was the basis for this thesis. They were also crucial during the writing stage, and I enjoyed great discussions on Amazonian fish natural history and ecology. Lauren was my main support during the data analysis process. Without her, many of the results presented in this thesis may not have come out. I also want to thank my field assistant; B.Sc. -

Influence of Environmental Features at Multiple Scales and Spatial Structure on Stream Fish Communities in a Tropical Agricultural Region
Journal of Freshwater Ecology ISSN: 0270-5060 (Print) 2156-6941 (Online) Journal homepage: https://www.tandfonline.com/loi/tjfe20 Influence of environmental features at multiple scales and spatial structure on stream fish communities in a tropical agricultural region Camilo A. Roa-Fuentes & Lilian Casatti To cite this article: Camilo A. Roa-Fuentes & Lilian Casatti (2017) Influence of environmental features at multiple scales and spatial structure on stream fish communities in a tropical agricultural region, Journal of Freshwater Ecology, 32:1, 281-295, DOI: 10.1080/02705060.2017.1287129 To link to this article: https://doi.org/10.1080/02705060.2017.1287129 © 2017 The Author(s). Published by Informa UK Limited, trading as Taylor & Francis Group Published online: 15 Feb 2017. Submit your article to this journal Article views: 779 View Crossmark data Citing articles: 4 View citing articles Full Terms & Conditions of access and use can be found at https://www.tandfonline.com/action/journalInformation?journalCode=tjfe20 JOURNAL OF FRESHWATER ECOLOGY, 2017 VOL. 32, NO. 1, 281–295 http://dx.doi.org/10.1080/02705060.2017.1287129 ARTICLE Influence of environmental features at multiple scales and spatial structure on stream fish communities in a tropical agricultural region Camilo A. Roa-Fuentes and Lilian Casatti Zoology and Botanic Department, S~ao Paulo State University, S~ao Jose do Rio Preto, Brazil ABSTRACT ARTICLE HISTORY Land cover change for agricultural expansion exerts strong pressures on Received 10 September 2016 tropical streams. We examined the relative contributions of catchment Accepted 20 January 2017 land cover, local environmental features, and spatial patterns on stream KEYWORDS fi n D fi sh communities ( 43). -

Felipe Skóra Neto
UNIVERSIDADE FEDERAL DO PARANÁ FELIPE SKÓRA NETO OBRAS DE INFRAESTRUTURA HIDROLÓGICA E INVASÕES DE PEIXES DE ÁGUA DOCE NA REGIÃO NEOTROPICAL: IMPLICAÇÕES PARA HOMOGENEIZAÇÃO BIÓTICA E HIPÓTESE DE NATURALIZAÇÃO DE DARWIN CURITIBA 2013 FELIPE SKÓRA NETO OBRAS DE INFRAESTRUTURA HIDROLÓGICA E INVASÕES DE PEIXES DE ÁGUA DOCE NA REGIÃO NEOTROPICAL: IMPLICAÇÕES PARA HOMOGENEIZAÇÃO BIÓTICA E HIPÓTESE DE NATURALIZAÇÃO DE DARWIN Dissertação apresentada como requisito parcial à obtenção do grau de Mestre em Ecologia e Conservação, no Curso de Pós- Graduação em Ecologia e Conservação, Setor de Ciências Biológicas, Universidade Federal do Paraná. Orientador: Jean Ricardo Simões Vitule Co-orientador: Vinícius Abilhoa CURITIBA 2013 Dedico este trabalho a todas as pessoas que foram meu suporte, meu refúgio e minha fortaleza ao longo dos períodos da minha vida. Aos meus pais Eugênio e Nilte, por sempre acreditarem no meu sonho de ser cientista e me darem total apoio para seguir uma carreira que poucas pessoas desejam trilhar. Além de todo o suporte intelectual e espiritual e financeiro para chegar até aqui, caminhando pelas próprias pernas. Aos meus avós: Cândida e Felippe, pela doçura e horas de paciência que me acolherem em seus braços durante a minha infância, pelas horas que dispenderem ao ficarem lendo livros comigo e por sempre serem meu refúgio. Você foi cedo demais, queria que estivesse aqui para ver esta conquista e principalmente ver o meu maior prêmio, que é minha filha. Saudades. A minha esposa Carine, que tem em comum a mesma profissão o que permitiu que entendesse as longas horas sentadas a frente de livros e do computador, a sua confiança e carinho nas minhas horas de cansaço, você é meu suporte e meu refúgio. -

Extension of the Distribution of Megalechis Thoracata (Valenciennes, 1840) (Siluriformes, Callichthyidae) to the Basin of the Itapecuru River, Northeastern Brazil
13 4 327 Lima et al NOTES ON GEOGRAPHIC DISTRIBUTION Check List 13 (4): 327–330 https://doi.org/10.15560/13.4.327 Extension of the distribution of Megalechis thoracata (Valenciennes, 1840) (Siluriformes, Callichthyidae) to the basin of the Itapecuru River, northeastern Brazil Renato Corrêia Lima,1 Maria Histelle Sousa do Nascimento,1 José Luís Olivan Birindelli,2 Maria Claudene Barros,1 Elmary da Costa Fraga1 1 Universidade Estadual do Maranhão, Centro de Estudos Superiores de Caxias, Praça Duque de Caxias, s/n, Caxias, MA, Brazil. 2 Universidade Estadual de Londrina, Rodovia Celso Garcia Cid, Pr 445 Km 380, s/n, Campus Universitário, Londrina, PR, Brazil. Corresponding author: Elmary da Costa Fraga, [email protected] Abstract The geographic distribution of Megalechis thoracata is extended to the basin of the Itapecuru River, based on a speci- men collected in the Soledade stream, a tributary of the Itapecuru, located in the Inhamum Municipal Environmental Protection Area in Maranhão, Brazil. Key words Palm swamp; stream; Callichthyinae; Cerrado; Maranhão. Academic editor: Pedro H. Carvalho | Received 6 September 2016 | Accepted 18 July 2017 | Published 18 August 2017 Citation: Lima RC, Nascimento MHS, Birindelli JLO, Barros MC, Fraga EC (2017) Extension of the distribution of Megalechis thoracata (Valenciennes, 1840) (Siluriformes, Callichthyidae) to the basin of the Itapecuru River, northeastern Brazil. Check List 13 (4): 327–330. https://doi. org/10.15560/13.4.327 Introduction fin truncated or with convex distal edge (vs bifurcated or with concave distal edge), and the presence of 2 (vs The catfish species of the family Callichthyidae are char- 1) unbranched rays in the dorsal fin. -

Universidade Estadual Paulista
UNIVERSIDADE ESTADUAL PAULISTA INSTITUTO DE BIOCIÊNCIAS ESTUDIOS CITOGENÉTICOS EN TELEOSTEOS MARINOS Y DULCEACUÍCOLAS DE VENEZUELA Mauro Nirchio T. Botucatu - SP Octubre de 2009 2 UNIVERSIDADE ESTADUAL PAULISTA INSTITUTO DE BIOCIÊNCIAS ESTUDIOS CITOGENÉTICOS EN TELEOSTEOS MARINOS Y DULCEACUÍCOLAS DE VENEZUELA Candidato: Mauro Nirchio T. Orientador: Dr. Claudio de Oliveira Tese apresentada ao Instituto de Biociências da Universidade Estadual Paulista “Júlio de Mesquita Filho”, como parte dos requisitos para obtenção do título de Doutor em Ciências Biológicas - Zoologia. Botucatu - SP Octubre de 2009 3 FICHA CATALOGRÁFICA ELABORADA PELA SEÇÃO TÉCNICA DE AQUISIÇÃO E TRATAMENTO DA INFORMAÇÃO DIVISÃO TÉCNICA DE BIBLIOTECA E DOCUMENTAÇÃO - CAMPUS DE BOTUCATU – UNESP BIBLIOTECÁRIA RESPONSÁVEL: SELMA MARIA DE JESUS Nirchio, T. Mauro. ESTUDOS CITOGENÉTICOS EM TELEÓSTEOS DE VENEZUELA/ Mauro Nirchio T.– Botucatu : [s.n.], 2009. Tese (doutorado) – Universidade Estadual Paulista, Instituto de Biociências de Botucatu 2009. Orientador: Cláudio de Oliveira 1. Peixe de água doce - 2. 1. Peixe de água marinha. 3. Citogenetica 4. Evolución CDD xxx.xx Palavras-chave: Citogenética; Actinopterigii, Evolución 4 AGRADECIMIENTO Esta tesis doctoral representa la consecución de un objetivo que me tracé para mejorar mi formación académica, el cual no hubiese sido posible alcanzar sin la cooperación de todas aquellas personas y organizaciones que han contribuido a que esta meta se haya materializado y a quienes quiero dedicarles estas líneas en señal de agradecimiento. A la UNESP por brindarme la oportunidad de ingresar como estudiante de Postgrado. A la Universidad de Oriente por su respaldo institucional. Al Dr, Claudio Oliveira, orientador de esta Tesis y gran amigo, por su apoyo incondicional, su siempre oportuno consejo, por haber compartido sus conocimientos y por la confianza brindada en todo momento. -

04 Knaack Final Version 3 1.Indd
Zoologische Abhandlungen (Dresden) 56: 449–809–80 49 Beiträge zur Kenntnis der Callichthyidae (Teleostei: Siluriformes). I. Ergänzende Beschreibung von Lepthoplosternum pectorale (BOULENGER, 1895) Teil 1 JOACHIM KNAACK Am Walde 5a, D-16775 Neuglobsow Abstract. Lepthoplosternum pectorale (BOULENGER, 1895), the type species of the genus, is re-described. Biological features were determined for the fi rst time like “condition factor” and “body-mass-index” besides morphological and meristic features. A lectotype is designated. The type-locality „Monté Sociedad“, Paraguay, is localized and specifi ed. Resumen. Se redescribe Lepthoplosternum pectorale (BOULENGER, 1895), la especie tipo del género. Aparte de características morfológicas y morfométricas se determinan por primera vez también datos biológicos como el “factor de condición” y el “índice de masa corporal”. Para facilitar estudios futuros se designa un lectotipo para esta especie. La localidad tipo “Monté Sociedad” en Paraguay es localizada y precisada. Kurzfassung. Es erfolgt eine ergänzende Beschreibung von Lepthoplosternum pectorale (BOU- LENGER, 1895), der Typusart der Gattung. Dabei werden neben morphologischen und morpho- metrischen Merkmalen erstmals auch biologische Parameter wie „Konditionsfaktor“ und „Body- Mass-Index“ ermittelt. Um zukünftige Arbeiten zu erleichtern, erfolgt die Festlegung eines Lectotypus. Der locus typicus „Monté Sociedad“, Paraguay, wird lokalisiert und präzisiert. Key words. Neotropische Region, Callichthyidae, Lepthoplosternum pectorale, Lectotypus-Fest- -

Como Os Fatores Bióticos E Abióticos Influenciam a Distribuição Dos Parasitos De Peixes
Como os fatores bióticos e abióticos influenciam a distribuição dos parasitos de peixes. Item Type Thesis/Dissertation Authors Ribeiro, Thamy Santos Publisher Universidade Estadual de Maringá. Departamento de Biologia. Programa de Pós-Graduação em Ecologia de Ambientes Aquáticos Continentais. Download date 02/10/2021 22:44:40 Link to Item http://hdl.handle.net/1834/10184 UNIVERSIDADE ESTADUAL DE MARINGÁ CENTRO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE BIOLOGIA PROGRAMA DE PÓSGRADUAÇÃO EM ECOLOGIA DE AMBIENTES AQUÁTICOS CONTINENTAIS THAMY SANTOS RIBEIRO Como os fatores bióticos e abióticos influenciam a distribuição dos parasitos de peixes Maringá, PR 2016 THAMY SANTOS RIBEIRO Como os fatores bióticos e abióticos influenciam a distribuição dos parasitos de peixes Tese apresentada ao Programa de Pós graduação em Ecologia de Ambientes Aquáticos Continentais do Departamento de Biologia, Centro de Ciências Biológicas da Universidade Estadual de Maringá, como requisito parcial para obtenção do título de Doutora em Ciências Ambientais. Área de concentração: Ciências Ambientais Orientador: Dr. Ricardo Massato Takemoto Coorientador: Dr. Nicolas Mouquet Maringá, PR 2016 "Dados Internacionais de CatalogaçãonaPublicação (CIP)" (Biblioteca Setorial UEM. Nupélia, Maringá, PR, Brasil) Ribeiro, Thamy Santos, 1987 R484c Como os fatores bióticos e abióticos influenciam a distribuição dos parasitos de peixes / Thamy Santos Ribeiro. Maringá, 2016. 94f. : il. Tese (doutorado em Ecologia de Ambientes Aquáticos Continentais)Universidade Estadual de Maringá, Dep. de Biologia, 2016. Orientador: Dr. Ricardo Massato Takemoto. Coorientador: Dr. Nicolas Mouquet. 1. Parasitismo Interação parasitohospedeiro. 2. Parasitos Interações Peixes de água doce. 3. Diversidade funcional. 4. Parasitos de peixes de água doce Distribuição. I. Universidade Estadual de Maringá. Departamento de Biologia. -

Teleostei: Ostariophysi: Siluriformes)
Neotropical Ichthyology, 5(3):337-350, 2007 Copyright © 2007 Sociedade Brasileira de Ictiologia Comparative analysis of spermiogenesis and sperm ultrastructure in Callich- thyidae (Teleostei: Ostariophysi: Siluriformes) Maria A. Spadella*, Claudio Oliveira**and Irani Quagio-Grassiotto** In Corydoradinae, the presence of spermatids in the lumen of the testicular tubules together with spermatozoa suggests that spermatogenesis is of the semicystic type, whereas in Callichthyinae, sperm production occurs entirely within spermatocysts in the germinal epithelium, characterizing cystic spermatogenesis. Spermiogenesis in Callichthyinae is characterized by an initial lateral development of the flagellum, the presence of nuclear rotation to different degrees, an eccentric or medial formation of a nuclear fossa, formation of a cytoplasmic channel, and presence of centriolar migration, being more similar to type I spermiogenesis. In Corydoradinae, spermiogenesis is characterized by eccentric development of the flagellum, the absence of nuclear rotation, an eccentric nuclear fossa formation, formation of a cytoplasmic channel, and absence of centriolar migration, differing from the types previously described. The process of spermatogenesis and spermiogenesis in Corydoradinae and Callichthyinae revealed unique characters for each of these subfamilies, corroborating the hypotheses that they constitute monophyletic groups. In relation to sperm ultrastructure, the comparative analysis of the callichthyid species shows that the general characteristics found