José Fernando Seabra Babo Screening Molecular De
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Molecular Detection of a Novel Babesia Sp. and Pathogenic Spotted
Infection, Genetics and Evolution 69 (2019) 190–198 Contents lists available at ScienceDirect Infection, Genetics and Evolution journal homepage: www.elsevier.com/locate/meegid Research paper Molecular detection of a novel Babesia sp. and pathogenic spotted fever T group rickettsiae in ticks collected from hedgehogs in Turkey: Haemaphysalis erinacei, a novel candidate vector for the genus Babesia ⁎ Ömer Orkun , Ayşe Çakmak, Serpil Nalbantoğlu, Zafer Karaer Department of Parasitology, Faculty of Veterinary Medicine, Ankara University, Ankara, Turkey ARTICLE INFO ABSTRACT Keywords: In this study, a total of 319 ticks were obtained from hedgehogs (Erinaceus concolor). All ticks were pooled into Erinaceus concolor groups and screened by PCR for tick-borne pathogens (TBPs). PCR and sequence analyses identified the presence Ticks of a novel Babesia sp. in adult Haemaphysalis erinacei. In addition, the presence of natural transovarial trans- Ixodidae mission of this novel Babesia sp. was detected in Ha. erinacei. According to the 18S rRNA (nearly complete) and A novel Babesia sp. partial rRNA locus (ITS-1/5.8S/ITS-2) phylogeny, it was determined that this new species is located within the Rickettsia Babesia sensu stricto clade and is closely related to Babesia spp. found in carnivores. Furthermore, the presence of Turkey three pathogenic spotted fever group (SFG) rickettsiae was determined in 65.8% of the tick pools: Rickettsia sibirica subsp. mongolitimonae in Hyalomma aegyptium (adult), Hyalomma spp. (larvae), Rhipicephalus turanicus (adult), and Ha. erinacei (adult); Rickettsia aeschlimannii in H. aegyptium (adult); Rickettsia slovaca in Hyalomma spp. (larvae and nymphs) and H. aegyptium (adult). To our knowledge, this is the first report of R. -

~.. R---'------ : KASMERA: Vol
~.. r---'-------------- : KASMERA: Vol.. 9, No. 1 4,1981 Zulla. Maracaibo. Venezuela. PROTOZOOS DE VENEZUELA Carlos Diaz Ungrla· Tratamos con este trabajo de ofrecer una puesta al día de los protozoos estudiados en nuestro país. Con ello damos un anticipo de lo que será nuestra próxima obra, en la cual, además de actualizar los problemas taxonómicos, pensamos hacer énfasis en la ultraestructura, cuyo cono cimiento es básico hoy día para manejar los protozoos, comQ animales unicelulares que son. Igualmente tratamos de difundir en nuestro medio la clasificación ac tual, que difiere tanto de la que se sigue estudiando. y por último, tratamos de reunir en un solo trabajo toda la infor mación bibliográfica venezolana, ya que es sabido que nuestros autores se ven precisados a publicar en revistas foráneas, y esto se ha acentuado en los últimos diez (10) años. En nuestro trabajo presentaremos primero la lista alfabética de los protozoos venezolanos, después ofreceremos su clasificación, para terminar por distribuirlos de acuerdo a sus hospedadores . • Profesor de la Facultad de Ciencias Veterinarias de la Universidad del Zulia. Maracaibo-Venezuela. -147 Con la esperanza de que nuestro trabajo sea útil anuestros colegas. En Maracaibo, abril de mil novecientos ochenta. 1 LISTA ALF ABETICA DE LOS PROTOZOOS DE VENEZUELA Babesia (Babesia) bigemina, Smith y Kilbome, 1893. Seflalada en Bos taurus por Zieman (1902). Deutsch. Med. Wochens., 20 y 21. Babesia (Babesia) caballi Nuttall y Stricldand. 1910. En Equus cabal/uso Gallo y Vogelsang (1051). Rev. Med.Vet. y Par~. 10 (1-4); 3. Babesia (Babesia) canis. Piana y Galli Valerio, 1895. En Canis ¡ami/iaris. -

Haemogregariny Parazitující U Želv Rodu Pelusios: Fylogenetické Vztahy, Morfologie a Hostitelská Specifita
Haemogregariny parazitující u želv rodu Pelusios: fylogenetické vztahy, morfologie a hostitelská specifita Diplomová práce Bc. Aneta Maršíková Školitel: MVDr. Jana Kvičerová, Ph.D. Školitel specialista: doc. MVDr. Pavel Široký, Ph.D. České Budějovice 2016 Maršíková A., 2016: Haemogregariny parazitující u želv rodu Pelusios: fylogenetické vztahy, morfologie a hostitelská specifita. [Haemogregarines in Pelusios turtles: phylogenetic relationships, morphology, and host specificity, MSc. Thesis, in Czech] – 68 pp., Faculty of Science, University of South Bohemia, České Budějovice, Czech Republic. Annotation: The study deals with phylogenetic relationships, morphology and host specificity of blood parasites Haemogregarina sp. infecting freswater turtles of the genus Pelusios from Africa. Results of phylogenetic analyses are also used for clarification of phylogenetic relationships between "haemogregarines sensu lato" and genus Haemogregarina. Prohlašuji, že svoji diplomovou práci jsem vypracovala samostatně pouze s použitím pramenů a literatury uvedených v seznamu citované literatury. Prohlašuji, že v souladu s § 47b zákona č. 111/1998 Sb. v platném znění souhlasím se zveřejněním své bakalářské práce, a to v nezkrácené podobě – v úpravě vzniklé vypuštěním vyznačených částí archivovaných Přírodovědeckou fakultou - elektronickou cestou ve veřejně přístupné části databáze STAG provozované Jihočeskou univerzitou v Českých Budějovicích na jejích internetových stránkách, a to se zachováním mého autorského práva k odevzdanému textu této kvalifikační práce. Souhlasím dále s tím, aby toutéž elektronickou cestou byly v souladu s uvedeným ustanovením zákona č. 111/1998 Sb. zveřejněny posudky školitele a oponentů práce i záznam o průběhu a výsledku obhajoby kvalifikační práce. Rovněž souhlasím s porovnáním textu mé kvalifikační práce s databází kvalifikačních prací Theses.cz provozovanou Národním registrem vysokoškolských kvalifikačních prací a systémem na odhalování plagiátů. -

ABSTRACT Gregarine Parasitism in Dragonfly Populations of Central
ABSTRACT Gregarine Parasitism in Dragonfly Populations of Central Texas with an Assessment of Fitness Costs in Erythemis simplicicollis Jason L. Locklin, Ph.D. Mentor: Darrell S. Vodopich, Ph.D. Dragonfly parasites are widespread and frequently include gregarines (Phylum Apicomplexa) in the gut of the host. Gregarines are ubiquitous protozoan parasites that infect arthropods worldwide. More than 1,600 gregarine species have been described, but only a small percentage of invertebrates have been surveyed for these apicomplexan parasites. Some consider gregarines rather harmless, but recent studies suggest otherwise. Odonate-gregarine studies have more commonly involved damselflies, and some have considered gregarines to rarely infect dragonflies. In this study, dragonfly populations were surveyed for gregarines and an assessment of fitness costs was made in a common and widespread host species, Erythemis simplicicollis. Adult dragonfly populations were surveyed weekly at two reservoirs in close proximity to one another and at a flow-through wetland system. Gregarine prevalences and intensities were compared within host populations between genders, among locations, among wing loads, and through time. Host fitness parameters measured included wing load, egg size, clutch size, and total egg count. Of the 37 dragonfly species surveyed, 14 species (38%) hosted gregarines. Thirteen of those species were previously unreported as hosts. Gregarine prevalences ranged from 2% – 52%. Intensities ranged from 1 – 201. Parasites were aggregated among their hosts. Gregarines were found only in individuals exceeding a minimum wing load, indicating that gregarines are likely not transferred from the naiad to adult during emergence. Prevalence and intensity exhibited strong seasonality during both years at one of the reservoirs, but no seasonal trend was detected at the wetland. -

Black-Flies and Leucocytozoon Spp. As Causes of Mortality in Juvenile Great Horned Owls in the Yukon, Canada
Black-flies and Leucocytozoon spp. as Causes of Mortality in Juvenile Great Horned Owls in the Yukon, Canada D. Bruce Hunter1, Christoph Rohner2, and Doug C. Currie3 ABSTRACT.—Black fly feeding and infection with the blood parasite Leucocytozoon spp. caused mortality in juvenile Great Horned Owls (Bubo virginianus) in the Yukon, Canada during 1989-1990. The mortality occurred during a year of food shortage corresponding with the crash in snowshoe hare (Lepus americanus) populations. We postulate that the occurrence of disease was mediated by reduced food availability. Rohner (1994) evaluated the numerical re- black flies identified from Alaska, USA and the sponse of Great Horned Owls (Bubo virginianus) Yukon Territory, Canada, 36 percent are orni- to the snowshoe hare (Lepus americanus) cycle thophilic, 39 percent mammalophilic and 25 from 1988 to 1993 in the Kluane Lake area of percent autogenous (Currie 1997). Numerous southwestern Yukon, Canada. The survival of female black flies were obtained from the car- juvenile owls was very high during 1989 and casses of the juvenile owls, but only 45 of these 1990, both years of abundant hare populations. were sufficiently well preserved for identifica- Survival decreased in 1991, the first year of the tion. They belonged to four taxa as follows: snowshoe hare population decline (Rohner and Helodon (Distosimulium) pleuralis (Malloch), 1; Hunter 1996). Monitoring of nest sites Helodon (Parahelodon) decemarticulatus combined with tracking of individuals by radio- (Twinn), 3; Simulium (Eusimulium) aureum Fries telemetry provided us with carcasses of 28 ju- complex, 3; and Simulium (Eusimulium) venile owls found dead during 1990 and 1991 canonicolum (Dyar and Shannon) complex, 38 (Rohner and Doyle 1992). -

(Apicomplexa: Adeleorina) Haemoparasites
Biological Forum – An International Journal 8(1): 331-337(2016) ISSN No. (Print): 0975-1130 ISSN No. (Online): 2249-3239 Molecular identification of Hepatozoon Miller, 1908 (Apicomplexa: Adeleorina) haemoparasites in Podarcis muralis lizards from northern Italy and detection of conserved motifs in the 18S rRNA gene Simona Panelli, Marianna Bassi and Enrica Capelli Department of Earth and Environmental Sciences, Section of Animal Biology, Laboratory of Immunology and Genetic Analyses and Centre for Health Technologies (CHT)/University of Pavia, Via Taramelli 24, 27100 Pavia, Italy (Corresponding author: Enrica Capelli, [email protected]) (Received 22 March, 2016, Accepted 06 April, 2016) (Published by Research Trend, Website: www.researchtrend.net) ABSTRACT: This study applies a non-invasive molecular test on common wall lizards (Podarcis muralis) collected in Northern Italy in order to i) identify protozoan blood parasites using primers targeting a portion of haemogregarine 18S rRNA; ii) perform a detailed bioinformatic and phylogenetic analysis of amplicons in a context where sequence analyses data are very scarce. Indeed the corresponding phylum (Apicomplexa) remains the poorest-studied animal group in spite of its significance for reptile ecology and evolution. A single genus, i.e., Hepatozoon Miller, 1908 (Apicomplexa: Adeleorina) and an identical infecting genotype were identified in all positive hosts. Bioinformatic analyses identified highly conserved sequence patterns, some of which known to be involved in the host-parasite cross-talk. Phylogenetic analyses evidenced a limited host specificity, in accord with existing data. This paper provides the first Hepatozoon sequence from P. muralis and one of the few insights into the molecular parasitology, sequence analysis and phylogenesis of haemogregarine parasites. -

A New Species of Sarcocystis in the Brain of Two Exotic Birds1
© Masson, Paris, 1979 Annales de Parasitologie (Paris) 1979, t. 54, n° 4, pp. 393-400 A new species of Sarcocystis in the brain of two exotic birds by P. C. C. GARNHAM, A. J. DUGGAN and R. E. SINDEN * Imperial College Field Station, Ashurst Lodge, Ascot, Berkshire and Wellcome Museum of Medical Science, 183 Euston Road, London N.W.1., England. Summary. Sarcocystis kirmsei sp. nov. is described from the brain of two tropical birds, from Thailand and Panama. Its distinction from Frenkelia is considered in some detail. Résumé. Une espèce nouvelle de Sarcocystis dans le cerveau de deux Oiseaux exotiques. Sarcocystis kirmsei est décrit du cerveau de deux Oiseaux tropicaux de Thaïlande et de Panama. Les critères de distinction entre cette espèce et le genre Frenkelia sont discutés en détail. In 1968, Kirmse (pers. comm.) found a curious parasite in sections of the brain of an unidentified bird which he had been given in Panama. He sent unstained sections to one of us (PCCG) and on examination the parasite was thought to belong to the Toxoplasmatea, either to a species of Sarcocystis or of Frenkelia. A brief description of the infection was made by Tadros (1970) in her thesis for the Ph. D. (London). The slenderness of the cystozoites resembled those of Frenkelia, but the prominent spines on the cyst wall were more like those of Sarcocystis. The distri bution of the cystozoites within the cyst is characteristic in that the central portion is practically empty while the outer part consists of numerous pockets of organisms, closely packed together. -
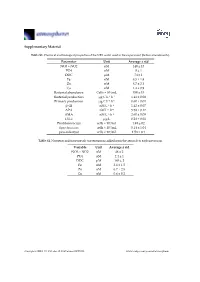
Supplementary Material Parameter Unit Average ± Std NO3 + NO2 Nm
Supplementary Material Table S1. Chemical and biological properties of the NRS water used in the experiment (before amendments). Parameter Unit Average ± std NO3 + NO2 nM 140 ± 13 PO4 nM 8 ± 1 DOC μM 74 ± 1 Fe nM 8.5 ± 1.8 Zn nM 8.7 ± 2.1 Cu nM 1.4 ± 0.9 Bacterial abundance Cells × 104/mL 350 ± 15 Bacterial production μg C L−1 h−1 1.41 ± 0.08 Primary production μg C L−1 h−1 0.60 ± 0.01 β-Gl nM L−1 h−1 1.42 ± 0.07 APA nM L−1 h−1 5.58 ± 0.17 AMA nM L−1·h−1 2.60 ± 0.09 Chl-a μg/L 0.28 ± 0.01 Prochlorococcus cells × 104/mL 1.49 ± 02 Synechococcus cells × 104/mL 5.14 ± 1.04 pico-eukaryot cells × 103/mL 1.58 × 0.1 Table S2. Nutrients and trace metals concentrations added from the aerosols to each mesocosm. Variable Unit Average ± std NO3 + NO2 nM 48 ± 2 PO4 nM 2.4 ± 1 DOC μM 165 ± 2 Fe nM 2.6 ± 1.5 Zn nM 6.7 ± 2.5 Cu nM 0.6 ± 0.2 Atmosphere 2019, 10, 358; doi:10.3390/atmos10070358 www.mdpi.com/journal/atmosphere Atmosphere 2019, 10, 358 2 of 6 Table S3. ANOVA test results between control, ‘UV-treated’ and ‘live-dust’ treatments at 20 h or 44 h, with significantly different values shown in bold. ANOVA df Sum Sq Mean Sq F Value p-value Chl-a 20 H 2, 6 0.03, 0.02 0.02, 0 4.52 0.0634 44 H 2, 6 0.02, 0 0.01, 0 23.13 0.002 Synechococcus Abundance 20 H 2, 7 8.23 × 107, 4.11 × 107 4.11 × 107, 4.51 × 107 0.91 0.4509 44 H 2, 7 5.31 × 108, 6.97 × 107 2.65 × 108, 1.16 × 107 22.84 0.0016 Prochlorococcus Abundance 20 H 2, 8 4.22 × 107, 2.11 × 107 2.11 × 107, 2.71 × 106 7.77 0.0216 44 H 2, 8 9.02 × 107, 1.47 × 107 4.51 × 107, 2.45 × 106 18.38 0.0028 Pico-eukaryote -

A New Species of Hepatozoon (Apicomplexa: Adeleorina) from Python Regius (Serpentes: Pythonidae) and Its Experimental Transmission by a Mosquito Vector
J. Parasitol., 93(?), 2007, pp. 1189–1198 ᭧ American Society of Parasitologists 2007 A NEW SPECIES OF HEPATOZOON (APICOMPLEXA: ADELEORINA) FROM PYTHON REGIUS (SERPENTES: PYTHONIDAE) AND ITS EXPERIMENTAL TRANSMISSION BY A MOSQUITO VECTOR Michal Sloboda, Martin Kamler, Jana Bulantova´*, Jan Voty´pka*†, and David Modry´† Department of Parasitology, University of Veterinary and Pharmaceutical Sciences, Palacke´ho 1-3, 612 42 Brno, Czech Republic. e-mail: [email protected] ABSTRACT: Hepatozoon ayorgbor n. sp. is described from specimens of Python regius imported from Ghana. Gametocytes were found in the peripheral blood of 43 of 55 snakes examined. Localization of gametocytes was mainly inside the erythrocytes; free gametocytes were found in 15 (34.9%) positive specimens. Infections of laboratory-reared Culex quinquefasciatus feeding on infected snakes, as well as experimental infection of juvenile Python regius by ingestion of infected mosquitoes, were performed to complete the life cycle. Similarly, transmission to different snake species (Boa constrictor and Lamprophis fuliginosus) and lizards (Lepidodactylus lugubris) was performed to assess the host specificity. Isolates were compared with Hepatozoon species from sub-Saharan reptiles and described as a new species based on the morphology, phylogenetic analysis, and a complete life cycle. Hemogregarines are the most common intracellular hemo- 3 genera (Telford et al., 2004). Low host specificity of Hepa- parasites found in reptiles. The Hemogregarinidae, Karyolysi- tozoon spp. is supported by experimental transmissions between dae, and Hepatozoidae are distinguished based on the different snakes from different families. Ball (1967) observed experi- developmental patterns in definitive (invertebrate) hosts oper- mental parasitemia with Hepatozoon rarefaciens in the Boa ating as vectors; all 3 families have heteroxenous life cycles constrictor (Boidae); the vector was Culex tarsalis, which had (Telford, 1984). -
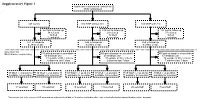
Supplementary Figure 1 Multicenter Randomised Control Trial 2746 Randomised
Supplementary Figure 1 Multicenter randomised control trial 2746 randomised 947 control 910 MNP without zinc 889 MNP with zinc 223 lost to follow up 219 lost to follow up 183 lost to follow up 34 refused 29 refused 37 refused 16 died 12 died 9 died 3 excluded 4 excluded 1 excluded 671 in follow-up 646 in follow-up 659 in follow-up at 24mo of age at 24mo of age at 24mo of age Selection for Microbiome sequencing 516 paired samples unavailable 469 paired samples unavailable 497 paired samples unavailable 69 antibiotic use 63 antibiotic use 67 antibiotic use 31 outside of WLZ criteria 37 outside of WLZ criteria 34 outside of WLZ criteria 6 diarrhea last 7 days 2 diarrhea last 7 days 7 diarrhea last 7 days 39 WLZ > -1 at 24 mo 10 WLZ < -2 at 24mo 58 WLZ > -1 at 24 mo 17 WLZ < -2 at 24mo 48 WLZ > -1 at 24 mo 8 WLZ < -2 at 24mo available for selection available for selection available for selection available for selection available for selection1 available for selection1 14 selected 10 selected 15 selected 14 selected 20 selected1 7 selected1 1 Two subjects (one in the reference WLZ group and one undernourished) had, at 12 months, no diarrhea within 1 day of stool collection but reported diarrhea within 7 days prior. Length, cm kg Weight, Supplementary Figure 2. Length (left) and weight (right) z-scores of children recruited into clinical trial NCT00705445 during the first 24 months of life. Median and quantile values are shown, with medians for participants profiled in current study indicated by red (undernourished) and black (reference WLZ) lines. -

Redalyc.Protozoan Infections in Farmed Fish from Brazil: Diagnosis
Revista Brasileira de Parasitologia Veterinária ISSN: 0103-846X [email protected] Colégio Brasileiro de Parasitologia Veterinária Brasil Laterça Martins, Mauricio; Cardoso, Lucas; Marchiori, Natalia; Benites de Pádua, Santiago Protozoan infections in farmed fish from Brazil: diagnosis and pathogenesis. Revista Brasileira de Parasitologia Veterinária, vol. 24, núm. 1, enero-marzo, 2015, pp. 1- 20 Colégio Brasileiro de Parasitologia Veterinária Jaboticabal, Brasil Available in: http://www.redalyc.org/articulo.oa?id=397841495001 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Review Article Braz. J. Vet. Parasitol., Jaboticabal, v. 24, n. 1, p. 1-20, jan.-mar. 2015 ISSN 0103-846X (Print) / ISSN 1984-2961 (Electronic) Doi: http://dx.doi.org/10.1590/S1984-29612015013 Protozoan infections in farmed fish from Brazil: diagnosis and pathogenesis Infecções por protozoários em peixes cultivados no Brasil: diagnóstico e patogênese Mauricio Laterça Martins1*; Lucas Cardoso1; Natalia Marchiori2; Santiago Benites de Pádua3 1Laboratório de Sanidade de Organismos Aquáticos – AQUOS, Departamento de Aquicultura, Universidade Federal de Santa Catarina – UFSC, Florianópolis, SC, Brasil 2Empresa de Pesquisa Agropecuária e Extensão Rural de Santa Catarina – Epagri, Campo Experimental de Piscicultura de Camboriú, Camboriú, SC, Brasil 3Aquivet Saúde Aquática, São José do Rio Preto, SP, Brasil Received January 19, 2015 Accepted February 2, 2015 Abstract The Phylum Protozoa brings together several organisms evolutionarily different that may act as ecto or endoparasites of fishes over the world being responsible for diseases, which, in turn, may lead to economical and social impacts in different countries. -

Haemocystidium Spp., a Species Complex Infecting Ancient Aquatic Turtles of the Family Podocnemididae First Report of These
IJP: Parasites and Wildlife 10 (2019) 299–309 Contents lists available at ScienceDirect IJP: Parasites and Wildlife journal homepage: www.elsevier.com/locate/ijppaw Haemocystidium spp., a species complex infecting ancient aquatic turtles of the family Podocnemididae: First report of these parasites in Podocnemis T vogli from the Orinoquia Leydy P. Gonzáleza,b, M. Andreína Pachecoc, Ananías A. Escalantec, Andrés David Jiménez Maldonadoa,d, Axl S. Cepedaa, Oscar A. Rodríguez-Fandiñoe, ∗ Mario Vargas‐Ramírezd, Nubia E. Mattaa, a Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá, Carrera 30 No 45-03, Bogotá, Colombia b Instituto de Biotecnología, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá, Carrera 30 No 45-03, Bogotá, Colombia c Department of Biology/Institute for Genomics and Evolutionary Medicine (iGEM), Temple University, Philadelphia, PA, USA d Instituto de Genética, Universidad Nacional de Colombia, Sede Bogotá, Carrera 30 No 45-03, Bogotá, Colombia e Fundación Universitaria-Unitrópico, Dirección de Investigación, Grupo de Investigación en Ciencias Biológicas de la Orinoquía (GINBIO), Colombia ARTICLE INFO ABSTRACT Keywords: The genus Haemocystidium was described in 1904 by Castellani and Willey. However, several studies considered Haemoparasites it a synonym of the genera Plasmodium or Haemoproteus. Recently, molecular evidence has shown the existence Reptile of a monophyletic group that corresponds to the genus Haemocystidium. Here, we further explore the clade Simondia Haemocystidium spp. by studying parasites from Testudines. A total of 193 individuals belonging to six families of Chelonians Testudines were analyzed. The samples were collected in five localities in Colombia: Casanare, Vichada, Arauca, Colombia Antioquia, and Córdoba. From each individual, a blood sample was taken for molecular analysis, and peripheral blood smears were made, which were fixed and subsequently stained with Giemsa.