Die Wildbienen Und Wespen Schleswig-Holsteins – Rote Liste
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-
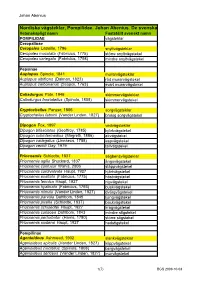
Nordiska Vägsteklar, Pompilidae. Johan Abenius. De Svenska
Johan Abenius Nordiska vägsteklar, Pompilidae. Johan Abenius. De svenska namnen fastställda av Kommittén för svenska djurnamn 100825 Vetenskapligt namn Fastställt svenskt namn POMPILIDAE vägsteklar Ceropalinae Ceropales Latreille, 1796 snyltvägsteklar Ceropales maculata (Fabricius, 1775) större snyltvägstekel Ceropales variegata (Fabricius, 1798) mindre snyltvägstekel Pepsinae Auplopus Spinola, 1841 murarvägsteklar Auplopus albifrons (Dalman, 1823) röd murarvägstekel Auplopus carbonarius (Scopoli, 1763) svart murarvägstekel Caliadurgus Pate, 1946 skimmervägsteklar Caliadurgus fasciatellus (Spinola, 1808) skimmervägstekel Cryptocheilus Panzer, 1806 sorgvägsteklar Cryptocheilus fabricii (Vander Linden, 1827) brokig sorgvägstekel Dipogon Fox, 1897 vedvägsteklar Dipogon bifasciatus (Geoffroy, 1785) björkvägstekel Dipogon subintermedius (Magretti, 1886) ekvägstekel Dipogon variegatus (Linnaeus, 1758) aspvägstekel Dipogon vechti Day, 1979 tallvägstekel Priocnemis Schiødte, 1837 sågbensvägsteklar Priocnemis agilis Shuckard, 1837 ängsvägstekel Priocnemis confusor Wahis, 2006 stäppvägstekel Priocnemis cordivalvata Haupt, 1927 hjärtvägstekel Priocnemis exaltata (Fabricius, 1775) höstvägstekel Priocnemis fennica Haupt, 1927 nipvägstekel Priocnemis hyalinata (Fabricius, 1793) buskvägstekel Priocnemis minuta (Vander Linden, 1827) dvärgvägstekel Priocnemis parvula Dahlbom, 1845 ljungvägstekel Priocnemis pusilla (Schiødte, 1837) backvägstekel Priocnemis schioedtei Haupt, 1927 kragvägstekel Priocnemis coriacea Dahlbom, 1843 mindre stigstekel Priocnemis -

Pohoria Burda Na Dostupných Historických Mapách Je Aj Cieľom Tohto Príspevku
OCHRANA PRÍRODY NATURE CONSERVATION 27 / 2016 OCHRANA PRÍRODY NATURE CONSERVATION 27 / 2016 Štátna ochrana prírody Slovenskej republiky Banská Bystrica Redakčná rada: prof. Dr. Ing. Viliam Pichler doc. RNDr. Ingrid Turisová, PhD. Mgr. Michal Adamec RNDr. Ján Kadlečík Ing. Marta Mútňanová RNDr. Katarína Králiková Recenzenti čísla: RNDr. Michal Ambros, PhD. Mgr. Peter Puchala, PhD. Ing. Jerguš Tesák doc. RNDr. Ingrid Turisová, PhD. Zostavil: RNDr. Katarína Králiková Jayzková korektúra: Mgr. Olga Majerová Grafická úprava: Ing. Viktória Ihringová Vydala: Štátna ochrana prírody Slovenskej republiky Banská Bystrica v roku 2016 Vydávané v elektronickej verzii Adresa redakcie: ŠOP SR, Tajovského 28B, 974 01 Banská Bystrica tel.: 048/413 66 61, e-mail: [email protected] ISSN: 2453-8183 Uzávierka predkladania príspevkov do nasledujúceho čísla (28): 30.9.2016. 2 \ Ochrana prírody, 27/2016 OCHRANA PRÍRODY INŠTRUKCIE PRE AUTOROV Vedecký časopis je zameraný najmä na publikovanie pôvodných vedeckých a odborných prác, recenzií a krátkych správ z ochrany prírody a krajiny, resp. z ochranárskej biológie, prioritne na Slovensku. Príspevky sú publikované v slovenskom, príp. českom jazyku s anglickým súhrnom, príp. v anglickom jazyku so slovenským (českým) súhrnom. Členenie príspevku 1) názov príspevku 2) neskrátené meno autora, adresa autora (vrátane adresy elektronickej pošty) 3) názov príspevku, abstrakt a kľúčové slová v anglickom jazyku 4) úvod, metodika, výsledky, diskusia, záver, literatúra Ilustrácie (obrázky, tabuľky, náčrty, mapky, mapy, grafy, fotografie) • minimálne rozlíšenie 1200 x 800 pixelov, rozlíšenie 300 dpi (digitálna fotografia má väčšinou 72 dpi) • každá ilustrácia bude uložená v samostatnom súbore (jpg, tif, bmp…) • používajte kilometrovú mierku, nie číselnú • mapy vytvorené v ArcView je nutné vyexportovať do formátov tif, jpg,.. -

Bumblebees' Bombus Impatiens
Bumblebees’ Bombus impatiens (Cresson) Learning: An Ecological Context by Hamida B. Mirwan A Thesis Presented to The University of Guelph In partial fulfillment of requirements for the degree of Doctor of Philosophy in School of Environmental Biology Guelph, Ontario, Canada © Hamida B. Mirwan, August, 2014 ABSTRACT BUMBLEBEES’ BOMBUS IMPATIENS (CRESSON) LEARNING: AN ECOLOGICAL CONTEXT Hamida B. Mirwan Co-Advisors: University of Guelph, 2014 Professors Peter G. Kevan & Jonathan Newman The capacities of the bumblebee, Bombus impatiens (Cresson), for learning and cognition were investigated by conditioning with increasingly complex series of single or multiple tasks to obtain the reinforcer (50% sucrose solution). Through operant conditioning, bumblebees could displace variously sized combinations of caps, rotate discs through various arcs (to 180°), and associate rotation direction with colour (white vs. yellow). They overcame various tasks through experience, presumably by shaping and scaffold learning. They showed incremental learning, if they had progressed through a series of easier tasks, single caps with increasing displacement complexity (to left, right, or up) or of balls with increasing masses, but could not complete the most difficult task de novo. They learned to discriminate the number of objects in artificial flower patches with one to three nectary flowers presented simultaneously in three compartments, and include chain responses with three other tasks: sliding doors, lifting caps, and rotating discs presented in fixed order. Pattern recognition and counting are parts of the foraging strategies of bumblebees. Multiple turn mazes, with several dead ends and minimal visual cues, were used to test the abilities of bumblebees to navigate by walking and remember routes after several days. -

ATBI De La Réserve Intégrale De Lauvitel
A.T.B.I de la Réserve intégrale de Lauvitel (Le Bourg d’Oisans, Isère) © Yann Baillet / Association Flavia ADE État des lieux des connaissances au 1e janvier 2019 Jérôme FORÊT, Manon BASSET & Rémy MOINE Parc national des Écrins / Service scientifique Le Bourg d’Oisans, 23/01/2019 Table des matières A.T.B.I du Lauvitel, vers un inventaire généralisé de la biodiversité.....................................3 Présentation synthétique des résultats..................................................................................4 1. Aculéates (guêpes, abeilles, fourmis)................................................................................6 2. Coléoptères......................................................................................................................10 3. Papillons...........................................................................................................................14 4. Orthoptères......................................................................................................................20 5. Syrphes............................................................................................................................22 6. Araignées (Araneae)........................................................................................................25 7. Opilions............................................................................................................................27 8. Chilopodes (mille-pattes).................................................................................................29 -

Wildlife Review Cover Image: Hedgehog by Keith Kirk
Dumfries & Galloway Wildlife Review Cover Image: Hedgehog by Keith Kirk. Keith is a former Dumfries & Galloway Council ranger and now helps to run Nocturnal Wildlife Tours based in Castle Douglas. The tours use a specially prepared night tours vehicle, complete with external mounted thermal camera and internal viewing screens. Each participant also has their own state- of-the-art thermal imaging device to use for the duration of the tour. This allows participants to detect animals as small as rabbits at up to 300 metres away or get close enough to see Badgers and Roe Deer going about their nightly routine without them knowing you’re there. For further information visit www.wildlifetours.co.uk email [email protected] or telephone 07483 131791 Contributing photographers p2 Small White butterfly © Ian Findlay, p4 Colvend coast ©Mark Pollitt, p5 Bittersweet © northeastwildlife.co.uk, Wildflower grassland ©Mark Pollitt, p6 Oblong Woodsia planting © National Trust for Scotland, Oblong Woodsia © Chris Miles, p8 Birdwatching © castigatio/Shutterstock, p9 Hedgehog in grass © northeastwildlife.co.uk, Hedgehog in leaves © Mark Bridger/Shutterstock, Hedgehog dropping © northeastwildlife.co.uk, p10 Cetacean watch at Mull of Galloway © DGERC, p11 Common Carder Bee © Bob Fitzsimmons, p12 Black Grouse confrontation © Sergey Uryadnikov/Shutterstock, p13 Black Grouse male ©Sergey Uryadnikov/Shutterstock, Female Black Grouse in flight © northeastwildlife.co.uk, Common Pipistrelle bat © Steven Farhall/ Shutterstock, p14 White Ermine © Mark Pollitt, -

Final Report 1
Sand pit for Biodiversity at Cep II quarry Researcher: Klára Řehounková Research group: Petr Bogusch, David Boukal, Milan Boukal, Lukáš Čížek, František Grycz, Petr Hesoun, Kamila Lencová, Anna Lepšová, Jan Máca, Pavel Marhoul, Klára Řehounková, Jiří Řehounek, Lenka Schmidtmayerová, Robert Tropek Březen – září 2012 Abstract We compared the effect of restoration status (technical reclamation, spontaneous succession, disturbed succession) on the communities of vascular plants and assemblages of arthropods in CEP II sand pit (T řebo ňsko region, SW part of the Czech Republic) to evaluate their biodiversity and conservation potential. We also studied the experimental restoration of psammophytic grasslands to compare the impact of two near-natural restoration methods (spontaneous and assisted succession) to establishment of target species. The sand pit comprises stages of 2 to 30 years since site abandonment with moisture gradient from wet to dry habitats. In all studied groups, i.e. vascular pants and arthropods, open spontaneously revegetated sites continuously disturbed by intensive recreation activities hosted the largest proportion of target and endangered species which occurred less in the more closed spontaneously revegetated sites and which were nearly absent in technically reclaimed sites. Out results provide clear evidence that the mosaics of spontaneously established forests habitats and open sand habitats are the most valuable stands from the conservation point of view. It has been documented that no expensive technical reclamations are needed to restore post-mining sites which can serve as secondary habitats for many endangered and declining species. The experimental restoration of rare and endangered plant communities seems to be efficient and promising method for a future large-scale restoration projects in abandoned sand pits. -

Redalyc.CLEPTOPARASITE BEES, with EMPHASIS on THE
Acta Biológica Colombiana ISSN: 0120-548X [email protected] Universidad Nacional de Colombia Sede Bogotá Colombia ALVES-DOS-SANTOS, ISABEL CLEPTOPARASITE BEES, WITH EMPHASIS ON THE OILBEES HOSTS Acta Biológica Colombiana, vol. 14, núm. 2, 2009, pp. 107-113 Universidad Nacional de Colombia Sede Bogotá Bogotá, Colombia Available in: http://www.redalyc.org/articulo.oa?id=319027883009 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Acta biol. Colomb., Vol. 14 No. 2, 2009 107 - 114 CLEPTOPARASITE BEES, WITH EMPHASIS ON THE OILBEES HOSTS Abejas cleptoparásitas, con énfasis en las abejas hospederas coletoras de aceite ISABEL ALVES-DOS-SANTOS1, Ph. D. 1Departamento de Ecologia, IBUSP. Universidade de São Paulo, Rua do Matão 321, trav 14. São Paulo 05508-900 Brazil. [email protected] Presentado 1 de noviembre de 2008, aceptado 1 de febrero de 2009, correcciones 7 de julio de 2009. ABSTRACT Cleptoparasite bees lay their eggs inside nests constructed by other bee species and the larvae feed on pollen provided by the host, in this case, solitary bees. The cleptoparasite (adult and larvae) show many morphological and behavior adaptations to this life style. In this paper I present some data on the cleptoparasite bees whose hosts are bees specialized to collect floral oil. Key words: solitary bee, interspecific interaction, parasitic strategies, hospicidal larvae. RESUMEN Las abejas Cleptoparásitas depositan sus huevos en nidos construídos por otras especies de abejas y las larvas se alimentan del polen que proveen las hospederas, en este caso, abejas solitarias. -

Hymenoptera: Aculeata) Jizerských Hor a Frýdlantska
Sborník Severočeského Muzea, Přírodní Vědy, Liberec, 27: 239 – 276, 2009 ISBN 978-80-87266-01-4 Žahadloví blanokřídlí (Hymenoptera: Aculeata) Jizerských hor a Frýdlantska Aculeata (Hymenoptera) of the Jizerské hory Mts and Frýdlant region (northern Bohemia, Czech Republic) Jakub STRAKA1), Libor Dvořák2) & Petr BOGUSCH3) 1) Katedra zoologie, Přírodovědecká fakulta, Univerzita Karlova, Viničná 7, CZ – 128 44 Praha 2; e-mail: [email protected] 2) Správa NP a CHKO Šumava, Sušická 399, CZ – 341 92 Kašperské Hory; e-mail: [email protected] 3) Katedra biologie, Pedagogická fakulta, Univerzita Hradec Králové, Rokitanského 62, CZ – 503 00 Hradec Králové; e-mail: [email protected] Abstract. The list of 279 species of aculeate Hymenoptera from the Jizerské hory Mts and Frýdlant region is presented. Altogether 13 critically endangered species, 22 endangered species, and 27 vulnerable species of the Czech Republic were found. The findings of Andrena tarsata Nylander, 1848, Anoplius tenuicornis (Tournier, 1889), Anthocopa villosa (Schenck, 1853), Crabro lapponicus Zetterstedt, 1838, Crossocerus walkeri (Shuckard, 1837), Dryudella femoralis (Moscary, 1877), Evagetes alamannicus (Blüthgen, 1944), Hylaeus annulatus (Lin- naeus, 1758), H. gracilicornis (Morawitz, 1867), Passaloecus monilicornis Dahlbom, 1842, Sphecodes spinulosus Hagens, 1875, Lasioglossum subfulvicorne austriacum Ebmer, 1973, and Mimumesa beaumonti (Van Lith, 1949) are of high faunistic importance. Key words: Hymenoptera, Aculeata, Jizerské hory Mts, Frýdlant region, faunistics, biology ÚVOD Žahadloví blanokřídlí (Hymenoptera: Aculeata) patří mezi velmi početné a ekonomicky významné skupiny hmyzu. Patří k nim význační opylovači (včely – Apoidea) i predátoři (sršni a vosy – Vespidae). V poslední době se ukazuje i velký význam této skupiny pro indikaci kva- lity lokalit. Řada druhů je na území České republiky buď kriticky ohrožena vyhubením, nebo jsou již považovány za regionálně vymizelé (Straka 2005a, b, c). -

2017 City of York Biodiversity Action Plan
CITY OF YORK Local Biodiversity Action Plan 2017 City of York Local Biodiversity Action Plan - Executive Summary What is biodiversity and why is it important? Biodiversity is the variety of all species of plant and animal life on earth, and the places in which they live. Biodiversity has its own intrinsic value but is also provides us with a wide range of essential goods and services such as such as food, fresh water and clean air, natural flood and climate regulation and pollination of crops, but also less obvious services such as benefits to our health and wellbeing and providing a sense of place. We are experiencing global declines in biodiversity, and the goods and services which it provides are consistently undervalued. Efforts to protect and enhance biodiversity need to be significantly increased. The Biodiversity of the City of York The City of York area is a special place not only for its history, buildings and archaeology but also for its wildlife. York Minister is an 800 year old jewel in the historical crown of the city, but we also have our natural gems as well. York supports species and habitats which are of national, regional and local conservation importance including the endangered Tansy Beetle which until 2014 was known only to occur along stretches of the River Ouse around York and Selby; ancient flood meadows of which c.9-10% of the national resource occurs in York; populations of Otters and Water Voles on the River Ouse, River Foss and their tributaries; the country’s most northerly example of extensive lowland heath at Strensall Common; and internationally important populations of wetland birds in the Lower Derwent Valley. -

JNCC Coastal Directories Project Team
Coasts and seas of the United Kingdom Region 11 The Western Approaches: Falmouth Bay to Kenfig edited by J.H. Barne, C.F. Robson, S.S. Kaznowska, J.P. Doody, N.C. Davidson & A.L. Buck Joint Nature Conservation Committee Monkstone House, City Road Peterborough PE1 1JY UK ©JNCC 1996 This volume has been produced by the Coastal Directories Project of the JNCC on behalf of the project Steering Group and supported by WWF-UK. JNCC Coastal Directories Project Team Project directors Dr J.P. Doody, Dr N.C. Davidson Project management and co-ordination J.H. Barne, C.F. Robson Editing and publication S.S. Kaznowska, J.C. Brooksbank, A.L. Buck Administration & editorial assistance C.A. Smith, R. Keddie, J. Plaza, S. Palasiuk, N.M. Stevenson The project receives guidance from a Steering Group which has more than 200 members. More detailed information and advice came from the members of the Core Steering Group, which is composed as follows: Dr J.M. Baxter Scottish Natural Heritage R.J. Bleakley Department of the Environment, Northern Ireland R. Bradley The Association of Sea Fisheries Committees of England and Wales Dr J.P. Doody Joint Nature Conservation Committee B. Empson Environment Agency Dr K. Hiscock Joint Nature Conservation Committee C. Gilbert Kent County Council & National Coasts and Estuaries Advisory Group Prof. S.J. Lockwood MAFF Directorate of Fisheries Research C.R. Macduff-Duncan Esso UK (on behalf of the UK Offshore Operators Association) Dr D.J. Murison Scottish Office Agriculture, Environment & Fisheries Department Dr H.J. Prosser Welsh Office Dr J.S. -

Volume 2. Animals
AC20 Doc. 8.5 Annex (English only/Seulement en anglais/Únicamente en inglés) REVIEW OF SIGNIFICANT TRADE ANALYSIS OF TRADE TRENDS WITH NOTES ON THE CONSERVATION STATUS OF SELECTED SPECIES Volume 2. Animals Prepared for the CITES Animals Committee, CITES Secretariat by the United Nations Environment Programme World Conservation Monitoring Centre JANUARY 2004 AC20 Doc. 8.5 – p. 3 Prepared and produced by: UNEP World Conservation Monitoring Centre, Cambridge, UK UNEP WORLD CONSERVATION MONITORING CENTRE (UNEP-WCMC) www.unep-wcmc.org The UNEP World Conservation Monitoring Centre is the biodiversity assessment and policy implementation arm of the United Nations Environment Programme, the world’s foremost intergovernmental environmental organisation. UNEP-WCMC aims to help decision-makers recognise the value of biodiversity to people everywhere, and to apply this knowledge to all that they do. The Centre’s challenge is to transform complex data into policy-relevant information, to build tools and systems for analysis and integration, and to support the needs of nations and the international community as they engage in joint programmes of action. UNEP-WCMC provides objective, scientifically rigorous products and services that include ecosystem assessments, support for implementation of environmental agreements, regional and global biodiversity information, research on threats and impacts, and development of future scenarios for the living world. Prepared for: The CITES Secretariat, Geneva A contribution to UNEP - The United Nations Environment Programme Printed by: UNEP World Conservation Monitoring Centre 219 Huntingdon Road, Cambridge CB3 0DL, UK © Copyright: UNEP World Conservation Monitoring Centre/CITES Secretariat The contents of this report do not necessarily reflect the views or policies of UNEP or contributory organisations. -

The Hymenoptera Collections of Williamedwardshuckard and the Dispersal of His Type Material
View metadata, citation and similar papers at core.ac.uk brought to you by CORE provided by Beiträge zur Entomologie = Contributions to Entomology... Beitr. Ent. Berlin ISSN 0005-805X 48 (1998) 1 S. 157-174 31.03.1998 The Hymenoptera collections of William Edward Shuckard and the dispersal of his type material With 1 figure D o n a ld B. B a k er Summary An inquiry is made into the dispersal of the Hymenoptera collections formed by WILLIAM EDWARD Shuckard and the survival of his type material. Zusammenfassung Untersucht wird der Verbleib der Hymenopteren-Sammlungen von WILLIAM EDWARD SHUCKARD und seines Typenmaterials. Additional key words T. Desvignes - W.H.L. Walcott - W.W. Saunders - E. Saunders - Hope Entomological Collections, Oxford - Natural History Museum, London - dispersal of some 19th Century entomological collections List of headings Introduction: W illiam Edward Shuckard (1803-1868)........................................................................... 158 Shuckard’s publications on the Hymenoptera:.......................................................................................... 158 Taxonomy: Hymenoptera other than bees................................................................................................. 158 The British Bees, 1866.................................................................................................................................. 159 The dispersal of Shuckard’s Hymenoptera collections.............................................................................. 159 The